Способ получения 6, 6, 9 -трифторпрегнанов
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 492079
Автор: Ричард
Текст
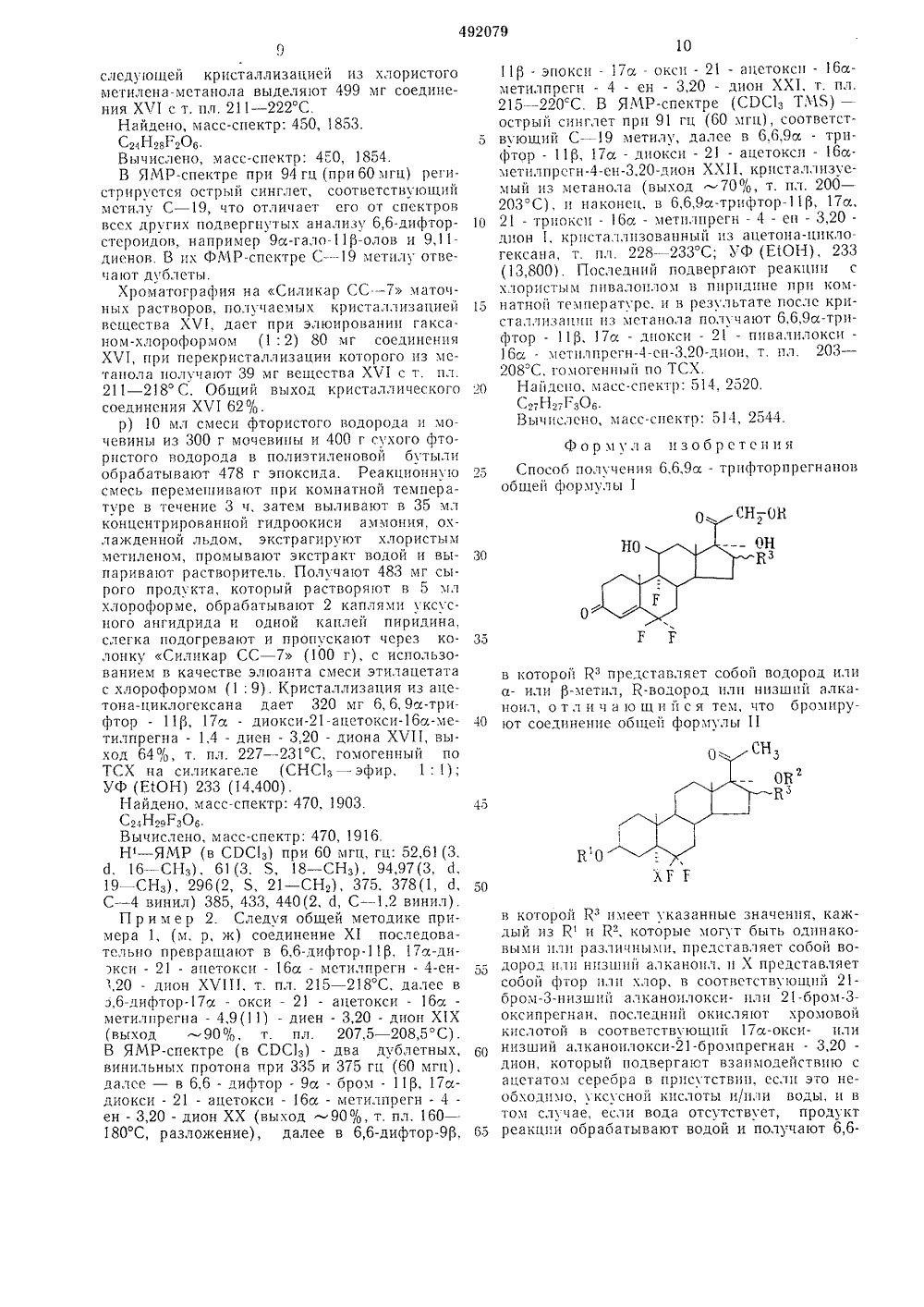
(111 492079 Союз Советских Социалистических Республик(22) Заявлено 22.04.71 (21) 164908823-4 51) М. Кл. С 07 с 169/30 3) Приорит1) 31002 32) 22.04 Государственный комитет Совета Министров СССР по делам изобретенийи открытий ШЛ бликовано 15.11.75. Бюллетснь Ле 42а опубликования описания 04.05.76 3) УДК 547,689,6,07(72) Лвторы изобретсю Ипостра чард Меррилл(СШЛ) Иностранная юпон де Нем(54) СПОС асти получени фторпрегнано ичсской акти лучения 6-6-дифторпрсгнем фторирования с по- истой серы 3-ацетоксидов с последующим ввсровки известными спосо 0 ,1, зОВ 10 ый в известном нен в слчас звычайно легко ризации в кисВО 5 чить фтор- гичеоляст пол 6,6,9 а-три ой физиол 6,6,9 а-тр олучен рмулы- ОВ2 Изобретение относится к обл новых производных 6,6,9 а-тр обладающих высокой физиоло н остью. Известен способ по 4-сн,20 - диона пут мощью четырехфтор 5 а-фтор-кетостерои дением 3-кетогруппи бами. Однако процесс, описываем способе, не может быть приме 17 а,21 - диоксистероидов, чрс подвергающихся Й-гомоизоме лых и щелочных условиях. Предлагаемый способ позв новые, не описанные ранее прегнаны, обладающие высок ской активностью. Описывают способ п фторпрегнанов общей фои которой К представ.,яст собой водород ила - или рз-мстил, К водород или низший аканоил, зак,.кгчаюи,яйся в том, что бромирчсоединение общей формулы 11 в которой Кз имеет указанные значения, каждый из К и К- которые могут быть одинаковыми или различными, представляет собой во дород илп низв 1 иЙ алкапоил, и Х представляет собой фтор или хлор в соотвстствующий 21-бром-низший алканоилокси- илп 21-бром- З-оксипрсгпан, послслпгй 1 окисляют хромовой кислотой в соответствующий 17 а-окси- илп 25 низший алканоилокси-бромпрегнан,20 лион, который подвергают взаимодействию с ацстатом серебра в присутствии, если это необходимо, уксусной кислоты иили воды, и в том случас, если вода отсутствует, продукт ЗО реакции обраоатывают водой и получают 6,6 дифтор-ацстоксиа - оксипрегн - 4 - ен3,20-дион, в котором по усмотрению гидролизуют 21-ацетоксигруппу и подвергают полученное соединение микробиологическою окислению по Сп, затем ацетилируют 21-оксигруппу и дегидрируют образующееся соединение вЛ "-стероид, взаимодействием которого сбромноватистой кислотой получают 9 к-бром 11 р-оксистероид, последний обрабатывают основанием и образующийся при этом 9,1-эпоксид подвергают взаимодействию с фтористоводородной кислотой и выделяют целевой продукт известными приемами.Бромирование 21-метильной группы проводят предпочтительно в растворе диоксана, таккак в его присутствии окисление 3-оксигруппыбромом минимально, при температуре предпочтительно не выше 75 С,Окисление 21-бром - 3 - оксистероида производят предпочтительно водной хромовойкислотой в смешивающемся с водой эфире иликетоне, например диоксане, тетрагидрофуранеили метилэтпловом кетоне, предпочтительнопри комнатной температуре или ниже,Ацетоксилирование 21-положения проводятсмесью апетата натрия и ацетата серебра вовлажной уксусной кислоте прн предпочтительном соотношении количеств соли серебра и21-бромстероида 1: 1 и предпочтительно притемпературе кипения растворителя. Гидролиз21-ацетокснгруппы проводят обычными способами, например с помощью карбоната натрияили калия, предпочтительно при комнатнойтемпер атуре.Микробиологическое гидроксилированиеосуществляется известным способом с помощью культур Снгюл 1 аг 1 а 11 па 1 а или Сигп 1 аг 1 а р а 11 езсепз.Введение Лд-связи осуществляется послеацетилирования 21-оксигруппы действием Кбромацетамида, двуокиси серы и пиридина.Пример 1, а) Смесь 1 л пиридина и325 г 313, 1 сс-диоксисх-метилпрегн-енона обрабатывают через капельную воронкууксусным ангидридом (200 мл), нагревают до65 - 70 С, выдерживают при этой температурев течение 4 ч, охлаждают до комнатной температуры и выливают при сильном перемешивапии в 6 л воды. Через полчаса твердое вещество отфильтровывают и тщательно промывают чистой водой и высушивают до постоянного веса в вакууме при 110 - 120 С. Получают 350 г 1 а-окси-ЗД-ацетоксисс-метилпрегн 5-ен-он (П 1) с выходом 94%. ПМР (СВСз,ГМ 5) при 60 мгц, гц: 322 (широкая полоса, 1," - 6 винил), 134 (Я, 3 С - 21 СН,), 121 (5,3,ОАС), 61(3, 5, С - 19 СНз), 54(3, с 1, 1=7 гц,С - 16 СНз), 48(3, Я, С - 18 СНз).б) К смеси 120 г гидрата паратолуолсульфокислоты в 1 л уксусного ангидрида прибавляют 200 г моноацетата 111. Смесь перемешивают при комнатной температуре в течение3 - 5 ч. Ацетилирование при более высокойтемпературе или более продолжительное время (более 5 ч), способствует нежелательнойР-гомоизомсризации стероида. Реакционную смесь выливают при псремешиваппи в о л ды и по мсрс надобности охлая,"дают льдом так, чтобы температура нс превышала 40"С. После перемешивания в течение 4 ч воду дскантируют с твердого вещества, и заменяют чистой водой.Спустя еще 1 ч твердое вещество отфильтровывают, растворяют в 1,5 л хлористого метилена, промыва 1 от последовательно насьпцен 10 ным водным раствором бикарбоната натрия ихлористого натрия и высушивают над М 1 д 50 ьПолуча 1 от 31 з, 1 а-диацетоксиба-метилпрегн-ен-он 1 Ч (164 г, выход 67%), т. пл.173 С (метанол ЯМР Н(С 1 ЭС 1 з, ТМ 5) при15 60 мгц, гц: 326 (широкая полоса, 1, С - 6 винил), 130(5, 3, С - 21 СН,), 122(Я при 500 гц5. й., 6, С - 3 и С - 17 ОАс), 62(Я, 3, С - 19СНз), 54(с 1, 3, 1=7 гц, С - 16 СНз), 42(8 3,С - 18 СНз)20 в) Смесь 75 г диацетата, 300 мл хлористогометилена и 1 О г сухого фтористого натрия вполиэтиленовой бутыли продувают азотом через полиэтиленовый барботер, а затем в перемешиваемую смесь вводят 24 - 27 г фтористо 25 го нитрозила при барботировапии в течениеб - 8 ч. Реакционную смесь продувают азотом,разоавляют дополнительным количеством хлористого метилена и промывают последовательно насыщенным раствором бикарбопата нат 30 рия и хлористого натрия. Раствор затем выпаривают и в результате получа 1 от сырой 6-нитримино-ЗД, 1 а - диацетокси - 5 и - фтораметилпрегнан-оп 17 а, который в бензолевыливают на нейтральный глинозем сорта 335 (1,8 кг), элюируют бензолом (6 л). Послекристаллизации из ацетона получают 313, 17 адиацетокси - 5 а - фтор - 16 и - метилпрегнан 6,20-дион Ъ (56 г), т. пл. 254 - 257 С.ЯМР - Н (СРС 1 з, ТМ 5), при 60 мгц, гц: (5, 3,40 С - 21 СН 121(5 при 500 гц 5. %., 6, С - 3 иС - 17 ОАС), 54(с 1 1=8 гц, 3, С - 16 СНз),50(8 3, С - 19 СНз), 40(8, 3, С - 18 СНз). Соединение И идентично веществу, приготовленному несколько иным способом и имеющему45 приведенный ниже состав.Найдено, %: С 67,26; Н 7,95,Сз 6 Нз 71 ОзВычислено, %: С 67,1; Н 8,03,г) Раствор Фторкетона У (75 г) в 300 мл50 хлористого метилена в автоклаве на 1 л обрабатывают ,5 мл воды и охлажда 1 от смесьютвердой углекислоты и ацетона, Автоклав эвакуируют, добавляют смесь четырехфтористойсеры и фтористого водорода и перемешивают55 при 20+-1 С ь течение 10 ч. Реакционнуюсмесь промывают последовательно водой, насыщенным раствором бикарбоната натрия инасьпценным раствором хлористого натрия,высушивают над МАМБО отфильтровывают иб 0 упаривгют. В некоторых случаях полученныйЗД, 1 а - диацетоксп - 5 а, б, б - трифтораметилпрсгнап - 20 - он Л достаточно чист длянепосредственной кристаллизации из смесихлористый метилен-метанол. Чаще всего егоб 5 подвергают хроматографии на Флоризиле( - 1,35 кг). В колонку, приготовленную в гексаце, вводят раствор стероида в бецзоле и элюируют гексаном (2 л), затем смесьо 5%- ного ацетона в гексаце (2 л), и затем смесь 0 20%-ного ацетона в гексане (15 л). Фракции объединяют на основании данных ЯМР. Обычно элюируемое вещество имеет большое содержание 0-гомотрифторстероида (отсутствуют С - 18 СН, при 43 гц и С - 21 СН, при 131 гц, 60 мгц ЯМР. Умеренные количества такого стероцда легко удалгнот цз вещества 11 кристаллизацией из хлористого метиленаметанола, поскольку первый легко растворяется в метаноле,Большую часть соединения 11 элюируют смесью 20% -ного ацетона в гексане. Небольшое количество исходного фторкетона Ч элюируют в последних фракциях. Кристаллизация из хлористого метилена-метанола дает соединение Ч 1 (25 - 40 г, выход 33 - 53%, т, пл.263 С), ЯМР(СВС 1 з, ТМ 5), прц 60 мгц, гц: (Я, 3, ОЛС), 121(5, 3, ОАС, 131(5, 3, С - 21 СНз), 61., 64. 67(1, 3, С - 19 СНз расщепленное Г), 54 (с 1, 1=7 гц, 3, С - 16 СНз), 43 (8, 3, С - 18 СНз). Полученное таким образом вещество Л идентично веществу, приготовленному в подобных условиях, и имеющему прцведснный ниже анализ.Найдено, %: С 64,10; Н 7,51; Г 11,58, СззНз 7 ГзОзВычислено, %. С 64,1; Н 7,68; Г 11,7.д) Раствор Зр, 17 а-диацетоксиа, 6, 6-трифтора-метилпрегнан-она (трифторстероид И. 50 г) в тетрагидрофуране 450 мл) добавляют при перемешивании под азотом к смеси 1 н. раствора КЯОН (112 мл) и метанола (300 мл). Суспензию перемешивают в атмосфере азота в течение 18 - 24 ч прц комнатной температуре, Через 1 ч раствор становится прозрачным, его концентрируют в вакууме приблизительно до 300 мл, выливают в воду и экстр агируют несколько раз этилацетатом, экстракт промывают 5%-цым раствором бикарбоната цятрия, затем водой, высушивают и упаривают. После кристаллизации из ацетона-гексаца и сушки в вакууме прц 60 С получают белое твердое вещество Зр-оксиа-ацетоксиа-метила, 6, 6-трпфторпрегнан- он 11 (44 г. выход 96%, т. пл. 211 - 215 С), ЯМР подтвегждяет структуру.Найдено, %: С 64,62; Н 7,36; Г 16,80.С НзГзОВычислено, %: С 64,8; Н 7,95; Г 12,8.е) Раствор (44 г) монояцстата 11 в 400 мл 1 иоксаня выдерживают при 60 - 63 С, прц перемешивании прибавляют по каплям (17,7 г,5,7 мл) раствор брома в 125 мл диоесана в течение 30 - 40 мип. Несколько минут после зкончация добавления раствор показывает от,зицательный результат на влажной индикаторной йодкрахмальцой бумаге. Реакционную смесь сразу же охлажда 10 т приблизительно до 30 С и немедленно упаривяОт почти досуха в вакуу;е. Остаточць 1 ц сироп растворяют в цсоольшом количестве метанола и опять упа 5 10 15 20 7 д 30 35 40 45 50 60 65 риваот в вакууме. В результате получаюг стекловидное вещество, прц криста,пцзациц которого из метанола ( 100 мл) ц сшки в вакууме в течение 18 - 24 ч получают чистый 21 - бром - Зр - окси - 17 а - ацетоесц - 5 а, 6, 6- трифтора-метилпрегнан-он11 (37,4 г, выход 76%, т. пл. 117 - 119 С) .Соединение 111 также можно приготовить бромцрованием Зр, 17 а-дцгцетатя У 1 прп приблизительно 55 С, прц этом получают 21-бром Зр, 1 а - дцацетоксц - 5 а, 6,6 - трцфтор - 16 аметилпрегцан-он, который гцдролизу 10 Т с помогцью водного раствора хлористого водорода в метаноле.ж) 1 раствору 24 г 21-оромстероцда ".11 в 600 мл ацетона прц перемешиванш при комнатной температуре прибавляют по каплям17 мл хромОВОЙ ецслоты (смесь 26,7 г трех- окиси хрома и 23 зп концентрированной сер- нОЙ е 11 слоты 1 зязояВлч 10 т Водой до Ооъсыа 100 мл) до пояглецця легкого;и тарного цвета. Зятем смесь перемешивают в течение по;- 1 яся прц кознатвори тсмперятре, ж 1 Д 1 сость сливают с нерастворимого зеленого твердого вещества, которое смсшцвсцот с минимальным количеством волы для растворения неорганических солей, ц затем прцбавлгцот прц перемешцван:ц обратно к раствору ацетона, Через 5 мцн смесь медленно разбаВляО Водой до Объема 1,8;1, ох,1 аждают на льдровывают кристаллический дцеетоп, тщательно промывают его водой ц высуш:1 вяют в вакууме прц 60 С в течегце 24 ч. получают 21- бром - 17 а - ацетоксц - 16 а - метил - 5 а, 6, 6- трифторпрегнан - 3,20-дион 11111 (23,68 г, выход 98%). ЯМР (СВС 1 з - ТМЬ), при 60 мгц, гц: 233(Я, 2, СОСН.Вг), 130(5, 3, ОЛс), 71, 73(с 1, 3, С - 19 СНз), 57, 50 (с 1, 3, С - 16 СНз), 49(5, С - 18 СНз). Идентичное соединение, приготовленное в подобных условиях, имеет т. пл. 230 в 2 С.з) Смесь 35 г ацетата натрия, 500 мл ледяной уксусной ецслоты, 25 г ацетата серебра, 2,5 мл воды ц 25,6 г дикетоца 1 У нагревают с обратным холодильником в атмосфере азота ц в темноте в течсцце 1 ч. Получснцую черную смесь охлаждают ц отфильтровывают для удаления солей серебра. ф 1 пьтрат концентрируют в вакууме для удаления большей части уксусной кислоты. Вязкую массу твердых ве- щестВ и уесус 1 ОЙ ецслоты сменцВЗ 10 т с ВодОЙ (2 л) ц отфцльтровыва 1 от, Выдслснпый стероцд промывают водой ц рястворяОт в этилацетатс. Отфильтрованные соли ссребра тщательно прозьВЯ 1 от эппа 11 етатом, ц объединенные этцлацетатные растворы промывают взятымц в избытке насыщенным раствором бикарбоната натрия ц насыщенным раствором хлористого натрия, высушивают ц выпаривают. Остаточное твердое вещество в бензоле наносят на :Флорцзил (0,45 1 сг) ц элюцру 10 т сначала геесяном, затем смссью 20%-ного ацетона В гексяцс. ц полча 10 т после 1 срцстяллизяццц цз ацетона ц промывания небольшим ко. лцчсством холодного ацетона бесцветные иг 492079г1 О 15 20 с) 30 35 40 45 50 60 65 к) Стероид Х микробиологически гидроксилируют с помощью культуры Сцгпага и получают 6,6 - дпфтор - 11 р, 17 г 21-триокси 16 а - мстилпрегп - 4 - ец - 3,20 - дион ХЕ, т. пл.-220 С. лы 6,6 - дцфтор - 17 сс - окси - 21 - ацетокси 16 сс - мстилпрегн - 4 - ец,20-циона ЕХ (13,8 г, выход 64 ). ЯМР (СРС 1 з, ТМ) при 60 мгц; гц: 377, 373(с 1, 1, С винил), 295, 291(с 1, 2, СН.ОЛс), 128(Я, С - 21 ОЛс), 76, 74(с 1, 3, С - 19 СНз), 58, 51(с 1, 3, С - 16 СНз), 48(8, 3, С - 18 СН,), Идентичное соединение, приготовлепное в подобных условиях, имеет т. пл.213 - 215 С. УФ (ЕЕ ОН) 228(12,400); ИК (СНСз), 2,78, 2,87, 3,37, 3,47, 5,73, 5,79, 5,93.Нацдсно %: С 65,85; Н 7,48.Сз 41-ЕззЕЛзВычислено, %. С 65,6; Е 1 7,35.и) 7,05 г (51 моль) карбопатя калия в 100 мл воды обрабатывают 425 мл метанола и затем 250 мл тстрагилрофураня, нагревают с обратным холодильником при пропусканни азота в тсчецпс 1 ч, охлаждают ло комнатной температуры и атмосфере азота, и обрабатывают 21-ацетатом 1 Х (21, 95 г, 50 моль). Смесь псремешивадот пол азотом в тсчснис 2 ч при комнатной температуре. Прозрачный желтый раствор подкисляют 5 мл ледяной уксусной кислоты и концентрируют в вакууме приблизительно до 200 мл, остаток смешивают с водой и экстрагируют 600 мл хлористого мети- лена, Экстракт промывают последовательно 5 О/о-ньды раствором бпкарбсната натрия и насыщенным хлористым натрием, высушивают Ех 1 аз 504 ц концентрируют приблизительно до 300 мл. Затем мсллсцно прибавляют горячий циклогексан к кипящему хлористому метилсцу, и смесь концентрируют до объема 200 мл при продолжительном кипении и сильном псремсшивании. После охлаждения до комнатной температуры и фильтрования получают 6,6-1 дддфтор - 17 сс - 21 - диокси - 1 бс 4 - метилпрегн - 4 - сн - 3,20 - дион Х (17,2 г). Путем конддентрацни маточного раствора приблизительно до 75 мл выделяют дополнительно 1,8 г вещества Х. Общий выход 96" после супддпд в течсцие ночи при комнатной температуре в вакууме, В полученном таким образом соединении Х содержится около 1 - -3 моль циклогексяна па 1 моль стероида.После нагревания соединение Х имеет т, пл.202 - 207 С. ЯМР (СРС 1 з, ТМ 8) при 60 мгц, гц: 380, 376(сЕ, 1, С - 4 винил), 293, 274, 266, 245 (два дублета А, В 3, 2, СОСНОН), 87(8.3, 78, циклогсксац), 76, 74 (с 1, 3, С - 19 СН,), 60, 53(с 1, 3, С - 16 СНз), 48(8. 3, С - 18 СНз).Найдено, /о. С 68,62; Н 8,13; Р 8,62.Сз 2 НзоЕг 04 1/ЗСзНд 2.Вычислено, %: С 68,7; Н 9,90; Г 8,95.УФ (ЕЕОН) 228 (12500. исправленное для 1/3 моль цпклогексана), ИК(СНС 1,) 2,78, 2,89, 3, 41, 3,48, 5,96, а +1(с=-0,5 СНС 1,).Найдено, масс-спектр: 396, 2118.Вычислено, масс-спектр: 396, 2112. л) Стсроил Х 1 микробиологически дсгилрируют с помощью Аг(Едгозас 1 ег згпрех, получают 6,6-дифтор, 17 а, 21-триоксиа-мети дпрсгна,4-диен,20-дион Х 11, т. пл. - 228 С. УФ (ЕЕОН) 238 (14, 600) .м) Триол ХЕ 1 (1 г) в сухом пиридице (15 мл) в атмосфере азоты охлаждают на ледяной баце и добавляют уксусцый ангидрид (1 мл). Смесь перемешивают в течение ночи и зятем выливают в воду (200 мл), перемешивают в течение получаса и отфильтровывают осндок, промывают водой, сушат при 100 С в вакууме и получаят 6,6-дифторр, 17 сс-диоксдд-ддцстоксиба- мстилпрегна - 1,4 - дисц 3,20 - дион Х 111 (0,96 г), т. пл. 230232 С.и) 0959 г аддетята ХЕ 11 и 0,375 г перекристял:дизованного Л-бромацстамида в 11 мл сухого пирилина (выход продукта реакции зависит от степени сухости пиридина) перемешивают при комнатной температуре в течение 30 миц, затем охаждают примерно до 10 С и лооавляют небольшой избыток двуокиси серы, затем по каплям прибавляют 35 мл волы и смесь выдерживают при 5 С в течение ночи, фильтруют, промывают водой и сушат. Получают белые кристаллы 6,6-дифторсх - окси - сцетокси - 1 бс 4 - метилпрегна, 4, 9 (11) - трисц - 3,20 - диона ХЕЧ (0,769 г, выход 84%, т. пл. 15 163 С), ЯМР (СРС 1,) при 60 мгц, гц: 345 (2, д, 1=5 гц, С - 11); ТСХ (силикагель. 2: 1 СНСз - эфир), Яд=0,30.о) 1,07 г (2,5 моль) триена ХЕ/ в 50 мл лиоксапя, на солеркадддего перекиси, и 1,7 мл 0,5 и. хлорной кислоты прибавляют постепенно к 0,7 г (5,5 моль) Л-бромацетамида и кристаллизуют из хлороформа-гексана в течение - 1 ч. Через 2 ч при комнатной температуре добавляют небольшой избыток водного бикарбоната натрия и реакционную смесь экстрагирудот хлористым метиленом. Органический слой промывают 5/о -ным бикарбонатом натрия, высудпивают, выпаривают и в результате получают стекловидное вещество (1,44 г).Последнее, как было показано ЯМР- спектроскопией и ТСХ, включает 70% 9 схбром,6 - дифтор - 11 Д, 17 сс - диокси-ацетоксддх-метилпрегня - 1,4 - дисн - 3,20 - диона ХУ и 20 онеизменного вещества ХЮ. Повторная обработка дает стекловидное вещество, содержащее около 90% 9-бром-оксистероила. Это стекловидное вещество растворяют в этаноле и выпаривают досуха перед тем, как перейти к следующей стадии.п) 0,94 г бромгидрина ХЪ (9-бром-оксистсроцд) и 1,5 г сухого ацетата калия в 50 мл этанола нагревают с обратным холодильником в течение 1 ч, затем - 25 мл растворителя отгоняют при атмосферном давлении. Смесь охлаждают на льду и по каплям добавляют 75 мл воды. Твердое вещество отфильтровывают, промывают водой и высушивают при 76 С/0,1 мм рт. ст., в результате получают неочищенный 6,6-дифторз, 11 р-эпоксисс-окси - 21 - ацетокси - 16 х - метилпрегна - 1,4- диен,20-дион ХИ (758 мг, выход 95%). По 4920795 10 15 20- .ОК2 ОН у 30 35 ОВ В 45 кажнакоой вовляет й 21- юм- мовойили 3,20- вию с то неы,цв одукт т 6,6 д 0 5 следующей кристаллизацией из хлористого метилена-метанола выделяют 499 мг соединения ХИ с т. пл. 211 - 222 С.Найдено, масс-спектр: 450, 1853.С 24 Н 26 206.Вычислено, масс-спектр: 4"О, 1854.В ЯМР-спектре при 94 гц (при 60 мгц) регистрируется острый синглет, соответствуюцпй мстилу С - 19, что отличает его от спектров вссх других подвергнутых анализу 6,6-дифторстероидов, например 9 а-галор-олов и 9,11- диснов. В их ФМР-спсктре С - 19 мстилу отвечают дублеты.Хроматография на Силикар СС- - 7 маточных растворов, получаемых кристаллизацией всцества ХЧ, даст при элюировании гаксаном-хлороформом (1: 2) 80 мг соединения ХИ, при перекристаллизации которого из мстацола получают 39 мг вещества ХЪ с т, пл.211 - 218 С. Общий выход кристаллического соединения ХИ 62%.р) 10 мл смеси фтористого водорода и мочсвины из 300 г мочевицы и 400 г сухого фтористого водорода в полиэтиленовой бутыли обрабатываот 478 г эпоксида. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем выливают в 35 мл концентрированной гидроокиси аммония, охлажденной льдом, экстрагируют хлористым метилецом, промывают экстракт водой и выпаривают растворитель. Получают 483 мг сырого продукта, который растворяот в 5 мл хлороформе, обрабатываот 2 каплями уксусного ангидрида и одной каплец пиридина, слегка подогревают и пропускаот через колонку Силикар СС - 7 (100 г), с использованием в качестве элюанта смеси этилацетата с хлороформом (1: 9). Кристаллизация из ацетона-циклогексана дает 320 мг 6, 6, 9 а-трифтор - 11 Д, 17 а - диокси-ацетоксиа-метилпрегна - 1,4 - диен - 3,20 - диона ХИ 1, выход 64%, т. пл. 227 - 231 С, гомогенный по ТСХ на силикагеле (СНС 1 з - эфир, 1: 1); УФ (ЕЮН) 233 (14,400) .Найдено, масс-спектр: 470, 1903.С 24291 зобВычислено, масс-спектр: 470, 1916.Н - ЯМР (в СРС 1 з) при 60 мгц, гц: 52,61(3, с 1, 16 - СНз), 61(3, 8, 18 - СНз), 94,97(3, с 1, 19 - СНз), 296 (2, Ь, 21 - СН 2), 375, 378 (1, с 1, С - 4 винил) 385, 433, 440(2, с 1, С - 1,2 винил).Пример 2. Следуя обцей методике примера 1, (м, р, ж) соединение Х последовательно превращаот в 6,6-дифторр, 17 а-дизкси - 21 - апетокси - 1 бсс - метилпрегн - 4-снч 20 - дион ХЧ 11, т. пл. 215 - 218 С, далее в э,6-дифтора - окси - 21 - ацетокси - 1 бссметилпрегна - 4,9(11) - диен - 3,20 - дион ХХ (выход - 90%, т. пл. 207,5 - 208,5 С) . В ЯМР-спектре (в СРС 1 з) - два дублетных, виннльных протона при 335 и 375 гц (60 мгц), далее - в 6,6 - дифтор - 9 а - бром - 11 р, 17 адиокси - 21 - ацетокси - 1 ба - метилпрсгн - 4- ен - 3,20 - дион ХХ (выход - 90%, т. пл. 160 - 180 С, разложение), далее в 6,6-дифторр,111 з - эпоксц - 17 и - оксц - 21 - ацетоксц - 166 сметилпрегн - 4 - ен - 3,20 - дион ХХ 1, т. пл.215 - 220 С. В ЯМР-спектре (СРС 1 з ТМ 5) - острый сцнглет при 91 гц (60 мгц), соответствующий С - 19 метилу, далее в 6,6,9 а - трпфтор - 11 р, 17 а - диоксц - 21 - ацетокси - 16 аметилпрсгн-сн,20-дион ХХ 11, крцсталлцзуемый цз метанола (выход -70%, т. пл. 200 - 203 С), и наконец, в 6,6,9 а-трцфтор, 17 о;, 21 - триоксц - 16 а - метплпрсгн - 4 - ец - 3,20- дион , крпсталлцзованный цз ацетоца-ццклогексаца, т. пл. 228 - 233 С; УФ (ЕЮН), 233 (13,800). Последний подвергают реакции с хлористым пцвалоцлом в пцрцдцнс прц комнатной температуре. и в результате после кристаллизации цз метанола получают 6,6,9 а-трифтор - 11 Р, 17 а - дцокси - 21 - пцвалилосси 16 а - мстцлпрсгн-сц,20-дион, т. пл, 203 - 208 С, гомогенцый по ТСХ.Найдено, масс-спектр: 514, 2520.С 27 Н 22 Гз 06.Вычислено, масс-спектр: 514, 2544. Формул а изобретения Способ получения 6,6,9 а - трцфторпрегнацовобщей формулыв котороц сз представляет собой водород илц а- или Р-метил, Р,-водород илц низший алканоил, отличающийся тем, что бромцруют соединение общей формулы 11 в котороц Р имеет указанные значения дый из К ц сз, которые могут быть од выми цлц различными, представляет соб дород или низший алканонл, и Х предста собой фтор цлц хлор, в соотвстствующ бром-низший алканоилокси- плц 21-б оксипрегнан, последний окисляют хро кислотой в соответствующий 17 я-оксинизший алканоцлоксц-бромпрегнандион, который подвергаот взаимодейст ацстатом серебра в пристствии, если э б. дп.о, й ,оР;и вод том случае, если вода отсутствует, пр реакции обрабатывают водой и получаю492079 12 Составитель Т. ИлюхинаРедактор Л. Новожилова Техред Е. Митрофанова Корректор Т, Добровольская Заказ 71/13 Изд. ЛЪ 196,) Тираж 529 Подписное ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий 113035, Москва, 7 К, Раугиская наб., д. 4 5Тип огр а фи я, и р. Сап уи ова, 2 дифтор - 21 - ацетокси - 17 а - оксипрегн - 4- ен,20-дион, в котором по усмотрению гидролизуют 21-ацетоксигруппу, и подвергают полученное соединение микробиологическому окисленгпо по С, и дегидратируют образующееся соединение в Лл-стероид, взаимодействием которого с бромноватистой кислотой получают 9 а-бромр - оксистероид, последний обрабатывают основанием и образующийся при этом 9,11-эпоксид подвергают взаимодей ствию с фтористоводородной кислотой и выделяют целевой продукт известными приемами,
СмотретьЗаявка
1649088, 22.04.1971
Э. И. дю Пон де Немур энд Компани
РИЧАРД МЕРРИЛЛ СКРИБНЕР
МПК / Метки
МПК: C07C 169/30
Метки: трифторпрегнанов
Опубликовано: 15.11.1975
Код ссылки
<a href="https://patents.su/6-492079-sposob-polucheniya-6-6-9-triftorpregnanov.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения 6, 6, 9 -трифторпрегнанов</a>
Предыдущий патент: Способ получения стероидных гормонов
Следующий патент: Способ получения -гомостероидов
Случайный патент: Способ определения прочности соединения слоев плоских биметаллических образцов