Способ получения замещенных 5-арил-1н-1, 5бензодиазепин-2, 4-(зн, 5н)-дионов1
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 361567
Авторы: Ацетил, Водород, Галоид, Диоксане, Качестве, Лед, Метил, Метилэтилкетоне, Метокси, Незамещенный, Нитро, Окисление, Перманганатом, Пиридил, Риде, Тетрагидрофуране, Трифторметил, Уксусной, Циано
Текст
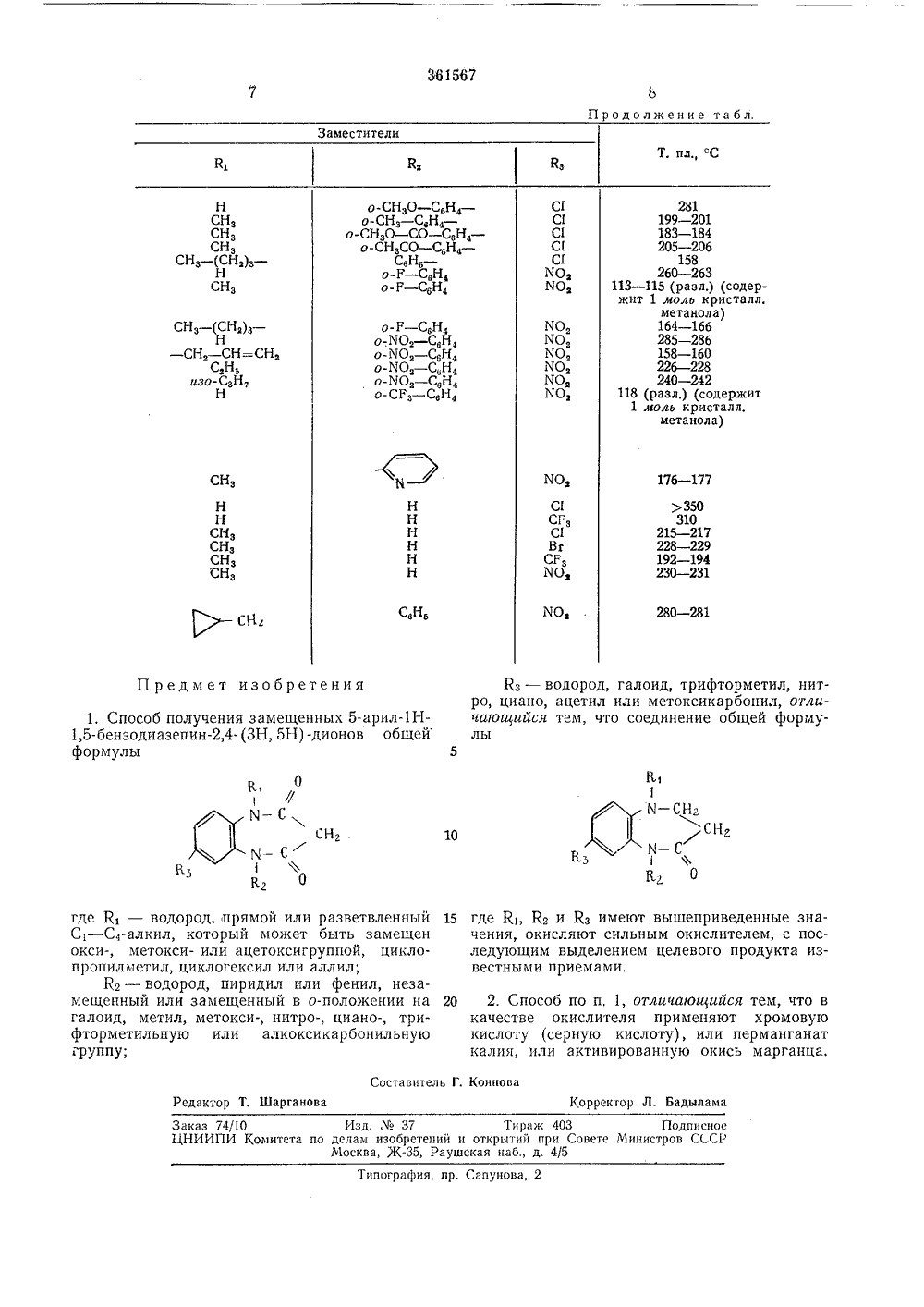
О П И С А Н И Е 361567ИЗОБРЕТЕН ИЯ Союз Советских Социалистических РеспубликК П АТЕНТУ висимый от патентавлено 28,1,1971 ( 1615161/23 С 074 53 Приоритет 13,11.1970,2006601,2, Ф итет по деламтеиий и открытиовете МинистровСССР изопри публиковано 07.Х 11.1972. Бюллетень1 за 1973 г,атд опубликования описания 31.1.1973с Мини Карл-Хе аявит СПОСОБ ПОЛУЧЕНИЯ ЗАМЕ 1 ЦЕННЫХ 5-АРИЛН,5 БЕНЗОДИАЗЕПИН,4"(ЗН, 5 Н)-ДИОНОВом, что соединение общей ор Изобретение относится к производных 1,5-бензодиазе ценными фармакологическ Известно, что 1,5-бензод действием кислот легко гид щепляются, образуя имидаз Предлагаемый способ п ных 5-арилН,5-бензодиа дионов общей формулыключаетсямулы способу полученийнинов, обладающихми свойствами.иазепины под возролизуются и расол. лучения замещензепин,4- (ЗН, 5 Н)11 2 ,Г М - С 0 и Кз гсляю елево теют приведенные выше знаильными окислителями и вы родукт известными приема где К К, ивчения, окт т сделяют ц й п15 ми.В качестве окислителяхромовую кислоту (сернуманганат калия, или аокись марганца.20 Окисление с хромовой кислотой/серной кислотой и перманганатом калия хорошо проводить в смешивающихся с водой растворителях,которые в условиях реакции не окисляются,например в ацетоне, метилэтилкетоне, ледяной25 уксусной кислоте, диоксане, тетрагидрофуранеили их смеси.Окисление активированной двуокисью марганца может быть, кроме того, проведено в уксусном эфире, диэтиловом эфире, метилепхло 30 риде или хлороформе,обычно используют ю кислоту), или пер(тивированную дву 1 % оК 1 - водород, прямой или С-алкил, который можетметокси- или ацетокси пилметил, циклогексил или К - водород, пиридил и енный или замешенный в ид, метил, метокси-, нитр рметильную или алкок разветвленныи быть замещен группой, циклоаллил;ли фенил, незао-положении на о-, циано-, три- сикарбонильную гдок ме га фт руппу, Я, - водород, галоид, тро, циано, ацетил или мето фторметил, нитсикарбонил, за3Температура реакции зависит от исходных реагентов и может варьироваться от 20 С до температуры кипения растворителя.Для получения соединения формулы 1, где К - оксиалкил, целесообразно исходить из соответствующих 1-ацилоксиалкил-,2,3,4,5-тетрагидроН,5-бензодиазепин-дионов и затем отщеплять при окислении ацильную группу.Соединения формулы 1, где К - водород, могут быть алкилфированы обычным образом. П р и и е р 1. 7-Нитро-фенилН,5-бснзодиазепин,4- (ЗН, 5 Н) -дион.65 г (0,23 моль) 7-нитро-фенил,3,4,5-тетрагидроН,5 - бензодиазепин-она, т. пл.241 С, растворяют или суспендируют в 2000 мл ацетона. В течение 15 мин по каплям добавляют раствор 120 мл чистого реактива из 40 г СгОз, 38 мл Н,804 и 150 мл Н,О, Нагревающуюся реакционную смесь размешивают 20 мин, декантируют от соли хрома и сгущают приблизительно до 300 мл, Остаток выливают в 500 мл воды, дают еще раз закипеть и оставляют выкристаллизовываться в ледяной бане. Выход 63,5 г (92/о); т. пл, 272 - 274"С (ацетонитрил) .П р и м е р 2. 1-Метил-нитро-фенилН,5-бензодиазепин,4- (ЗН, 5 Н) -дион.29,7 г (0,1 моль) 1-метил-нитро-фенил Н,3,4,5-тетрагидро - 1,5-бензодиазепин-оца, т. пл, 123 - 125 С, окисляют аналогично примеру 1. Получают 2,6 г (88%) целевого продукта, т, пл. 178 - 180 С.П р и м е р 3, 3-Этил-нитро-фенилН,5-бензодиазепин,4- (ЗН, 5 Н) -дион.31,1 г (0,1 моль) 1-этил-нитро-фенил.1- 2,3,4,5 - тетрагидро,5 - бензодиазепин- она, т. пл. 160 - 162 С, окисляют аналогично примеру 1. Получают 29,4 г (90%) целевого продукта, т. пл. 257 - 259 С.П р и м е р 4, 1-Изопропил-нитро-фенил Н,5-бензодиазепин,4- (31-1, 5 Н) -дион.32,5 г (0,1 моль) 1-изопропил-нитро-фенилН,3,4,5 - тетрагидро,5 - бензодиазепин-она, т. пл, 170 - 171 С, окисляют аналогично примеру 1. Выход 28,0 г (82%), т. пл. 212 - 213 С.П р и м е р 5. 1-Аллил-нитро-фенилН,5-бензодиазепин,4- (ЗН, 5 Н) -дион,32,3 г (0,1 люль) 1-аллил-нитро-фенил Н,3,4,5 - тетрагидро - 1,5 - бензодиазепин- она, т, пл, 126 в 1 С, окисляют аналогично примеру 1, Выход 25,4 г (75%), т, пл. 237 - 239 С.П р и м е р 6, 7-Хлор-метил-фенилН,5-бензодиазепин,4- (ЗН, 5 Н) -дион,79 г (0,276 моль) 7-хлор-метил-фенил,3,4,5-тетрагидро - 1 Н,5-бензодиазепин-она, т, пл, 133 - 139 С, растворяют в 2000 мл ацетона и окисляют, как в примере 1. После упаривания ацетонный раствор обрабатывают метиленхлоридом, промывают водой, высушивают и упаривают до 250 - 300 ил. Добавляя диизопропиловый эфир, получают 68 г (82/о ) кристаллизата, т, пл, 179 - 182 С. 5 10 15 20 25 Зо 35 40 45 50 55 60 65 4П р и м е р 7. 5-фенил-трифторметилН,5-бензодиазепин,4- (ЗН, 5 Н) -дион.34,5 г (0,113 моль) 5-фенил-трифторметил,3,4,5 - тетрагидро - 1 Н,5 - бензодиазепин - 4- она, т, пл. 152 - 153 С, растворяют или суспендируют в 300 мл ледяной уксусной кислоты и разбавляют 60 мл смеси хромовой и серной кислот. Размешивают 3 час при комнатной температуре и выливают в 3 л воды.Выделившийеся сырой продукт отсасывают, промывают водой и обрабатывают метиленхлоридом. После промывки, сушки и упаривация получают при добавлении изопропилового эфира 30 г (83%) целевого продукта с т. пл, 258 в 2 С.Г 1 р и м е р 8, 5-Фенил-трифторметилН,5-бензодиазепин,4- (ЗН, 51-1) -дион.б г (0,02 люль) 5-фенил-трифторметил,3, 4,5 - тетрагидро - 1 Н-,5-бензодиазепин - 4-она, т. пл. 152 в 1 С, растворяют в 100 мл чистого ацетона и после добавления 20 г перманганата калия и 30 мл воды кипятят с обратным холодильником 1 час. Отсасывают над кизельгуром, отделяют пиролюзит и упаривают филь- трат. Остаток обрабатывают метиленхлоридом и затем, как в примере 7.Выход 2 г (32%), т, пл. 258 - 260 С.П р и м е р 9. 1-Метил-фенил-трифторметилН,5-бензодиазепин,4-(ЗН, 5 Н) -дион.5 г (0,016 люль) 1-метил-фенил-трифторметил,3,4,5 - тетрагидроН - 1,5-бензодиазепин-она, т, пл. 91 - 92 С, растворяют в 200 мл уксусного эфира и после добавления 15 г активированной двуокиси марганца кипятят с обратным холодильником 20 час, Отсасывают над кизельгуром, фильтрат упаривают, остаток обрабатывают метиленхлоридом и затем, как описано выше.Выход 1,5 г (28 О/о ), т. пл, 205 - 206 С.П р и м е р 10. 1-Метил-нитро-фенилН,5-бецзодиазепин,4- (ЗН, 5 Н) -дион.5 г (0,017 моль) 1-метил-нитро-фенил,3,4,5-тетрагидро - 1 Н,5-бензодиазепиц-она, т. пл. 123 - 125 С, суспендируют в 100 мл тетрагидрофурана и кипятят с обратным холодильником 15 час в присутствии 15 г активированого пиролюзита. Затем смесь отсасывают, фильтрат частично выпаривают в вакууме и обрабатывают, как обычно. Выход 2,1 г (40%); т. пл. 178 - 180 С.П р и м е р 11. 1 Р-Ацетоксиэтил-хлор- фенилН,5 - бензодиазепин,4- (ЗН, 5 Н) -дион.17,9 г (0,05 моль) Р-ацетоксиэтил-хлор- фенилН,3,4,5 - тетрагидро - 1,5 - бензодиазепин-она окисляют аналогично примеру 10. Из уксусноэфирного раствора при выпаривании получают бесцветные кристаллы с т, пл, 168 - 170 С. Их растворяют или суспендируют в трехкратном количестве 10%-ного метанольно-водного раствора едкого натра и размешивают 30 мин при комнатной температуре. Затем выливают в воду, встряхивают с метиленхлоридом и получают после выпаривания мстиленхлоридной фазы и перекристаллизациц361567 диизопропиловый эфир, Выход 35 г т. пл.179 в 1 С.П р и м е р 13. 1-Оксиэтил-нитро-фегнл 11-1-1,5-бензодпазепин,4- (ЗН, 5 Н) -дион.5 20 г (0,07 моль) 7-нитро-фенил-Н,5-бснзодиазепин,4- (3, 5 Н) -диона суспендируот в 600 м г метанола, добавляют 10 мл воды, 1 мл тритона В и 50 мл этиленоксида, размешивают при комнатной температуре до образования 10 прозрачного раствора (-50 час). Растворупаривают досуха, остаток обрабатывают мстнленхлоридом и многократно встряхивают с водой. Органическую фазу высушивают, выпаривают и остаток перекристаллизовывают из 15 этанола, Выход 11 г, т. пл. 187 - 188 С.Лналогично методу, приведенному в примерах 1 - 13, получают соединения формулы 1, перечисленные в таблице. остатка из этанола 5 г (33%) соединения ст. пл. 210 С. П р и м с р 12, 1-Метил-нитро-фенилН,5-бснзодиазспин,4- (ЗН, 5 Н) -дион.40 г (0,13 моль) 7-нитро-фенилН,5-бензодиазепин,4- (ЗН, 5 Н) -диона суспендируют. в 600 мл тетрагидрофурана и после добавления 6,4 г 50% -ной суспензии гидрида натрия получают раствор, в который вводят 8,5 мл метилйодида, размешивают 1 час при 45 С, добавляют 8,5 мл метилйодида и размешивают еще 1 час. В раствор добавляют несколько капель ледяной уксусной кислоты, выпаривают, остаток обрабатывают метиленхлоридом, промывают водой, высушивают метиленхлоридную фазу, выпаривают растворитель и перекристаллизовывают из смеси метиленхлорид -Таблица Заместители Т, плС 306 в 3 280 в 2 263 в 2 228 в 2 С 1 Н С 1 Сгз С,Нз -С,Н; -о-С 1 - С,Н, -о С Сзн 4 Н Н Н Н 268 в 2 СЕ 3 273 в 2 250 в 2 Н с,н,С,Н, -с,н,о-Вг - С,Н, -о-Р - С,Й, -о-ИОз - С,н, -С,йзо-СХ - С,Н, -о-СРЗ - Сзн 4 -о-Вг - СН -с,н, -213 в 2 СзНз -231 в 2 НзС - СН, - СН, -НЗС - Снз - СнзН,С - СН, - СН -Н,С=СН - СН, -НС=СН - СН, -ННННСНЗ -Низо-Сзн, -СНзО - Снз - Снз -НО - СН, - СН, -НО - СН - СН -НО - СН, - СН -С 1 МО, С 1 СГз СИ Вг С 1 О С 1 Г С 1 С 1 С 1 С 3 С 1 С 1 Вг СГз 185 в 1 197 в 1 239 в 2 203 в 2 169 в 1 270 в 2 302 в 3 260 в 2 255 в 2 206 в 2 291 в 2 209 в 2 204 в 2 210 в 2 176 в 1 180 в 1 178 в 1 208 в 2 204 в 2 153 в 1361567 Продолжение табл. Заместители Т. пл С С 1 С С 1 С 1 С 1 МО, МОз о-СНЗО - С 6 Н 4 -о-СНЗ - СФН 4 -О-СНЗО - СО - СВН 4 -о-СНзСО - С,Й 4 -о-Р - С,Н 4о-Р - СвН НСНэС 13 (С 2)зНСНЗ йО, МО, ИО, ч Оз ИОз СНз - (СНз)з -Н СН, - СН=СНз С,Нь изо-СзН 7 Н) 350310215 в 2228 в 2192 в 1230 в 2 ССРз С 1ВгСРЗ Н Н Н Н Н Н Н Н СНЗ СНз СзНь 280 в 2 Кз - водород, галоид, трифторметил, нитро, циано, ацетил или метоксикарбонил, отличающийся тем, что соединение общей формулы5 П ред м ет изобретения К 1И - СНгСнаМ - СФ 10 где К, - водород, прямой или разветвленный 15 С 1 - С 4-алкил, который может быть замещен окси-, метокси- или ацетоксигруппой, циклопропилметил, циклогексил или аллил;Кг - водород, пиридил или фенил, незамещенный или замещенный в о-положении на 20 галоид, метил, метокси-, нитро-, циано-, трифторметильную или алкоксикарбонильную группу; Составитель Г. Коннова Корректор Л. Бадылама Редактор Т, Шарганова Заказ 74/О Изд.37 Тираж 403 ПодписноеЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров С( СР Москва, Ж, Раушская наб., д. 4/5 Типография, пр. Сапунова, 2 1, Способ получения замещенных 5-арилН,5-бензодиазепин,4- (ЗН, 5 Н) -дионов общей формулы 07М-с,к - сг 281199 в 2 183 в 1 205 в 2158260 в 2 113 - 115 (разл,) (содержит 1 моль кристалл.метанола) 164 в 1 285 в 2 158 в 1 226 в 2 240 в 2 118 (разл.) (содержит1 моль кристалл.метанола) где Кь Кг и Кз имеют вышеприведенные значения, окисляют сильным окислителем, с последующим выделением целевого продукта известными приемами,2. Способ по п, 1, отличающийся тем, что в качестве окислителя применяют хромовую кислоту (серную кислоту), или перманганат калия, или активированную окись марганца.
СмотретьЗаявка
1615161
Изобретение относитс способу получений производных бензодиазепинов, обладающих цепными фармакологическими свойствами Известно, что бензодиазепииы под воздействием кислот легко гидролизуютс, расщепл ютс образу имидазол Предлагаемый способ получени замеп ных арил бензодиазепин ЗН, дионов общей формулы, где водород, мой или разветвленный алкил, который может быть замещен ОКСИ метокси или ацетоксигруппой, цикло нропилметил, циклогексил или аллил
водород, пиридил или фенил, незамещенный или замещенный положении галоид, метил, метокси нитро циано три фторметильную или алкоксикарбонильную группу, водород, галоид, трифторметил, нитро, циано, ацетил или метоксикарбонил, качестве окислител обычно используЕОт хромовую кислоту серную кислоту или пер манганат кали или активированную двуокись марганца, Окисление хромовой кислотой серной кислотой, перманганатом кали хорошо проводить смешивающихс водой растворител которые услови реакции окисл ютс например ацетоне, метилэтилкетоне, лед ной, уксусной кислоте, диоксане, тетрагидрофуране или смеси, риде или хлороформе
МПК / Метки
МПК: C07D 243/12
Метки: 4-(зн, 5-арил-1н-1, 5бензодиазепин-2, 5н)-дионов1, замещенных
Опубликовано: 01.01.1973
Код ссылки
<a href="https://patents.su/4-361567-sposob-polucheniya-zameshhennykh-5-aril-1n-1-5benzodiazepin-2-4-zn-5n-dionov1.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения замещенных 5-арил-1н-1, 5бензодиазепин-2, 4-(зн, 5н)-дионов1</a>
Предыдущий патент: Способ получения производных п-аминоал кил бензол сульфон амида
Следующий патент: 361568
Случайный патент: Устройство для сборки шарнирного соединения секаторов