Способ получения замещенных имидазолов или их нетоксичных фармакологически приемлемых солей
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
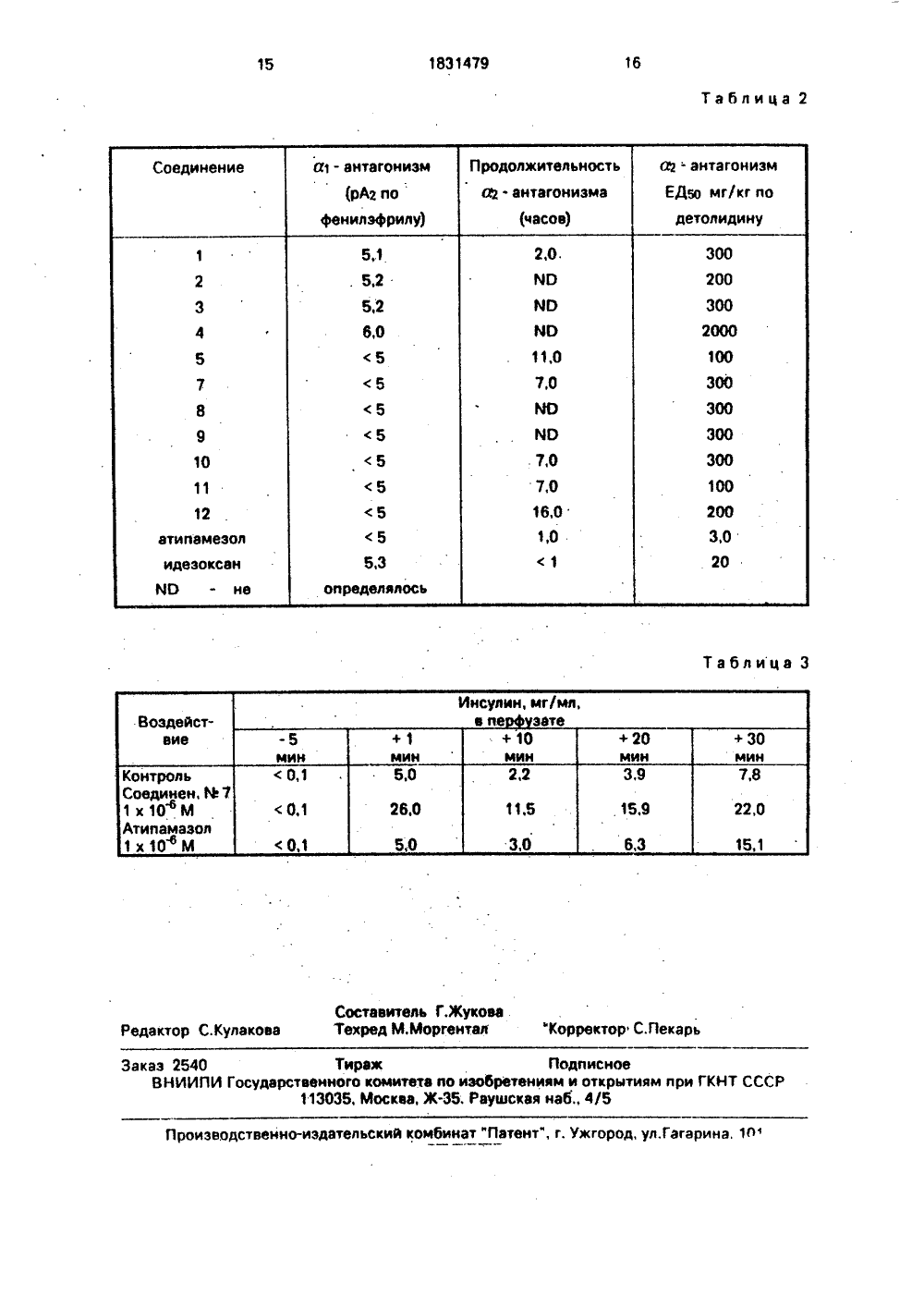
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСКИРЕСПУБЛИК 831479 г / 7 О 2 ЭЭ,У 1)5 Е ИЗОБРЕТЕН АТЕНТУ где Х - СН 2 или С = О, Я 1- С 1- Б-алк бензил, который может быть заме или незамещенным, 82- Н, С 1-4-ал или С 1-з-алкокси, Вз-Н, СНЗ, СН 2 СН или На, 84 - Н, СНз, СНгСНз, или На 1, На-галоген, причем, когда 82 С 1- з-алкил. 81 не может быть водоро когда 82 " ОН или С 1 - З-алкокси, Х не быть С - О, Реагент 1: продукт общей ф лы: ил, либо щенным кил, ОН з, ОСНз или ж муН 2 2. Яз, 84Реагент 1улы:8 У ензил,имеют вышеу : алкил или ар С 1- ь-алкил, л У где ни фо ны алоген. Э т Изобретен мещенным ими ным, фармакол общей формулы С 1. 4-алкил ОНСНЗ, СН 2 СНз, СН 2 СНз, ОСНз, ем, когда 82 - Н ет быть водоро-з-алкокси, х не являются эффекСН 2 щими антагонитез новых высотвующих антагов, которые могут Н -алкил, либ мещенным может быть где Х-СН 2 или бензил, которы ГОСУДАРСТВЕЩ 1 ОЕ ПАТЕНТНВЕДОМСТВО СССРГОСПАТЕНТ СССР)(21) 4742612/04 (22) 08,12.89 (46) 30.07.93. Бюл, М 28 (31) 8828831. 1 (32) 09,12.88 (Э.Э) ОВ (71) Фармос-Ихтюмя ОЙ (Р 1) (72) Арто Йоханнес Карьялайнен, Раймо Эйнари Виртанен, Арья Леена Карьялайнен (й) (56) Эльдерфилд Р. Гетероциклические соединения. т. 5, М,; И.Л 1954, с.167. (54) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕНННХ ИМИДАЗОЛОВ ИЛИ ИХ НЕТОКСИЧННХ ФАРМАКОЛОГИЧ ЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ (57) Использование: в качестве антагонистов а 2-адренорецепторов. Сущность изобретения пдплчкт общей формулый е относится к новым 4 (5)-эадаэолам или к их нетоксич гически приемлемым солям 1: или незамещенным, 82- Н или С 1 - 3-алкокси Вз - Н ОСНз, или На 1, 84" Н, СНз, или На. На-галоген, прич или С 1 - з алкил, 81 не мож дом, и когда 82 - ОН или С 1 может быть С = О, которые тивными и долгодействую стами а 2-адренорецепторовЦель изобретения - син коселективных и дол годвйс нистов а-адренорецептороС азанные эначеалкилгалогенид ибо незамещенбл.Ьвбыть особенно полезны при лечении диабетов, с помощью широко известного способа алкилирования имидазолов,Поставленная цель достигается предложенным способом получения соединений 1, заключающимся в И-алкилировании соедих сн-) 2,Р йН где х, нг, Вз, й - имеют вышеуказанные значения, алкилом или аралкилгалогенидом формулы: й У, где й - С 1 - 5 алкил либо замещенный, либо незамещенный бензил,У - галоген.П р и м е р 1. 4-(2-Этил,3-дигидро- инден-ил)1-метилН-имидазол 1,0 г 4-(2- атил,3-дигидроН-инден-ил)1 Н- имидазола, 4 мл 48; йаОН 10 мл толуола и 0,075 г тетрабутиламмоний бромида смешивают при перемешивании. Затем прибавляют 1,15 г йодистого метила в 3 мл толуола, После прибавления смесь нагревают до 40 С,перемешивают 1 ч и затем дают охладиться,К смеси добавляют воды и экстрагируют продукт толуолом. Толуольный раствор промывают водой, упаривают и получают 1 г(94) продукта.Продукт очищают флеш-хроматографией (элюент метиленхлоридметанол 95:5). Гидрохлорид(масло) был получен в этилацетате.Масс-спектр 226 (27, Мф), 211 (10, МСНз), 197(М-СНг- СНз), НС-соль, 1 Н ЯМР(80 МГц, МеОН-б): д 0,82 ЯН, т, 3 - 7,4 Гц, СНг-СНз), 1,92 (2 Н, кв.,3 - 7,4 Гц, СНгСНз), 3,18 и 3,254, АВ кв., Здв -16,5 ц, инденовое кольцо Нг и Нгз), 3,87 (ЗН, сйСНз), 1,05. 7,30 (4 Н, м, аром.), 7.39 (1 Н, д, 3 - 1,5 .Гц, им), 8,85(1 Н, д, 3 =1,5 Гц, им). НО-соль, 1 ЗС-ЯМР(20 МГц, МеОН-оа); д 9,34 (ОЕЙ кв), 33,33 (т), 36,27 (кв); 44,63 (2 т), 43,47 (с), 121,18 (д), 125,45 (2 Д), 127,75 (2 д), 136,74 (д), 141,80 (с), 142,04 (2 с).П р и м е р 2. 2-Этил- и 5-(2-атил,3- дигидроН-инден-ил)-1 Н-имиазол.Алкилирование 4-(2-атил,3-дигидро- инден+1 Н-имидазола проводится согласно примеру 1, с той разницей, что используется этилйодид. Выход неочищейного продукта составляет 0,91, Разделение изомеров осуществляется флеш-хроматографией. Гидрохлорид продукта получают в этилацетате.1-Этил-(2-атил,3-дигидроН-инден -2-ил)1 Н имидазол. т.пл, гидрохлорида 206- 2080 С. Масс-спектр 240 (30, м), 225 (12, М-СНз),211 (100, М-СНгСН, 129 (10), 115 (21) НС- соль, 1 Н ЯМР (80 МГц), МеОН-д: д 0,81 (ЗН,т, 3 =7,5 Гц, СНгСНз), 1,49(ЗН, т, Л =7,4 Гц,5йСНгСНз), 1,91(2 Н, кв,3 =7,5 Гц, СНгСНз),3,16 и 3,21 (4 Н, Ан, кв, Лда = 16,6 Гц, пидановое кольцо Нг и Нг ), 4,20 (2 Н, кв, Л = 7,4Гц, йСНгСНз), 7,05-7,30 (4 Н, м, аром.), 7,49,0,75(ЗН, т, 7,4 Гн, СНгСНз), 1,63 (ЗН, тЗ =7,2 Гц, йСНгСНз), 1,88 (2 Н, кв, Л = 7,4 Гц,20 СНрСНз середина АЗв квартета 3,3 мд (4 Н,Нг и Нг инденового кольца),4,39(2 Н, кв, 31,2 Гц,йСНгСНз), 7,05-7;30 (4 Н, м, аром.),7,41 (1 Н, д, 3 - 1,7 Гц, им), 9,00 (1 Н, д, 31,7 Гц, им).П р и м е р 3, 4(2-Этил,3-дигидроНинден-ил)-1-н-пропилН-имидаэол,Алкилирование 4-(2-этил,3-дигидро 1 Н-инден-ил)-1 Н-имидазола проводитсяаналогично примеру 1, с той разницей, что30 используют н-пропилйодид, Выход составляет 86, Главный иэомер выделяют припомощи флеш-хроматографии и получаютгидрохлорид в этилацетате, т,пл, гидрохлорида 213-2200 С,Масс-спектр 254 (26, м+), 239 (11, МСНз), 225 (100, М-СНгСНз), 183 (18), 172 (10),136 (16), 129 (12), 128 (13), 127 (10), 115 (21).НС 1-соль 1 Н ЯМР (80 МГц, МеОН-бд); д 60,81(ЗН, т, СНгСНз), 0,91 (3, т, СНгСНгСНз), 1,6840 2,13 (4 Н, м, СНгСНз и СНгСНгСНз), 3,18 и3,27 (4 Н, АВ кв, Здс = 16,5 Гц, инденовоекольцо Нг и Нг), 4,13 (2 Н, 37,1 Гц,МСНгСНг-), 7,05-1,3 С (4 Н, м. аром. 7.48 (1 Н,д, Л 1,5 Гц, им), 8,92 (1 Н, д, 3 - 1,5 Гц,45 им 2),П р и м е р 4, 1-Бензил-(2-атил,3-дигидроН-инден-ил)1 Н-имидазол,Бензилирование 4-(2-этил,3-дигидро 1 Н-инден-ил)-1 Н-имидазола проводится50 аналогично примеру 1 при помощи бензилхлорида, Выход составляет 1007,. Гидрохлорид был получен в этилацетате.Т,пл. гидрохлорида 158-161 С.Масс-спектр 302 (37, м), 287 (8, М-СНз),55 273 (83, М-СНгСНз), 182 (23, М-СНгРз), 128= 16,4 Гц инденовое кольцо Нг Нз), 5,36 (д), 129,32 (л), 130,35 (2 д), 131.23 (2 д), 134,02(2 Н, с, СН 2 РЬ), 7.04-7,28 (4 Н, м, ароматиче- (с), 135.,38 (с), 136,14 (с), 136,71(с), 137,16(д),ские протоны инденового кольца), 7,38 (5 Н, 137,26 (д), 153,63 (с), 205,73 (с).с, протоны бенэольного кольца), 7,44 (1 Н, д, П р и м е р 7. 2-(1-МетилН-имидазол= 1,5 Гц, им), 9,00 (1 Н, д,= 1,5 Гц, им). 5 и 5-ил-)2-н-пропил-инденон.П р и м е р 5. 2-Этил-(1-метилН-ими(1 Н-имидазол-ил)2-н-пропил-индедазол- и 5-ил-)1-инденон 20 мл толуола, 8 нон (полученный, согласно ЕР 183492) имл 48 йаОН, 0,1 гтетрабутиламмоний бро-йодистый метил вводят в реакцию как опимида и 1,5 г 2-этил-(1 Н-имидазол-ил)-1- . сано в примере 5. Выход составляет 80,инденона полученного согласно КР 183492 10 Изомеры разделяют флеш-хроматографией,помещают в колбу, Смесь. нагревают до элюент метиленхларид - метанол 95:5.40 С и при.перемешивании прибавляют по Солянокислые соли получают в этилацекаплям 1,4 г метилйодида, продолжают пе- тате;ремешивание 1 ч при 40 С, Затем реакцион-(1-.Метил-имидазол-ил)-2-н-пропную смесь охлаждают и прибавляют воды, 15 ил-инденон гидрохлорид представляет соПродукт экстрагируют толулом, толуольный бой масло,раствор промывают водой и упаривают, НС 1-соль, 1 Н ЯМР (80 МГц, МеОН-б 4):Продукт выделяют и очищают, флеш-хрома- д 0,89 (ЗН, искаженный т, -СНгСНэ), 1,02 тографией (элюент метиленхлорид-метанол 1,44. (2 Н, м, СН 2 СНгСНз). 1,68-2,28 (2 Н, м;95:5). 20 СН 2 СН 2 СНз), 3,57 (2 Н, широк, с, инденовоеГидрохлорид (масло) получают в этила- кольцо, СН), 3,93 (ЗМ, с ИСНз), 7,37-7,37цетате. (5 Н, м, аром, и им), 8,93 (1 Н, широк. с мм-.2).2-Зтил-(1-метил-имидазол-ил)-1- НС-соль, 13 С ЯМР (20 МГц, МеОН-б 4);инденон, д 14,38 (ОгВ кв), 18,95(т), 36,51 (кв.), 38,90(т),Масс-спектр 240 (32, М ), 225 (15, М 41,32 (т), 52,80 (с), 121,45 (д), 125,27 (д),СНз), 211(100, М-СН 2 СНэ), 115(13). 127,87 (д), 129,20 (д), 135,17 (с), 136,04 (с),НС 1-соль, 1 Н ЯМР (80 МГц, МеОН-б 4); 137,10(д), 137,38(л), 153,4(с), 205,58(с).д 0,85 (ЗН, искаженный т, СНгСНз), 1,71-2,28 2-(1-МетилН-имидазол-ил)-2-н-про(2 Н, м, СН 2-СНз), 3,57 (2 Н, середина А квар- пил-инденон.тета, инденовое кольцо СН 2), 3,95 (ЗН, с, 30 Масс-спектр; 254 (32, М+), 225 (48, МНСНз), 7,37-7,88 (5 Н, м. аром, и им), 8.97 СН 2 СНз), 211 (100 М-СН 2 СН 2 СНз), 183 (10),(2 Н, м, СНрСНз), 3,6(2 Н, м, инденовое коль- этилйодид вводят в реакцию как описано вцо СН 2), 3,77 (ЗН, с,МСНэ), 7.4-7,9 (5 Н, м, примере 5. Выходсоставляет 98 ь; Ивомерыаром, и. им), 8,9 (1 Н, широк, с им), разделяют флеш-хроматографией, злюентП р и м е р 6. 2-Этил-(1-(4-хлорбенэил)- 40 метиленхлорид - метанол 95;5. Солянокис 1 Н-имидазол-ил)-1-инденон. лые соли изомеров получают в этилацетате,2-Этил-(1 Н-имидазол-ил)-1-инденон 2-(1-ЭтилН-имидазол-ил)2-н-пропи 4-хлорбензилхлорид реагируют при 60 ОС ил-инденон. Т.пл, гидрохлорида 180 окак описано в примере 5, Выход составляет 194 С.74; Гидрохлорид получен в этилацетате, 45 НС-соль, 1 Н ЯМР (30 МГц, МеОН-б 4);т,пл, 150-154 С, д 0,90 (ЗН, искаженный т, СН 2 СН 2 СНз), 1,0 Масс-спектр 350 и 352(26 и 9,М),321 и 1,4 (2 Н, м, СН 2 СНгСНз), 1,52 (ЗН, т,=7,4323 (51 и 17 М-СН 2 СНз), 225 (Э, М- Гц, Ъ.ИСН 2 СНэ) 1,68-2,28 (2 Н, м,СН 2 С 6 С 4 С), 196 (10, 321 СН 2 С 6 Н 4 С 1); 125 и СН 2 СН 2 СНэ), 3,54 и 3,61 (2 Н, АВ кв, 1 дв127 (100 и 35, СН 2 С 6 Н 4 С); 91 (16), 89 (12), 50 17,3 Гц, инденовое кольцо СН 2),4,26(2 Н, квНС 1-соль,1 Н ЯМР(МеОН-б 4): д 0,82(ЗН,7,4 Гц,)МСНгСНз),7,37-7,87(5 Н, м, аром.искаженный, т, МН 2), 1,78-2,26 (2 Н, м, - и ин), 8;98(1 Н, д,-1,5 Гц, им).СН 2 СНз). 3, 50 и 3,57 (2 Н, АВ кв, Здв -18,0 НС-соль, 13 С ЯМР (20 МГц, МеОН-б 4):Гц, инденовое кольцо Н 2), 5,42 (2 Н, с, д 14,41(ОЕй кв),15,56(кв),19,07(т),38,87(т),Масс-спектр: 268 (2 Н, М ), 239 (36, МСН 2 СНз), 225 (100, М-СН 2 СН 2 СНз), 197 (16).П р и м е р 9. 4-(2,З-Дигидро-метоксиметилН-инден-ил)-1-метил 1 Н-имидаэол,а), (2,.3-Дигидро-1-имидазол-ил)1 Н- инден-ил) метанол,2,8 г литийалюмогидрида вносят в 75 мл сухого ТГФ в атмосфере азота, 15,0 г этил 2,3-дигидро-1 Н-.имидазол-илН-инден- -2-карбоксилата (полученного согласно ЕР 247764) растворяют в 150 мл сухого ТГФ и медленно по каплям прибавляют при комнатной температуре. После прибавления смесь перемешивают 2 ч при комнатной температуре и затем еще 2 ч при 40 С, Избыток литийалюмогидрида разлагают медленным прибавлением этилацетата и затем смесь выливают в разбавленную соляную кислоту. Водный раствор промывают хлористым метиленом и подщелачивают гидроксидом натрия, Продукт экстрагируют этилацетатом. Осадок образующийся в процессе экстракции фильтруют и промывают несколько раз этилацетатом и хлористым метиленом. Органические растворы объединяют, сушат и упаривают. Гидрохлорид продукта получают в этилацетате, т,пл, 181-184 С.Масс-спектр 214 (18, М), 196 (10, МН 20), 195 (14), 183 (100, М-СН 2 ОН), 175 (19), 162 (46), 145 (10), 1 ЗЗ (13), 129 (13), 128 (10), 121 (14), 120 (18), 115 (24), 91 (27), 77 (16).НО-соль, 1 Н ЯМР (80 МГц, ИаОН-б 4): д 3,24 и 3,28 (-4 И, А кв, Здв - 16,2 Гц, инденовое кольцо Н 2 и Н 2 з), 3,68 (2 Н, с, СН 2 СН), 7,08-7,32 (4 Н, м, аром.), 7,40 (1 Н, д, 3 = 1.4 Гц, им/4). 8,81 (1 Н, дЗ = 1.4 Гц, им).б). (2,3-Дигидро-(1-метил-имидазол-ил)-1 Н-инден-ил)-метанол,Тетрабутиламмоний бромид (0,51 г) и 4 ф раствор МаОН,Д 6 мл) смешивают, прибавляют 68 мл толуола и 6,8 г 2,3-дигидро- (1 Н-имитдазолил-(1 Н-инден-ил)метанола как основания и нагревают до 40 С,6,4 г йодистого метила прибавляют по каплям и перемешивают смесь 3 ч при 40 С, После охлаждения реакционной смеси прибавляют воды, отделяют толуольный слой, а водный экстрагируют толуолом. Обьединенные толуольные растворы промывают водой, сушат и упаривают, Продукт (основание) кристаллизуют из ацетона, т,пл.103-106 ЯС. Гидрохлорид получают в смеси изопропанолэтилацетат, т.пл, 224-220 С, Масс-спектр: 228 (17, М ), 197 (100, МСН 20 Н), 115 (13), 98 (16).НС-соль, 1 Н ЯМР (30 МГц, МеОН-б 4),д 322 и 327 (4 Н, АВ кв, Лдв " 164 Гц, 5 инденовое кольцо Н 2 и Н 2 з), 3,67 (2 Н, с,СН 2 СН), 3,89 (ЗН, с, СНз), 7,07-7,33 (4 Н, м, аром.),7,43(1 Н, д, Л =1,5 Гц, им),8,79(1 Н, д, 3 1,5 Гц, им).в). 4-(2,3-Дигидро-метоксиметилН инден-ил)-1-метилН-имидазол.Гидрид натрия (0,89 г 50 ф суспензии вминеральном масле промытые пентаном) и 10 мл сухого ТГФ помещают в колбу и атмос. фере азота. Суспензию нагревают до 45- 15 50 С и при этой температуре прибавляют1,38 г (2,3-дигидро-(1-метилН-имидазол-ил)-1 Н-индол-ил)метанола,в 4 мл ТГФ и1,42 г йодистого метила по каплям. После.прибавления смесь перемешивают 40 мин 20 25 ют этилацетатом, Выход 1,24 г(85). Гидро. хлорид получают в смесиизопропанол-этилацетат, т,пл. 177-180"С. 45 50 55 30 35 40 при 45 С, Затем смесь охлаждают и очень осторожно прибавляют эолу. ТГФ упаривают и подкисляют смесь концентрированной НО при охлаждении, промывают эфиром, водный слой подщелачивают и экстрагируМасс-спектр: 242 (14, М ), 211 (10, МОСНз), 197 (100, М-СН 2 ОСНз), 115 (14).НС-соль, 1 Н ЯМР (80 МГц, МеОН-О);д 3,26 (4 Н, с, инденовое кольцо Н 2 и Н 2),3,33 (ЗН, с, ОСНз), 3,54 (2 Н, с, -СН 20-), 3,88(1 Н, д, 3 = 1,5 Гц, им), 8,80 (1 Н, д, Л = 1,5 Гц,им),НС-соль, 13 С ЯМР (20 МГц, МеОН-бл):36,24 (О ЕВ кв.) 42,26 (2 т, 48,07 (о), 59,52 (кв),78,68 (т, 120,91 (д), 125,66 (2), 127,96 (2 Д),136,50 (д), 140,74 (с), 141,52 (2 с),П р и м е р 10. а). (2-(1-БензилН-имидазол-ил)-2.3-дигидроН-инден-ил) метанол,0,0237 г тетрабутиламмоний бромида. 1 мл 48 6 МаОН, 5 ил толуола, 0,58 г (2,3-дигидро-(1 Н-имидазол-ил)1 Н-инден-ил)- метанол гидрохлорида, приготовленного согласно примеру 9 а и 0.30 г бензилхлорида смешивают и перемешивают 2 ч при 60- 70 С, Затем смесь охлаждают и разбавляют водой, толоул упаривают, а водный раствор подкислвют при охлаждении. Кислый раствор промывают эфиром и отделяют продукт в виде маслообразного слоя. Продукт экстрагируется в хлористый метилен как гидрохлорид.(0,84 г 50 О суспензии в минеральном масле)как реагента в сухом ТГФ как растворителе. 15После завершения реакции, смесь осторожно выливают в воду, ТГФ упаривают иэкстрагируют продукт этилацетатом.Выход 89. Гидрохлорид получают вэтилацетате, т.пл. 159-163 С, 20Масс-спектр: 318 (18, М), 287 (10, МОСНз), 273 (87, М СН 20 СНз), 132 (12, 273 СН 2 РЬ) 91 (100, С 7 Н 7 )НС-соль, 18 ЯМР (80 МГц, МеОН-б 4):д 3,24 (4 Н, с, инденовое кольцо Н 2 и Н 2"), 253,31 (ЗН, с, СНз), 3,50 (2 Н, с, -СК 20-), 5,37(2 Н, с, СН 2 Рп), 7,18 (4, с, инденоаое кольцоН, Н, Ни Н), 7,40 (5 Н, с, СН 2 СБНь),7,47 (1 Н, д, 3 = 1,5 Гц, им), 8,93 (1 Н, д, 31,5 Гц, им). 30П р и м е р 11, 4-(2,З-Дигидро-н-пропилН-инден-ил)-2-метил-имидазол.й-метилирован ие 4-(2,3-дигидро-нпропилН-инден-ил)-1 Н-имидазола (получение описано в 2167408) проводится 35согласно примеру 1, Продукт очищаютфлеш-хроматографией, элюент хлористыйметилен-метанол 95:5.Т.пл. гидрохлорида 84-86 С,Масс-спектр 240 (28, М), 211 (18, МСН 2 СНэ), 197 (100, М-СН 2 СН 2 СНз), 115 (16),98 (22),НО-соль, 1 Н ЯМР (80 МГц, МеОН-бфд 0,75-1,36 (5 Н, м, СН 2 СНз), 1,78-2,01(2 Н, м,СН 2 СН 2 СНз), 3,22 (4 Н, АВ кв. инденовое 45кольцо Н 2 и Н 2 з), 3,85 (ЗН, с,йСНз)г 7,047,29 (4 Н, м. аром.), 7,35 (1 Н, д, 3 = 1,5 Гц,им), 8,80 (1 Н, широк, с им).П р и м е р 12, 1-Этил- и 5-(2,3-дигидро-н-пропилН-инден-ил)1 Н-имидазол. 50й-этилирование 4-(2,3-дигидро-н-пропилН-инден-ил)-1 Н-имидазола проводится согласно примеру 1, Температурареакции 40-60 С, Выход неочищенного продукта 94, 551-Э тил-(2,3-ди гидро-н-пропилНинден-ил)-1 Н-имидазол,Т.пл, гидрохлорида 205-207 С,Масс-спектр: 254 (25, М ), 225 (16, МСН 2 СНЗ), 211 (100, М-СН 2 СН 2 СНз), 115 (10),НС-соль, 1 Н ЯМР (80 МГц, МеОН-б 4): д 0,79-1,44 (5 Н, м, СН 2 СНрСНз). 1,49 (ЗН, т, Э - 7,4 Гц, МСН 2-СНз), 1,77-2,00 (2 Н, м, СН 2 СН 2 СНз), 3,18 и 3,27 (4 Н, АВ кв, 3 = 16,0 Гц, инденовое кольцо Нр и Н 2 з),4,21(2 Н, кв, ,) =7,4 Гц МСН 2 СКз),7,04-7,29(4 Н, м, аром,), 7,4 В (1 Н, д, 3 -1,5 Гц, им), 8,92 (1 Н, широк, с им).1-Этил-(2,5-дигидроН-пропилН-инден-ил)1 Н-имидазол.Масс-спектр: 254 (32, М ), 211 (100, МСН 2 СН 2 СНз), 115 (13).П р и м е р 13. 2-Этил(1-атилН-имидазол- и 5-ил-)1-инданон,й-этилирование 2-этил-(1 Н-имидазол-ил)1-инденона проводится согласно примеру 5, с той разницей, что используется йодистый этил. Темпераутра реакции 60 С, время реакции 2 ч. Общий выход продукта (смеси изомеров) составляет 98 оь. Кристаллизация смеси изомеров из петролейного эфира дает чистый 2-этил-(1-этил-имидазол-ил)-1-инденон, 1,5-иэомер выделяют флеш-хроматографией, элюент метиленхлорид-метанол 95:5.2-Этил-(1-этил-и мида зол-ил)-1-и- ндено.Т.пл. основания 85-88 С,Масс-спектр: 254 (28, М ), 239 (16, МСНз), 225 (100. М-СН 2 СНз).Основание: 1 Н ЯМР (300 МГц, СДС 3): д 0,85(ЗН, тЗ =7,5 Гц, СН 2 СНз), 1,41(ЗН, т, 3 7,4 Гц,МСН 2 СНз), 2;02 (2 Н, кв, 3 =7,5 Гц, СН 2 СНз), 3,29 и 3,90 (2 Н, АВ кв, Здв = 17,6 Гц, инденовое кольцо Н 2), 3,90 (2 Н, кв, 3 = 7,4 Гц, ИСН 2 СНз), 6,94 (1 В, д, .Г = 1,3 Гц, им), 7,36 (1 Н, д, 3 = 1,3 Гц, им), 7,32-7,77 (4 Н, м, аром.),2-Этил-(1-атилН-и мидазол-ил)-1- инденон,Масс-спектр: 254 (23, М+), 225 (100, МСН СН), 197 (17), 115 (11).П р и м е р 14. 1-Этил-(2,3-дигидро- метоксиметил-инден-.л)-18-имидон.а). (2-(1-ЭтилН-имидазол-ил)-2,3-дигидроН-инден-ил)метанол.Н-зтилирование (2-дигидро-)1 Н-имидазол-ил)-1 Н-инден-ил)метанола проводится согласно примеру 9 б, с той разницей, что используется этилйодид, Температура реакции 40-60 С. Продукт очищают флеш- хроматографией, элюент метиленхларид - метанол 95;5, выход составляет 93 . Гидрохлорид получен в этилентате, т.пл. 102- 165 С,Масс-спектр: 242 (25, М ), 211 (100, МСН 2 ОН). 182 (12, 2 Н-СН 2 СН), 129 (10), 128 (10), 127 (1 О), 115 (21).НС-соль, 1 Н ЯМР (80 МГц, МеОН-бл):д 1;52 (ЗН, т,= 7,4 Гц, СНэ), 3,12 и 3,27 (4 НАВ кв, дв 16,4 Гц, инденовое кольцо Нги Нгэ),. 3;67 (2 Н, с, -СНБО-), 4,24 (2 Н, кв,7,4 Гц, -СН 2 СН), 7,08-7,32 (4 В, м, аром,), 7,54 5-1 Н-инден-ил)1 Н-имидазол .получают со" 15гласно примеру 9 с, Выход 83, Гидрохлорид получен в этилацетате, т.пл. 172-174 С.Масс-спектр: 256 (16, М 4), 225 (10, МОСНз), 211 (100, М-СН 2-0 СНз), 115 (14).НО-соль, 18 ЯМР (80 МГц, МеОН-бд); 20д 1,51 (ЗН, т,7;4 Гц СН 2 СНз), 3,27 (4 Н, с,инденовое кольцо Н 2 и Н 2 э), 3.,33 (ЗН, с,ОНОСНэ), 3,53 (2 Н, с, СН 20 СНз), 4,23 (2 Н,кв, Л = 7,4 Гц, СН 2 СНз), 7,06-7;32 (4 Н, м,аром,),7,53(1 Н, д.,=1,5 Гц, им), 8,88(1 Н,. 25д,= 15 Гц, им),Изобретение состоит в обнаружении.группы соединений, которые проявляют се-.лективный и длительный антагонизм к а 2 адренорецепторам. Эта группа соединений 30способна, например, повышать выделениеинсулина.Были испытаны соединения изобретения приведенные в табл. 1.Фармакологическая активность соединений данного изобретения определялась.следующим образом:1. щ-адреноцепторный антагонизм.Известно, что у крыс Ф агонисты вызы"веют расширение зрачков (мидризе 7), этот 40эффект передается через постсиноптйческие щ-рецепторы, Анестезированной крысе вводили внутривенно стандартную дозудетомидино, и затем в также внутривенноувеличивающиеся дозы изучаемого антагониста. За этим следовало образование вызванного детемидйном мидриезе. Былиопределены значения БД 50, то есть дозаантагониста, вызывающая ЗО обращение.Примеры и результаты этого теста представлены в табл. 2.Продолжительность а-блокирующегодействия соединений была определена следующим образом, антагонисты вводилисьорально группе из 4 крыс за 1,2,4,7 и 16 чдо 55анестезии и кумулятивного внутривенноговведения детомидина. При вычисленииантагонизма и мидриэтическому эффекту0,1 мг/кг детомидина для каждой группы было установлено соотношение. время-эффект. Это позволило определить время, необходимое для снижение эффектанаполовину, Результаты представлены втабл. 2,2. а 1-адреноцепторный антагонизм,Чтобы получить информацию также и оселективности антагониста между а 1 исФ рецепторами, их способность ингибировать а-рецепторы была. определена на изолированной мышце крысы. Соединениямисравнения были фенилзфрин, известный а 1.агонист и празопин, известный а 2-антагонист. Чтобы определить а 1-антагонизм, припомощи фенил эфрина вызывали мышечноесокращение и определяли значение рА 2 изучаемого соединения,Примеры и результаты этого теста также представлены в табл. 2.3, Возможность выделения инсулина иэизолированной,Следующей моделью для изучения способности соединений данного изобретенияблокировать постсинептические а 2-адреноцепторы и более того, показать возможность их применения в антидиэбетическойтерапии, было измерено выделение инсулина из изолированной крысы. Была выделенау крыс Зргацое-Оааеу при анестезией иперфуэирована п Итго через свою собственную артериальную систему с физиологическим раствором, содержащим глюкозу вконцентрации (11 мМ) подходящей для вызова умеренной секреции.инсулина.Образцы для определения концентрации инсулина в перфузате отбирались до ив течение 30 мин после прибавления изучаемого соединения + глюкоза. Инсулин анализировался при помощи ВА-Кт (йочо),Примеры и результаты этого теста представлены в табл. 3.Соединения данного изобретения реагируют с органическими и неорганическими кислотами с образованием множества фармэцевтически полезных солей, как например, иариды, бромиды, сульфаты, нитраты, фосфаты, сульфонэты, формиаты, тартраты, малеэты, цитраты, бензоаты, селицилаты, аскорбаты и т,п, Эти соли имеют такую же терапевтическую активность как и основания.Эти соединения и их нетоксичные фэрмакологически приемлемые соли могут вводиться орально, пэрентерально или внутривенно, При лечении диабетов предпочтительно вводить соединения орально в дневной дозе 0,1-10 мг/кг, предпочтительно1-2 мг/кг.1831479Таблица 2лицСоставитель Г.ЖуковаРедактор С.Кулакова Техред М.Моргентал "Коькаэ 2540 Тираж ПодписноеВНИИПИ Государственного комитета юо изобретениям и открытиям при ГКНТ СССР113035, Москва, Ж, Раущсквя наб 4/5зеодственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 1
СмотретьЗаявка
4742612, 08.12.1989
Фэрмос-Ихтюмя ОЙ
АРТО ЙОХАННЕС КАРЬЯЛАЙНЕН, РАЙМО ЭЙНАРИ ВИРТАНЕН, АРЬЯ ЛЕЕНА КАРЬЯЛАЙНЕН
МПК / Метки
МПК: C07D 233/58
Метки: замещенных, имидазолов, нетоксичных, приемлемых, солей, фармакологически
Опубликовано: 30.07.1993
Код ссылки
<a href="https://patents.su/8-1831479-sposob-polucheniya-zameshhennykh-imidazolov-ili-ikh-netoksichnykh-farmakologicheski-priemlemykh-solejj.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения замещенных имидазолов или их нетоксичных фармакологически приемлемых солей</a>
Предыдущий патент: Способ получения бициклических соединений или их солей
Следующий патент: Способ обработки порошка твердого цианурхлорида
Случайный патент: Резак а. с. кривовязюка для вырубки заготовок из плоского материала