Водорастворимые соли 2 замещенных 9-диэтил аминоэтилимидазо (1, 2-а) бензимидазола, проявляющие гипотензивную и противовоспалительную активность
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
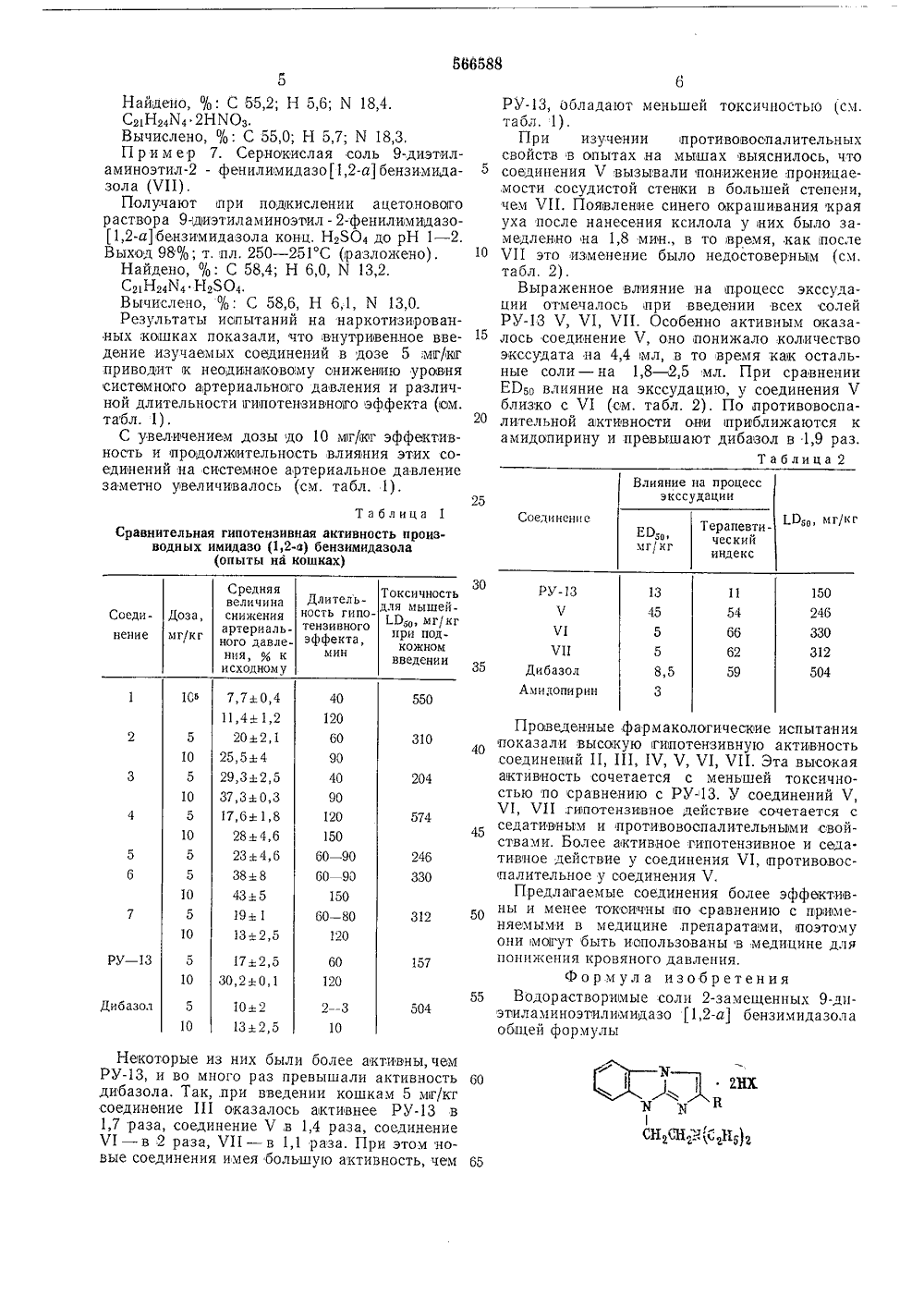
0) 566588 ОПИСАНИЕ ИЗОБРЕТЕНИЯ Союз Советских Социалистическнх Республик(23) ПриоритетОпубликовано 30.07.77. Бюллетень28Дата опубликования описания 23,08,77 1/475 51) М. 1(л.вА осударственный комитет авета Мнннстров СССРпо делам изобретений 15,7:616-0088,8), Г овалев,юренков нисимова, С.К. Фоминмени гой медици монов, Г, В. К И, Н. Т(71) Заявители Ростовский ордена Трудового Кр ниверситет и Волгоградский госуд дарс кий(54) ВОДОРАСТВОРИМЪ 1 Е СО 9-ДИЭТИЛАМИНОЭТИЛИМИДАЗО ПРОЯВЛЯЮЩИЕ ГИПОТЕНЗИВНУЮ ТЕЛЪНУЮ АКТИ-а бензимидазола опалительную акИзобретение относится к биологически активным соединениям, проявлязощим гипотензивную и аротивовоспалительную активность,Эти свойства позволяют применять их в медицине для лечения гипертонических кризов,начальных стадий гипертонии и стенокардии,Известно, что в медицинской практике дляпонижения кровяного давления при лечении,гипертонических кризов, начальных стадийгиаертонии и стенсткардии применяют дибазол, являющийся производньвм бензимидазола и проявляющий спазмолитическую и гипотензивную активность,1, Однако при лечении гипертонии дибазол оказывает недостаточно эффективное действ 1 ие и применяется 15лвтшь в комбинации с другими средствами,Более эффективные соединения (по силе идлительности гипотензивнэго,действия посравнению с дибазолом) найдены в рядуимидазо 1,2-абвнзимидазола. Из,них наиболее активен дигидрохлорид 9-диэтиламиногэтил - 2 - фенилимидазо 1,2-абензимидазола(РУ - 13) 2. П 1 роизводные ,2проявляют также р вотивность,Целью изобретения явлтипотензивной активности исичности производных иимидазола, а также расширеобладающих противовоспавием.С этой целью лредлагаетсрастворимые соли 2-замешенноэтилим идазо 1,2-а бензимформулы ется увеличение уменьшение токидазо 1,2-а 1 бензние ряда веществ, ительным дейстя применять водоных 9-диэтилампдазола обшей( 4 СН 2 СН 2 Ю(С 2 Н 5)2 4 и СНзОС 6 Н 4, трсг-С 41 де К - п-ВгСС 10 Нт, СвНь.Х - С 1, Вг, г)ОзП редл а гаем ые 04оединения об й форм ты оро- азо- давктивно ктивно ртернал длительокончи ь ко ть дибьно,гоностиостью,ейчем30 СН 2 СН 2 ж(С 2 Н,2 получают следующим ооразо Однако препарат РУ, а го в 3 - 10 раз превышает а ла по степени снижения а ления и в 10 - 50 раз по ствия, обладает большей т дибазол,И 2-ЗАМЕЩЕННЫХ 1,2-а БЕНЗИМИДАЗОЛА,И ПРОТИВОВОСПАЛИ- НОС3П р и м е р 1. Двгидрохлорид 2-и-бромфенил - 9 - диэтиламиноэтилимидазо 1-2-а бензимидазола (1).В горячий спиртовой или ацетоновый раствор 2,32 г (0,01 моль) 2-аииноР-диэтиламиноэтилбензимидазола,прибавляют 2,78 г (0,01 моль) и-бро 1 мфенацилбромида. Смесь тщательно перемешивают и оставляют стоять при комнатной температуре на 2 - 3 час. Выпавший осадок гидробромида 1-диэтиламиноэтил-бромфенацил - 2-иминобензимидазолина отфильтровывают, промывая на фильтре ацетоном и эфиром. Выход соли 4,5 г (88%); т. ал. 224 С (из спирта).Найдено, /о . С 49,1; Н 5,3; Вг 31,0; К 11,0.С 21 Н 25 ВгМ 40 НВг.Вьиислено, /о С 49,4; Н 5,3; Вг 31,3; К 11,0. Полученную четвертичную соль кипятят вконцентрированной соляной или бромистоводородной кислоте (в соотношении 1 т вещества 30 - 35 мл кислоты) 4 час. По охлаждении осадок отфильтровывают, промывают ацетоном и высушивают. Затем его растворяютв воде, раствор подщелачивают аммиаком.Выпавшее цгустое масло отделяют, высушивают, растворяют в спирте или ацетоне и подкисляют конц, НС 1 до рН 1 - 2. Выпавшийосадок дигидрохлорида 2-и-бромфенил-диэтиламиноэтилимидазо 1,2-а бензимидазолаотфильтровывают и кристаллизуют из спирта. Выход 97/о, т. пл. 246 - 247 С.Найдено, /о. С 52,9; Н 5,0; И 11,0.С,НВгИ 4 2 НС 1.Вычислено, /о. С 52,8; Н 5,2; К 11,6,П р и м е р 2. Дипидрохлорид 9-диэтиламиноэтил-:2-и - метоксифенилимидазо 1,2-а 1 бензимидазола (11).Смешивают спиртовой раствор 2,32 г (0,01моля) 2-аминаР-диэтиламиноэтилоензимидазола с 2,3 г (0,01 моль) и-,метоксифенацилбромида и,неоколыкими каплями конц. НВг иоставляют стоять на 2 - 3 час. Затем смесьразбавляют эфиром, осадок 1-диэтиламиноэтил-и-метоксифенацил- иминобензимидазолина в виде дигидробромида отфильвровывают, промывают ацетоном. Выход соли имина 90%; т. пл. 230 С (из спирта с эфиром).Найдено, %, С 48,9; Н 5,8; Вг 30,1; И 10,3.С,Н,8 К 40 2 НВг.Вычислено, /о. С 48,7; Н 5,6; Вг 29,6;М 10,3.Полученную соль,имина;кипятят в конц.НС 1 3 - 4 час. По охлаждении раствор нейтрализуют концентрированнььм раствором аммиака, экстрагируют хлороформом. Остатокпо испарении хлороформа обрабатываютспиртовым раствором хлористого водорода,разбавляют эфиром и осадок отфильтровывают. Выход дигидрохлорида 11 90/,; т. пл.242 С (из спирта с эфиром),Найдено, о/о: С 60,5; Н 6,5; С 1 16,0; Х 13,0,С 2 Н 28 К 40 2 НС 1.Вычислено, %: С 60,7; Н 6,5; С 1 16,3; Х 12,9.П р им е р 3, Дигидрохлорид 9-,диэтилами 5 10 15 20 25 30 35 40 45 50 55 60 65 4ноэтил- трет - бутилимидазо 1,2-а 1 бензимидазола (11).Полученная при взаимодействии 2-амино диэтиламиноэтилбензимидазола с бромпина.колином с выходом 90/о, четвертичная сольпредставляет собой белоснежные кристаллыс т. пл. 184 С (из спирта).Найдено, %: С 46,3; Н 6,4; Вг 32,1; И 11,3.С 19 НзоИ 40 2 НВг.Вьиислено, %: С 46,3; Н 6,6; Вг 32,5; Х 11,4.Циклизуют соль кипячением в концентрированной соляной кислоте и выделяют искомыйдигидрохлорид аналогично вышеописанному.Выход 94%, Белоснежные иголочки; т, пл.231 С (разложение из водного спирта). Соединение растворимо в воде, горячем спирте,Найдено, %: С 59,3; Н 7,8; С 1 18,5; И 14,3.С 19 Н 28 К 4 2 НС 1.Вычислено, %: С 59,2; Н 7,8; С 1 18,4; К 14,5.П р и м е р 4. Дигидрохлорид-диэтиламиноэтил - 2 а - нафтнлимидазо 1,2-а 1 бензимидазола (17).Нециклический дигидробромид 2-иминодиэтиламиноэтил - За - нафтоилметилбензимидазолина получен при смешении насыщенногоацетонового раствора 2-амино-диэтиламиноэтилбензимидазола с а-бромацетилнафталином и несколькими каплями НВг. Выход 85%;т. пл, 215 С (из спирта с эфиром).Найдено, %: С 53,6; Н 5,5; Вг 28,2; И 10,2.С 5 Н 28 И 40 2 НВг,Вычислено, %, С 53,4; Н 5,4; Вг 28,4; 1 Ч 10,0.Полученная соль имина циклизуется прикипячении в 1 конц. НС 1 или НВг (5 - б часов)в искомое производное имидазо 1,2-а 1 бензимидазола. Выделение дигидрохлорида проводят аналотично вышеописанному (см. при;мер 1). Белоснежные иголочки с тпл. 241(1).Получают при циклизации гидробромида 1 диэтиламиноэтил-фенацил - 2-иминобензимидазолина в конц. НВг (3 час). Выпадавший поохлаждении белоснежный осадок дигидробромида Ч отфильтровываютпромывают ацетоном и кристаллизуют из спирта, Выход 95%;т. пл. 275 - 276 С.Найдено, %: С 50,9; Н 5,1; Вг 32,2; И 11,6.С 21 Н 4 М 4 2 НВг.Вычислено, /о. С 51,0; Н 5,3; Вг 32,2; Х 11,4.П р и м е р 6. Азотокислая соль 9-,диэтиламиноэтил- фенилимидазо 1,2-а 1 бензимидазола (И).К насыщенному спиртовому или ацетоновому раствору 9-диэтиламиноэтил-фенилимидазо,1,2-а 1 бензимидазола прибавляют по каплям конец. НКОз до,рН 1 - 2, Выпавший осадочекотфильтровывают, промывают эфиром и ацетоном. Выход 97 О/о; т. пл. 181 - 182 С (разложение из спирта) .866588 Най,дено, %: С 55,2; Н 5,6; гч 18,4.С 21 Н 24 М 4 2 НКОЗВычислено, %: С 55,0; Н 5,7; Х 18,3, П р и м е р 7. Сернокислая соль 9-диэтиламиноэтил- фенилимидазо 1,2-а бензимиазола (И),Получают при подкислении ацетонового раствора 9-диэтил а м иноэтил - 2-фенилимидазо,2-абензимидазола конц. НЬ 04 до рН 1 - 2. Выход 98%; т. пл, 250 - 251 С (разложено).Найдено, %: С 58,4; Н 6,0, К 13,2.СмН 4 Х 4 НЯ 04Вычислено, %; С 58,6, Н 6,1, Х 13,0.Результаты испытаний на наркотизированных кошках показали, что внутривенное введение изучаемых соединений в дозе 5 ъпг/кг приводит к неодинаковому снижению уровня системного артериального давления и различной длительности гипотензивноуо эффекта (см. табл. 1).С увеличением дозы до 10 мг/кг эффективность и продолжительность влияния этих соединений на системное артериальное давление заметно увеличивалось (см. табл. 1). Влияние на процесс экссудацииТаблица 1 Сравнительная гипотензивная активность производных имидазо (1,2-а) бензимидазолаСоединение 1.00, и г/к г Терапевтический индекс ЕОа 0, мг/кг 30 Средняявеличина снижения артериального давления, % к исходному РУ ЧЧ 1И 135 ДибазолАмидопирин 1345558,53 150 246 330 312 504 11 54 66 62 59 Токсичность для мышей-1150 мг/КГпри подкожном введении Длительность гипотензивного эффекта,мин Соединение Доза, мг/кг 165 550 310 204 574 246 330 312 5 10172,530,20,1 РУ - 13 60120 157 Дибазол 102132,5 2 - 3 504 10 10 Некоторые из них были более активны, чем РУ, и во много раз превышали активность дибазола. Так, при введении кошкам 5 мг/кт соединение 111 оказалось активнее РУв 1,7 раза, соединение Ч,в 1,4 раза, соединение И - в 2 раза, И 1 - в 1,1 раза. При этом новые соединения имея большую активность, чем 12 НХ 60 1Н 20 Нф-фя) 65 5 10 5 10 5 10 5 5 10 5 10РУ, обладают меньшей токсичностью (см.табл, 1),При изучении противовоспалительныхсвойств в опытах,на мьппах выяснилось, чтосоединения Ч вызывали понижение проницае,мости сосудистой стеньки в большей степени,чем И 1. Появление синего окрашивания краяуха после нанесения ксилола у них было замедленно на 1,8 мии в то время, как после10 И это изменение было недостоверным (см.табл. 2).Выраженное влияние на процесс экссудации отмечалось при введении всех солейРУЧ, И, И 1. Особенно активным оказалось соединение Ч, оно понижало количествоэкссудата на 4,4 )мл, в то время как остальные соли - на 1,8 2,5 мл. При сравненииЕРзэ влияние на экссудацию, у соединения Чблизко с И (см. табл. 2). По противовоспалительной активности они приближаются камидопирину и превышают дибазол в 1,9 раз.Таблица 2 Произведенные фармакологические испытании40 показали высокую гипотензивную активностьсоединений 11, 111, Ч, Ч, И, И. Эта высокаяактивность сочетается с меньшей токсичностью по сравнению с РУл 13. У соединений Ч,И, Ч 11 .гипотензввное действие сочетается с45 седативным и противовоспалительными свойствами. Более активное типотензивное и седа.тивное действие у соединения И, противовоспалительное у соединения Ъ.Предлагаемые соединения более эффективны и менее токсичны по сравнению с применяемыми в медицине, препаратами, поэтомуони могут быть использованы в медицине дляпонижения кровяного давления,Формула изобретения55 Водорастворииые соли 2-замешенных 9-диэтиламиноэтилимидазо 1,2-а 1 бензимидазолаобцей формулы566588 Составитель С, Малютина Техред А. Камышникова Корректор О. Тюрина Редактор Л. Герасимова Заказ 1889/16 Изд Ъго 632 Тираж 693 Подписное НПО Государственного комитета Совета Министров СССР по делам изобретений и открытий 113035, Москва, )К, Раушская наб., д. 4/5типография, пр. Сапунова, 2 аде К - п-ВгСаН 4, п-СНзОС,Н 4, трет-С 4 Нз,а-С 1 оНт, СаНБ, Х С 1 Вг ХОз 504 проявляющие гипотензивную и противовосаалительную активность. 8 Источники информации,принятые во внимание при экспертизе 1, Справочник лекарственных препаратов,М., /Медицина, 1970, с. 35. 5 2. Фармакология и токсиколо 1 гия, том 36,1973, с. 232.
СмотретьЗаявка
2159549, 22.07.1975
РОСТОВСКИЙ ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ, ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ
СИМОНОВ АНДРЕЙ МИХАЙЛОВИЧ, КОВАЛЕВ ГЕННАДИЙ ВАСИЛЬЕВИЧ, АНИСИМОВА ВЕРА АЛЕКСЕЕВНА, ГОФМАН СВЕТЛАНА МИХАЙЛОВНА, ТЮРЕНКОВ ИВАН НИКОЛАЕВИЧ, ФОМИН ЮРИЙ КОНСТАНТИНОВИЧ
МПК / Метки
МПК: A61K 31/4184, A61K 31/4188, A61P 29/00, A61P 9/12
Метки: 2-а, 9-диэтил, активность, аминоэтилимидазо, бензимидазола, водорастворимые, гипотензивную, замещенных, противовоспалительную, проявляющие, соли
Опубликовано: 30.07.1977
Код ссылки
<a href="https://patents.su/4-566588-vodorastvorimye-soli-2-zameshhennykh-9-diehtil-aminoehtilimidazo-1-2-a-benzimidazola-proyavlyayushhie-gipotenzivnuyu-i-protivovospalitelnuyu-aktivnost.html" target="_blank" rel="follow" title="База патентов СССР">Водорастворимые соли 2 замещенных 9-диэтил аминоэтилимидазо (1, 2-а) бензимидазола, проявляющие гипотензивную и противовоспалительную активность</a>
Предыдущий патент: Способ получения таблеток
Следующий патент: Способ получения 5-фосфодиэстеразы
Случайный патент: Многофазный мультивибратор