Способ получения n-нитрозо-n-(бэта-хлорэтил) карбамоилпептидов или их кислотно-аддитивных солей
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
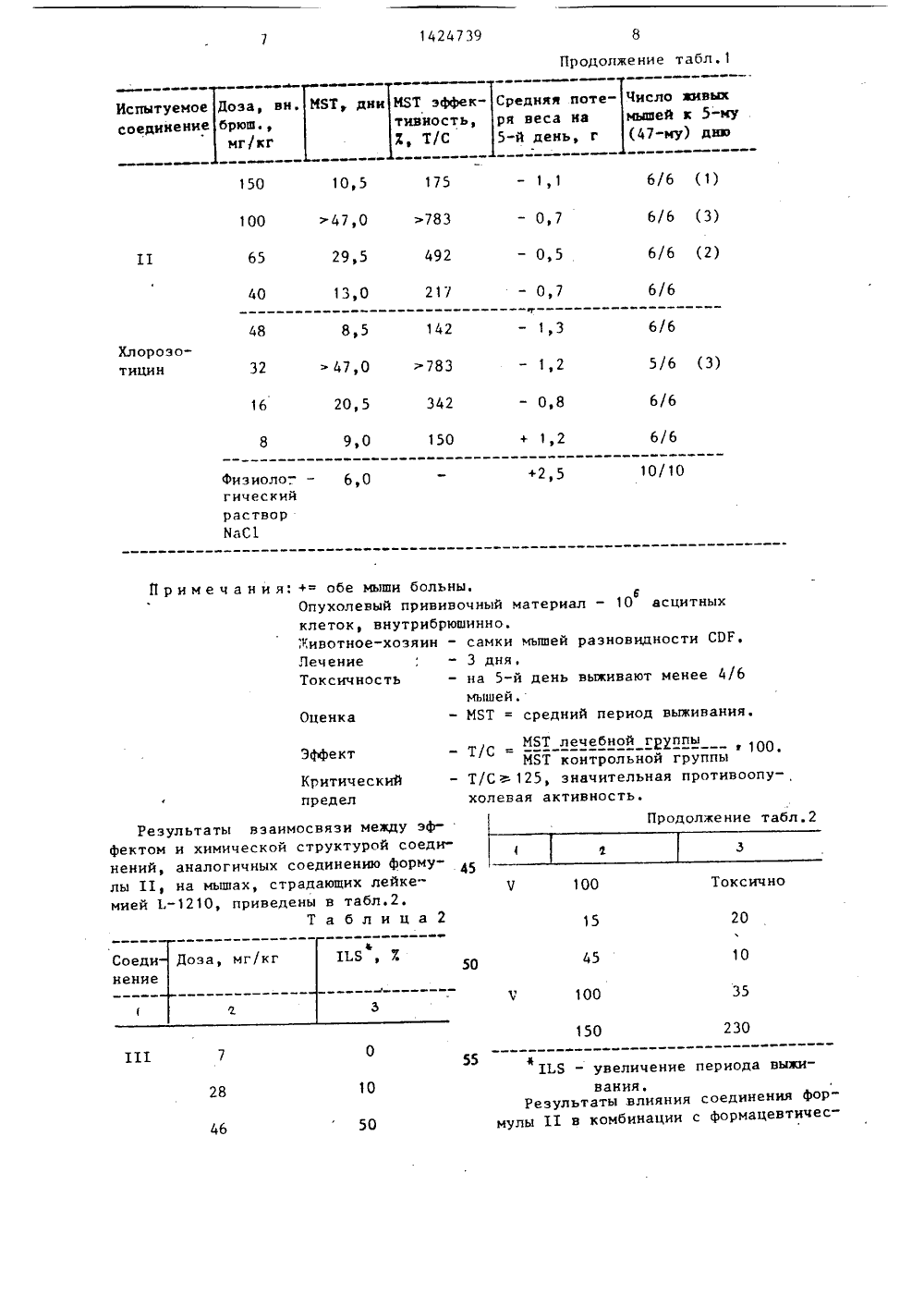
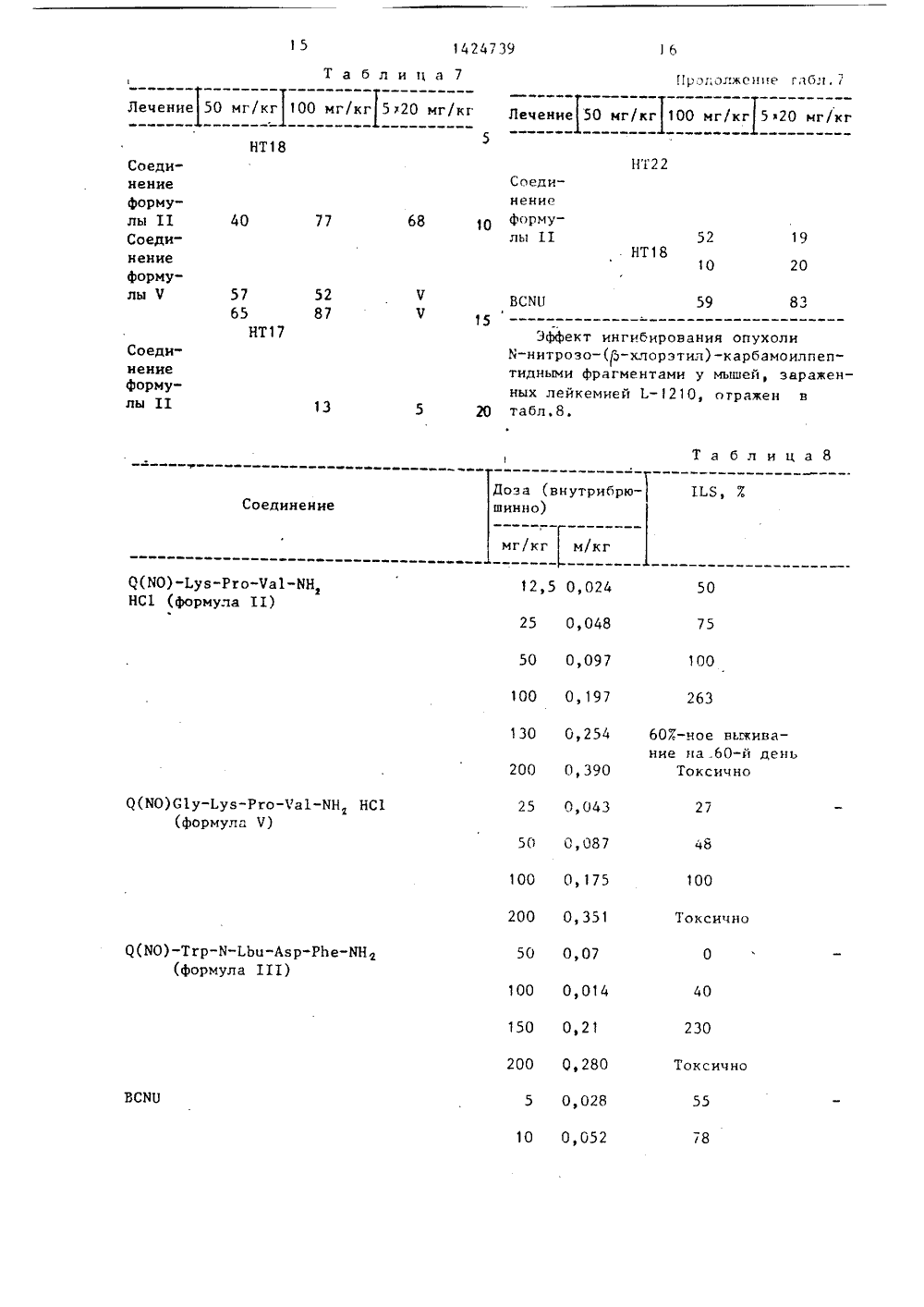
СОЮЗ СОЕ-:ТСНИХСОЦИАЛИСТИ 4 ЕСНИ 8014 сю 4 С 07 К 5/10 / 1 К 37 0 ПИСАНИЕ ИЗОБРЕТЕПАТЕНТУ йЬ.",.в У 34ер еш Ведьесет альман Медэихрадски, Карой Л раш Йенеи (НБ) 088,8)етаг, Современныа в органическо1967, с. 377. с" иш) и. М.: Хим К-НИТРОЗО-КИЛПЕПТИДОВ ИЛИ СОЛЕЙ 54) СПОСОБ ПОЛУЧЕН (БЭТА-ХЛОРЭТИЛ) КАРБ ИХ КИСЛОТНО-АЛДИТИВ(57) Иэобре пептидов, в тся замещенныхполучения К" ние ка астнос ГОСУДАРСТВЕННЫИ НОМИТЕТ СССРПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИИ(71) Хиноин ДьедьТермекек Дьяра РТ(72) Хелга Шюли,ки, Хедвиг МедзихЛасло Коппер и Ан(56) Вейганд-Хильгметоды эксперимент нитрозо-К-(бзта-хлорэтил)карбамоилпептидов ф-лы 1 С 1 СН СН -К(-КО)-С(0)КН 3 К, где и 1, К - Ьув-РгоЧа 1-КН,; С 1 у-Ьув-Рго-Ча 1-КН, Тгр-КтЬеи-Авр-РКе-КН, Тгр-С 1 У-Ьув-Рго-Ча 1 КН 1, Тгр-Ьец-Авр-РЬе-КН, п=2; К -Ьув-Рго-Ча 1-КН, или их кислотно-адднтивных солей, которые могут бытьиспользованы в медицине. Цель - создание новых более активных пептидов.Их синтез ведут из соединений Ф-л 11и 111: (НК) -К (11), С 1-СН СН-КС(0) (111), где К и п имеют укаэанные значения, с последующим нитрованием с помощью азотистой кислоты илихлористого нитрозипа. Целевой продукт выделяют в свободном виде илив виде соли. Новые пептиды обладаютв сравнении с известными аналогами(не содержащими нитрозогруппы) лучшими противоопухолевой активностью итоксичностью (ЬП =360 мг/кг).8 табл.17 1424739 18 оэа (внутрибинно) ПЗ, 1 единение г/кг м/кг 0 0,112 8 0,212 15 Токсич 12 0,015 19 100 03 30 16 0 О,0 О,е опедеяли Токсичн Не определяли Не о-Ча 1-ЯН 085-Ьув-Рго-С 1 у О. ЬЗ зми цитостатическими агентами, чем ВСЯ 11, хлороэотицин, пептидамнды, не содераащие нитроэогруппы. Реэультат ют, что полу соединения я-Ьув-Рго-Ча 1-ЙН 2 СН СООНаи м е ч а н и е. ЙС 1-СН СН -Я-С 1 исследований покаэыванные по иэобретениюяются более эффективны 50 0,061 100 О, 122 200 0,244 00 0) 140 50 0,210 00 0,280 1 О 0,018 20 0)036 80 0,144 50 0,109 Продолжение табл,8,ределялиНе определялиИзобретение относится к способуполучения М-нитрозо-Я-(бета-хлорэтил)карбамоилпептидов или их кислотноаддитивных солей - новых биологичес 5ки активных соединений, которые могутнайти применение в медицине,Цель изобретения - получение новыхпроизводных в ряду пептидов, обладающих более высокой противоопухолевой 10активностью.Синтез И-(2-хлорэтил)карбамоилпептидов,К 102-ному раствору пептида, содержащего один эквивалент свободной 15аминотерминальной Функции в диметипФормамиде, по каплям при 0 С добавляют 1,1 эквивалента 2-хлорэтилизоцианатаРеакционную смесь перемешиовают в течение 2 ч при 0 С, а затем 20отстаивают ночь при комнатной температуре. Диметилформамид отгоняют ввакууме, остаток обрабатывают водойи фильтруют,Синтез М-/(2-хлорэтил)-И-нитрозокарбамоил/-пептидов:а) Нитрование смесью ИаКО/муравьиная кислота.1 ммоль Я-(2-хлорэтил)карбамоилпептЪда растворяют в 8 мп 98-1003-ной 30омуравьиной кислоты при 0 С, охлаждаяи перемешивая, По каплям добавляют300 мг нитрита натрия в 2 мл воды.,Реакционную смесь выстаивают в течение ночи в холодильнике, после чегоотгоняют растворитель, Дистилляционный остаток обрабатывают водой иФильтруют. При необходимости продуктможно дополнительно очистить на кочлонке с силикагелем методом хроматографин;в) Нитрование с помощью хлористого нитрозила в присутствии трет-бутоксикарбонкл (защитной группы),1 ммоль М-(2-хлорэтил)карбамоилпептида растворяют в 10 мл безводногсопиридина при -20 С. К раствору покаплям при перемешивании добавляют1 мл дихлорметана, содержащего 12 ммоль хлористого нитрозила. После 50перемешиваиия в течение часа реакционную смесь концентрируют в вакууме.Дистилляционный остаток растворяютв этилацетате и дважды экстрагируютледяной водой. Органический слой сушат над сульфатом натрия, растворотфильтровывают, этилацетат упариваютв вакууме.Дистилляционный остатоковыстаивается 2 ч при 0 С в 5 мл 981007.-ной муравьиной кислоты. Затем к нему добавляют 1 мл муравьиной кис" лоты содержащей 0,12 ммоль хлористо- водородной кислоты. Полученный раствор выпаривают в течение 10 мин. Дис" тилляционный остаток растворяют в воде и лиофилиэируют. В случае необходимости продукт может быть очищен методом хроматографии на колонке с силикагелем.П р и м е р 1. Альфа, эпсилонбис-(бета-хлорэтилкарбамоил)-лиэилпролилвалинамид.Раствор 736 мг (1,6 ммоль) лиэил" пролилвалинамиддиацетата в 8 мл диметилформамида охлаждают до 0 С. Далее в раствор по каплям добавляют 0,46 мл (3,2 ммоль) триэтиламина и 0,34 мл (4 ммоль) бета-хлорэтилиэоцианата. Реакционную смесь перемешивают при 0 С в течение 4 ч, после чего дают ей постоять и перегоняют в вакууме. Остаток смешивают с водой, выпавший в осадок продукт отделяют фильтрованием и сушат. Таким образом получают 480 мг указанного в названии примера соединения. Выход 543;от,пл, 183-185 С, К 1 0,75 (смесь н-бутанола с пиридином, ледяной уксусной кислотой и водой в соотношении 4:1: 1:1; тонкослойная хроматографическая обработка с использованием Киэельгеля С" фирмы Иерк).Найдено, С 47,90 ф, Н 7,60; М 17,41 С 1 13,26.С, НМИт О С 12 (552,5)Вычислено, 7: С 47,82, Н 7,11;И 17,74 С 1 12,83.П р и м е р 2, Альфа, эпсилон-бис /М-нитрозо-В-(бета-хлорэтил)-карбамоил/-лизилпролилвалинамидК 552 мг (1 ммоль) альфа, эпсилонбис-(бета-хлорэтилкарбамоил)"лизилпролилвалинамида добавляют 10 мл 99 Е- ной муравьиной кислоты, после чего в течение часа добавляют в эту смесь по каплям раствор 500 мг нитрита нат" рия и 3 мл воды. На следующий день реакционную смесь выпаривают в вакуумеОстаток обрабатывают водой, Фильтруют и промывают водой. Таким образом получают 460 мг указанного в названии примера соединения; выход 753.К 0,80 (смесь метанола с этилаце татой в соотношении 1:3, тонкослойная хроматографическая обработка с7390,1 мл (1,2 ммоль)-хлорэтилизоцианата. Реакционной смеси дают отстояться в течение ночи при комнатной5 температуре затем растворитель упаФривают в вакууме. Остаток очищаютхроматографией на колонке, заполненной силикагелем. В качестве элюентаиспользуют смесь метанола и этилаце 10 тата в соотношении 3:1. Фракции, содержащие основной продукт, собирают.Растворитель отгоняют в вакууме. Таким образом получают 430 мг М,-/КЪ-хлорэтил)-карбамоил/-третичный15 бутилоксикарбониллизилпролилвалинамида.-.Выход составляет 783, К 0,90(смесь этилацетата, пиридина ледянойуксусной кислоты, воды в соотношении240:20:6;11, тонкослойная хроматография, К 1 еае 18 е 1 Мегс 125 Найдено, 7: С 1 6,56.СмНдКО 6 С 1 (547, )Вычислено, 7: С 1 6,48,К раствору из 547 мг (1 ммоль)о-(К- ф-хлорэтил)-карбамоил) -Е-трет.30 бутилоксикарбонил-лизилпропилвалинамида и 10 мл безводного пиридина до-,бавляют по капле смесь из 1 мл(1,2 ммоль) нитрозилхлорида и 1 млдихлорметана при -20 С с одновремен35ным перемешиванием раствора. Послеперемешивания в течение часа реакционную смесь упаривают в вакууме. Остаток растворяют в этилацетате приОС и дважды экстрагируют ледяной40 водой, Этилацетатную фазу сушат надбезводным сульфатом натрия, этилацетат отгоняют в вакууме. Остаток отстаивается в течение нескольких часовв 5 мл 98-1007-ной муравьиной кислоты45 при 0 С. Затем добавляют 1 мп муравьиной кислоты, содержащей 0,12 ммольхлористо-водородной кислотыи через10 мин упаривают раствор в вакууме.Остаток очищают хроматографией на ко 50 лонке, заполненной силикагелем, при0 С смесью этилацетата, пиридина ледяной уксусной кислоты и воды в соотношении 60:20:6:11. 31424использованием продукта "КизельгельС" фирмы Мерк),Я=184 (К-нитроэогруппа, 397 нм).Найдено, Х: С 1 11,41; К 20,10.С,НтКОтС 1 (611,51)Вычислено, 7: С 1 11,59; К 20,61,П р и м е р 3. Бета"хлорэтилкарбамоил-триптофил-норлейцкп-альфа-аспарагил-фенилаланинамид,615 мл (1 ммоль) триптофил-норлейцил-альфа-аспарагил-фенилаланинамидгидрохлорида растворяют в 6 мл безводного диметилформамида, после чегов приготовленный раствор добавляют0,14 мл (1 ммоль) триэтиламина и0,1 мл (1,2 ммоль) бета-хлорэтилизоцианата, в дальнейшем реакцию проводят аналогично примеру 1. Таким образом получают 600 мг укаэанного в названии примера соединения; выход 887,К 0,72 (смесь н-бутанола, уксуснойкислоты, воды в соотношении 4:1:1),т.пл. 201-202 С.Найдено, 7: С 1 4,94 К 13,78.С, Н,Кт ОС 1 (684, 19)Вычислено, Х: С 1 5,18 К 14,33.П р и м е р 4, К-нитроэо-К-(бетахлорэтил)карбамоилтриптофилнорлейцилальфа-аспарагнл-фенилаланинамид 111,684 мг (1 ммоль) бета-хлорэтилкарбамоил-триптофил-норлейцил-альфа-ас-.парагил-фенилаланинамида используютдля реакции с раствором 300 мг нитри.та натрия и 2 мл воды, как изложенов примере 3. Таким образом получают605 мг указанного в названии примерасоединения. Выход 853. К 0,80 (смесьн-бутанола с ледяной уксусной кислотой и водой в соотношении 4:1:1, продукт Кизельгель С" фирмы Керк).Найдено, 7: С 1 4,73; К 15,28,Ко 3,87, С 55,50 Н 5,77.С Н,КОС 1 (713,20)Вычислено, Х: С 1 4,97, К 15)71;. КО 4,201 С 55,52; Н 5,75.Поскольку в диапазоне поглощениянитрозогруппы имеет место поглощениесамого пептида, нитроэную группу определяют по методу Лоои Диона.П р и м е р 5. Ы,-/К-нитрозо-К(хлорэтил)-карбамоип/-лиэилпролилвалинамидацетат 11,К 614 мг (1 ммоль) 6-третичногобутилоксикарбонил-лизилпролилвалинамидтоэилата в 10 мл безводного диметилформамида при охлаждении снегоми перемешивании добавляют по каплям0,14 мл (1 ммоль) триэтипамина и Фракции, содержащие основной продукт, собирают, упаривают, остаток лиофилиэируют путем растворения в воде.Выход - 390 мг (727).1424739 25 Таблица 1 Испытуемое Доза, вн. МЯТ дни МБТ эффек- Средняя поте- Число живыхсоединение брюш тивность ря веса на мьппей к 5-му мг/кг 7 Т/С 5-й день, г (47-му) дню 40 ъ 470 783 1,4 6/6 (5) ВСМА 470) 783 0,8 6/6 (5) 30 6/6 142 8,5 1,5 200 6/6 (2) 6/6 (3) 12,0 200 0,6 130 47,0 783 0,8 70 6/6 233 14,0 0,3 40 Целевое соединение: К 0,33 (смесьэтилацетата, пиридина, ледяной уксусной кислоты и воды в соотношении60:20:6:11) тонкослойная хроматогра 5фия, Кдезе 18 е 1 С.Мегс 1 с, К 0,64:11), К 0,64 (бутанол:пиридин:ледя"ная уксусная кислота:вода 4:1:1:1),Найдено 7: С 49,71; 5,85;И 17,08; 0 15,71, С 1 8,88.С, НМО,С 1 (755,77)Вычислено, Ж: С 50,85; 6,40;И 18,53, 0 14,82, С 1 9,83.Эжилон корр.: 88,40 нм. Измеренпри использовании метанола в качестве растворителя, концентрация 104 моль/л, при 25 С.Проведены биологические испытанияполученных соединений.При изучении влияния соединенийна лейкемию Еимплантированнуюмышам, в качестве тестовых соединенийиспольэовали с б-бис-/И-нитроэо-И"/-хлорэтил/-карбамоил/лизилпролилввлинамид (далее в тексте соединение 1)и с -/И-нитрозо-И-//-хлорэтил/-карбамоил-лизилпролилвалинамид гидрохлорид (далее в тексте соединение 11).Полученные результаты приведеныв табл.1-4.В табл.1 показано влияние соединений 1 и 11 на внутрибрюшинно имплантированную мышам лейкемию 1.-1210.Оба соединения оказались более активными, чем 13-бисф-хлорэтил/-1 нитрозомочевина (далее в текстеВСИЦ) и 2-/3-(2-хлорэтил) -3-нитрозоуреидо/2-дезокси-глюкопираноза1424739 Продолжение табл.1 Средняя поте- Число зивых ря веса на мышей к 5-му 5-й день, г (47-му) дню МБТ эффективность,3, Т/С МБТ дни Доза, вн.брюш.,мг/кг Испытуемое соединение 150 47,0 783 29,5 492 100 0,7 6/6 40 217 13,0 0,7 6/6 48 1,3 Хлороэотицин 5/6 (3) 32 1,2 6/6 16 0,8 6/6 89 э 0 150+2,5 физиоло- гический растворИаС 1 Примечан и я: += обе мыши больны.6Опухолевый прививочный материал - 10 асцитныхклеток, внутрибрюшинно.Животное-хозяин - самки мышей разновидности СРР.Лечение 3 дня.Токсичность - на 5-й день выживают менее 4/6мышей.Оценка - МБТ = средний период выживания,Эффект Критическийпредел езультаты в фе ктом и химичес ений, аналогичн ы 11, иа мышах, ией 1.-1210, при То 20 10 0 ванияРезультаты вы 11 в комби ния фор- евтичесния сое ии с фо 50 142 47,0 783 20,5 342аимосвязи между эфой структурой соед х соединению форму страдающих лейке" едены в табл.2.Таблица 6/6 (1) 6/Ь (3) 6/6 (2) МБТ лечебной грппыМБТ контрольной группы - Т/С125, значительная противоопухолевая активность. Б - увеличение периода выжи25 125 3 1 О 1, 805,912505,91,2, 1105,6 150 2 44 350 2 0 2 77 150 110 41030 ние, соответствующее 7+812. Лече 77 35 ние, соответствующее 7+913. Лече 40 ние, соот- ветствующее 7+10 14. 1 лечения 70 3 33 3 70 1 50 1 20 15. ВС%316. Лечение, соот- ветствующее 14+15 В,а меланома Опухоль Льюиса Лечение Средняя дли ЬЯ,тельность выживания, дни Средняя дли ЬБ,тельность вы. живания, дни 210 26,0 КонтрольСоединение 11: 100 мг/кг 31,5 21,5 22,0 кими добавками на мышей, страдающихлейкемией Е, приведены в табл.З. Т а б л и ц а 3Соединени Лечение 4, ВСЯУ5. Лечение, соот- ветствующее 2+36. Лечение, соот- ветствующее 1+47. 118. Цикло-.фосфамид 9.Дибромдульцитол 1 О.ВСМУ11. ЛечеРезультаты влияния соединения формулы 11 на выживание мьппей, страдающих лейкемией Е, приведены в табл.4. 11 112,5 1 50 150 1 87 1"133 1 125 2 44 125 3 33 1100 3 45Внутрибрюшинное применение в день, указанный после трансплантации. Время выживания Время выживау мышей лечеб- ния в группеюной группы - без лечения 1 Ы ----------- " хВремя выживания в группе без х 100Выживание на 60-й день послетрансплантации,45Результаты влияния соединения 11на твердые опухоли приведены втабл.5.Т а б л и ц а 51424739 родоп;:;япе г з бл . 5 Опухоль Льюиса В,к меланома Лечение Средняя дли.Б Средняя дли ЕЯ тельность вы- Й тельность вы- Х аивания, дни живания дни 520 мг/кг 27,0 29 35,0 35 В С%3 20 мг/кг 28,5 420 36 61 5 к 4 мг/кг 25,0 34,0 31 Внутрибрюшинное применение с 1-го дня послетрансплантации Т 1) СП 35 40 45 50 55 А) опухоль Б,п (подкожно). Дозировка 100 мг/кг или 5 к 20 мг/кг,внутрибрюшинное введение (начало лечения в день после трансплантации), оказалось неэффективным.В) Легочная меланома Льюиса и меланома В,п - метастазирующие опухоли мьппей (1ш.)С) Опухолевые ксенографты,человека (Я. с.):30НТ 18 (ате 1 апотдсцзше 1 апоша) Контооль (среднее), дней 22,5100 мг/кг 50,0 1,05"20 мг/кг 56,25 1,5НТ 22 (крупнаякарцинома толстой кишки)Контроль 17,0100 мг/кг 24,0 0,295"20 мг/кг 21,5 0,26НТ 17 (аденоматозная карциноматолстой кишки)Контроль 16,5100 мг/кг 14,75 0,05 к 20 мг/кг 5,0 0,0Время начала лечения - наличие опухоли, имеюшей размер примерно 8 ммСпособ лечения; внутрибрюшинное введение.ТР=удвоение объема опухоли.К -лечебная группа; К,-контрольная группа.Влияние производных пептид-нитрозомочевпны на рост экспериментальных твердых опухолей и опухолевых ксенографтов человека приведены в табл.6 7.Исследуемые соединения:Х-нитрозо-Я-(Р-хлорэтил)-карбамоил-лизилпролилвалинамид НС 1 (соединение 11);И-нитрозо-И- ф-хлорэтил)-карбамоил-глицил-лизилпролилвалинамид НС 1 (соединЕние Ч).Основные объекты:а) экспериментальная твердая опухоль: мышиная опухоль Б, легочная опухоль Льюиса и мышиная Вп мела- нома;б) опухолевые ксенографты человека: амеланотивная меланома НТ 18, колоректальная аденокарцинома НТ 17, колоректальная аденокарцинома НТ 22 (муиипозная) карцинома годжелудочной железы НТ 27. Опыты на экспериментальных твердых опухолях: опухоль разрезали на мелкие куски, которые трансплантировали под шкуру на спине мыши разновидности С 1 ГР, Лечение начинали на следующий после трансплантации день. Размер орухоли измеряли кронциркулем, объем рассчитывали по диаметру.Соединение 11 применяемое нутрибрюшинно в дозе 100 мг/кг и 5"20 мг/кг (одна дозировка в течение 5 дней), не оказывало влияния на рост опухоли.Легочная опухоль Льюиса: опухоль трансплантировали в виде клеточной суспензии в бедренную мь.шцу инбредных1424739 13 Т а б л и ц а 6 Опухоль Льюиса Лечение Средняя выжи ЕБ ваемость, дни Е Средняя вы 11,Б,живаемость, Е и КонтрольСоединение 11100 мг/кг 26 31 2,0 5,4 мг/ 25,0 да выживания величение ерио 5 орезультатам увеличивает Согласно полу соединение 11 ум длительность жиэ опухоли Льюиса, В, . Степень эффе опухоли практиче фекту от ВСЮ, и стве сравнительн чен еренн ни животных как пр так и при меланом гибированиявивалентна эфуемому в качеединения. кта ск поль го с 40 Объем обработанноопухоли на 21-йдень Объем обработанной опухоли в 0-й день Эффект ингибирования опухол ольной опухоли на 21-й трольной опухоли в 0-й Объем ко - Объем ен(1007полн рост амелаингибирование роста как их влияопухоли)Реэультвают, что эомочевины ых и пан лось бол азы- итроы экспериментовоизводные пептидкаэывают значит ьн мьппей разновидности С 57 В 1 при количестве клеток 10 . Растущая опухольрегулярно давала легочные метастазы,Лечение начинали в день, следующий эа 5трансплантацией. Наблюдали выживаемость животных в лечебной и контрольной группах,Меланома В,: опухоль трансплантировали под шкуру на спине инбредных Изучение опухолевых ксенографтов человека: кусочки опухолей, которые можно серийно трансплантировать (взрослая тимектомия, полное облучение с 8,5 Су, мозговая перестройка с помощью 510 сингенных мозговых клеток), трансплантировали под шкуру мышей разновидности СН 7 В 1 в виде кусочков опухолиРастущая опухоль индуцировала легочные метастазы. Лечение и оценку эффекта осуществпяли способом, описанным для легочной опухоли Льюиса.Результаты, относяшиеся к легочной опухоли Льюиса и меланоме Вш, приведены в табл.Ь. на спине искусственно имуннодепрессированных мьппей разновидности СВА//СА, Лечение (внутрибрюшинное введение) начинали, когда опухоли достигали диаметра 0,7-1,0 см и можнобыло наблюдать их прогрессирующийрост. Диаметры опухолей измеряликронциркулем, объем рассчитывали подиаметру, (У= /6 И , 0 - средний диаметр). Степень эффекта ингибированияопухоли определяли по разности в объеме опухоли, измеренном на 21-й деньпосле трансплантации, в контрольнойи лечебной группах (каждая экспериментальная группа включала по крайней мере 6 опухолей). ингибирующее влияние на нотивной меланомы, тогд ние на рост колоректаль атических опухолей оказ слабым (табл.7,8).15 1424739 Таблица 7 НрэпзлжовпР Габл.7 Лечение 50 мг/кг 100 мг/кг 5 20 мг/кг Лечение 50 НТ 18 НТ 22 Соединениеформулы 11Соединениеформулы Ч Соединение Форму лы 11 68 77 40 19 52НТ 1810 20 ЧВСМ 13 Ч 15 52 87 57 65НТ 17 59 Эффект ингибирования опухолиХ-нитрозо-(5-хлорэтил)-карбамоилпептидными фрагментами у мышей, зараженных лейкемией Е, отражен в 20 табл.8. Соединениеформулы 11 13 Та блица 8 еДоза (внутрибрю-шинно) Соединение мг/кг м/кг Я(МО)-1.уя-Рго-Ча 1-МН,НС 1 (формула 11) 12,5 0,024 25 0,048 50 0,097 100 0,197 130 0,254 200 0,390 25 0,043 50 0,087 100 0,175 200 0,351 50 0,07 100 0,014 150 0,21 200 0,280 5 0,028 10 0,052
СмотретьЗаявка
3506053, 22.10.1982
Хиноин Дьёдьсер еш Ведьесетн Термекек Дьяра РТ
ХЕЛГА ШЮЛИ, КАЛЬМАН МЕДЗИХРАДСКИ, ХЕДВИГ МЕДЗИХРАДСКИ, КАРОЙ ЛАПИШ, ЛАСЛО КОППЕР, АНДРАШ ЙЕНЕИ
МПК / Метки
МПК: C07K 5/117
Метки: n-нитрозо-n-(бэта-хлорэтил, карбамоилпептидов, кислотно-аддитивных, солей
Опубликовано: 15.09.1988
Код ссылки
<a href="https://patents.su/11-1424739-sposob-polucheniya-n-nitrozo-n-behta-khlorehtil-karbamoilpeptidov-ili-ikh-kislotno-additivnykh-solejj.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения n-нитрозо-n-(бэта-хлорэтил) карбамоилпептидов или их кислотно-аддитивных солей</a>
Предыдущий патент: Способ получения производных тиено-1, 2-тиазола
Следующий патент: Способ получения дистиллятных углеводородных фракций
Случайный патент: Приемник частотно-манипулированных сигналов