1r, 3s-2, 2-диметил-3-(2-метил-2-оксипропил) циклопропанкарбонитрил как промежуточное соединение в синтезе пиретроидного инсектицида дельта-метрина и способ получения промежуточного соединения
Формула | Описание | Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 1679760
Авторы: Рукавишников, Ткачев
Формула
1. 1R,3S-2,2-Диметил-3-(2-метил-2-оксипропил)циклопропанкарбонитрил формулы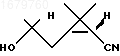
как промежуточное соединение в синтезе пиретроидного инсектицида - дельтаметрина.
2. Способ получения 1R,3S-2,2-диметил-3-(2-метил-2-оксипропил)циклопропанкарбонитрила формулы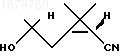
отличающийся тем, что кетонитрил формулы![]()
обрабатывают избытком метилмагнийиодида сначала при 0 5oС, а затем при комнатной температуре и кипячении с обратным холодильником, полученный при этом оксинитрил формулы![]()
растворяют в низшем алифатическом спирте и обрабатывают пероксидом водорода в присутствии водного раствора едкой щелочи при 30 40oС, образовавшийся при этом оксиамид формулы![]()
обрабатывают полученным in situ гипобромитом щелочного металла в присутствии катализатора межфазного переноса четвертичной аммониевой соли - сначала при комнатной температуре, а затем при кипячении с обратным холодильником.
Описание
Целью изобретения является изыскание нового производного оксикарбонитрила в качестве промежуточного соединения для синтеза дельтаметрина и разработка нового способа получения промежуточного соединения I, который осуществляют по более простой технологии по сравнению со способом получения известного промежуточного соединения для синтеза дельтаметрина с большим выходом.
П р и м е р 1. Получение из 3-карена кетонитрила формулы
10 г (+)-3-карена, выделенного при ректификации соснового скипидара и имеющего [
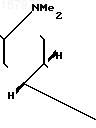
К раствору 6 г указанного аминооксима в 40 мл хлороформа добавляют 3 г измельченного карбоната натрия и при интенсивном перемешивании при комнатной температуре по каплям прибавляют 4 мл уксусного ангидрида. После окончания прибавления уксусного ангидрида реакционную смесь выдерживают при переме- шивании около 1 ч, после чего фильтруют, фильтрат упаривают в вакууме водоструйного насоса на водяной бане, остаток нагревают в вакууме (остаточное давление 5 мм рт.ст. температура бани 100оС) в течение получаса для удаления диметилацетамида и получают 4,5 г (выход 96% в расчете на аминооксим и 81% в расчете на 3-карен) кетонитрила (II).
П р и м е р 2. Получение оксинитрила (I) из кетонитрила (II).
К раствору реактива Гриньяра, приготовленному из 1,08 г магния и 6,5 г метилиодида, в 250 мл абсолютного эфира прибавляют при перемешивании и охлаждении в бане со льдом раствор 5 г кетонитрила (II) в 20 мл эфира. Реакционную массу перемешивают 1 ч при охлаждении, 1 ч при комнатной температуре и кипятят 3 ч. После охлаждения смеси до комнатной температуры прикапывают при энергичном перемешивании 30 мл воды и 50 мл 1М раствора соляной кислоты. Эфирный слой отделяют, водный экстрагируют дополнительно 50 мл эфира. Объединенный эфирный экстракт промывают насыщенным водным раствором хлористого натрия, сушат безводным сульфатом магния и после упаривания растворителя получают 4,8 г оксинитрила формулы
HO
ИК (CHCl3): 3600, 2260 см-1.
ЯМР-1Н (CDCl3): 0,97, 1,11 c, по 3Н; 1,24 с, 6Н; 1,42 д, 2Н; 2,24 д, 2Н.
ЯМР-13 С (CDCl3): 21,58 д, 37,37 т, 70,39 с, 119,53 с, 13,35 т, 22,00 д, 17,29 с, 29,60 к, 14,51 к, 28,70 к, 28,12 к.
Масс-спектрометр, m/z (%): 108(20), 99(25), 59(100), 43(22).
Найдено, C 71,7; H 10,3; N 7,7.
C11H19NO
Вычислено, C 71,9; H 10,6; N 7,7.
[
Сырой оксинитрил в количестве4,78 г растворяют в 35 мл метанола, прибавляют 22 мл 10%-ного водного раствора КОН и при перемешивании прибавляют по каплям 33 мл 30%-ной перекиси водорода, поддерживая температуру реакционной смеси 30-40оС. Затем добавляют твердый хлористый натрий до насыщения водно-метанольного раствора и после охлаждения реакционной смеси экстрагируют продукт хлороформом (четыре раза по 50 мл). Хлороформный экстракт высушивают безводным сульфатом натрия и после удаления растворителя получают 4,5 г оксиамида формулы
ИК (CHCl3): 3600, 3520, 3410, 1680, 1590 см-1.
ЯМР 1Н (CDCl3): 0,91, 1,09 c, по 3Н; 1,22 с, 6Н; 1,41 м, 2,16 м.
ЯМР 13С (ацетон-d6): 22,63 д, 38,42 т, 70,08 с, 175,73 с, 31,75 т, 23,00 д, 16,96 с, 28,91 к, 15,56 к, 29,07 к, 30,48 к.
Масс-спектр, m/z(%): 140(57), 83(22), 59(100), 55(24), 43(29).
Найдено, C 66,9; H 11,1; N 6,5.
C11H21NO2
Вычислено, C 66,3; H 10,6; N 7,0.
[
К раствору 13,5 г едкого кали в 30 мл воды при охлаждении в бане со льдом прикапывают при перемешивании 4,16 мл брома, после чего прибавляют 0,3 г триэтилбензиламмонийхлорида и раствор 4 г сырого указанного оксиамида в 30 мл хлористого метилена. Смесь перемешивают 1 ч при комнатной температуре, затем кипятят с обратным холодильником 1,5 ч при интенсивном перемешивании, охлаждают до комнатной температуры и отделяют органический слой. Водную фазу экстрагируют 20 мл хлористого метилена, объединенный экстракт промывают насыщенным водным раствором хлористого натрия, высушивают безводным сульфатом натрия и после упаривания растворителя получают 3,08 г сырого оксинитрила (I) в виде желтого масла. Выход оксинитрила (I) в расчете на кетонитрил (II) 70% Аналитический образец оксинитрила (I) получают хроматографированием сырого продукта на силикагеле, элюэнт диэтиловый эфир.
ИК (CCl4): 3620, 2240 см-1.
ЯМР 1Н (CCl4): 1,17 c, 6H; 1,22, 1,26 c, по 3Н; 1,57 д, 2Н; 2,62 с, 1Н.
ЯМР 13С (CDCl3): 26,35 д, 38,90 т, 70,45 с, 119,29 с, 14,24 д, 23,05 с, 26,40 к, 16,59 к, 29,17 к, 28,79 к.
Масс-спектр, m/z (%): 94 (27), 82(30), 59(100), 56(21), 43(53), 41(22).
Найдено, C 71,0; H 10,1; N 8,1.
С10H17NO
Вычислено, C 71,8; H 10,3; N 8,4.
[
П р и м е р 3. Получение из оксинитрила (I) 1R-хризантемолактона формулы
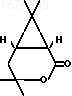
К раствору 0,16 г оксинитрила (I), полученного по примеру 2, в 2 мл этанола прибавляют раствор 0,75 г едкого кали в 2 мл воды. Смесь кипятят с обратным холодильником 24 ч, после чего подкисляют 1М раствором соляной кислоты до рН 1-2, насыщают раствор твердым хлористым натрием и экстрагируют продукт эфиром (две порции по 30 мл). Эфирный раствор упаривают, к остатку прибавляют 10 мл 10%-ного раствора едкого калия. Щелочной раствор промывают эфиром (две порции по 10 мл), подкисляют 1М раствором соляной кислоты и экстрагируют эфиром (три порции по 20 мл). Эфирный экстракт высушивают безводным сульфатом магния и упаривают растворитель. Остаток растворяют в 3 мл бензола, прибавляют 0,05 г n-толуолсульфокислоты и кипятят смесь 1 ч с обратным холодильником, после чего промывают 2 мл 0,5 н. раствора карбоната натрия, высушивают безводным сульфатом магния и после удаления растворителя получают 0,11 г указанного лактона (используемого в процессе получения дельтаметрина), кристаллизующегося при стоянии. Выход лактона в расчете на оксинитрил 68% Для получения аналитического образца лактон перекристаллизовывают из эфира гексана, т.пл. 83оС.
ИК (CCl4): 1730, 1270, 1200 см-1.
ЯМР 1Н (CCl4): 1,06, 1,21, 1,42, 1,32 c, по 3Н.
ЯМР 13С (CCl4-CDCl3): 21,91 д, 29,38 т, 81,93 с, 169,10 с, 23,60 д, 25,03 с, 28,14 к, 15,21 к, 26,31 к, 26,63 к.
Масс-спектр, m/z (% ): 168(18), 124(37), 110(63), 109(100), 95(81), 67(77), 43(64).
Найдено, C 71,4; H 9,93.
C10H16O2
Вычислено, C 71,4; H 10,6.
[
П р и м е р 4. Получение указанного лактона из известного промежуточного соединения формулы
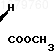
К раствору 2 г КОН в 20 мл метанола прибавляют 4 г указанного оксиэфира и кипятят смесь 3 ч, после чего подкисляют и экстрагируют 3,5 г образовавшейся соответствующей кислоты формулы
П р и м е р 5. Получение дельтаметрина из указанного хризантемолактона осуществляют по следующей схеме:
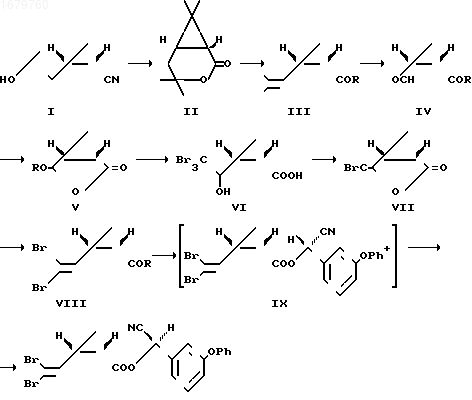 __
__ К 1 г шестиводного бромида магния прибавляют 0,65 мл пиридина и 1 г хризантемолактона (II). Смесь выдерживают 14 ч при 125оС, охлаждают и добавляют смесь 2М соляной кислоты с эфиром. Выпавший осадок комплекса бромида магния с цис-хризантемовой кислотой отфильтровывают и высушивают, после чего разлагают смесью 5М соляной кислоты и диоксана 1:1 и выделяют 0,49 г (49%) 1R-цис-хризантемовой кислоты (III, R OH).
К раствору 73,5 г хризантемовой кислоты в 140 мл петролейного эфира добавляют 35 мл хлористого тионила и выдерживают в течение ночи при комнатной температуре. После удаления растворителя и избытка хлористого тионила выделяют 80 г хлорангидрида (III, R Cl), который растворяют в 80 мл петролейного эфира и добавляют последовательно 65 мл пиридина и 55 мл метанола. После удаления из реакционной смеси растворителей выделяют 75,6 г метилового эфира (III, R CH3). Полученный эфир в количестве 70 г растворяют в 700 мл метанола, охлаждают раствор до -80оС и пропускают в него ток озона в течение 3,5 ч, после чего к смеси при -40оС прибавляют 79 мл диметилсульфида. Растворитель удаляют в вакууме, остаток (75,9 г) растворяют в 560 мл 30%-ной уксусной кислоты, выдерживают 15 мин при 80оС и после подщелачивания раствора экстрагируют 53,5 г образовавшегося альдегида формулы
(R CH3). 57,2 г указанного альдегида, обрабатывают раствором 16,9 г натрия в 570 мл метанола и выделяют 52,4 г лактона (R Me), который кипятят 2 ч в смеси 260 мл воды и 130 мл диоксана, после чего получают 25 г карональдегида формулы
HO
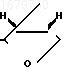 = O Выход карональдегида в расчете на хризантемовую кислоту (III, R OH) 40%
= O Выход карональдегида в расчете на хризантемовую кислоту (III, R OH) 40%К раствору 36,8 г карональдегида в смеси 135 мл тетрагидрофурана и 27 мл бромоформа при -10оС прикапывают 90 мл 30%-ного раствора едкого кали в метаноле за 1 ч. Смесь перемешивают 2 ч при -10оС, после чего прибавляют 200 мл воды и перемешивают еще 0,5 ч при 25оС. Тетрагидрофуран и метанол упаривают, водный раствор подкисляют 15%-ным раствором соляной кислоты. Выпавший осадок отфильтровывают, промывают водой и после высушивания получают 68,5 г кислоты формулы VI, которую превращают в соответствующий лактон (VII) с выходом 95% обработкой n-толуолсульфокислотой в бензоле. Полученный лактон в количестве 56,6 г растворяют в 400 мл сухого эфира, прибавляют 330 мл уксусной кислоты и при перемешивании прибавляют порциями 118 г цинковой пыли. Смесь перемешивают 2,5 ч при 25оС, после чего отфильтровывают. Фильтрат упаривают, остаток разбавляют водой. Выпавшие кристаллы отфильтровывают, промывают водой и высушивают. После перекристаллизации из изопропанола получают 36 г (80%) дельтаметриновой кислоты формулы
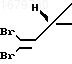
К раствору 29,8 г дельтаметриновой кислоты в 250 мл эфира прибавляют при 0оС 5 капель диметилформамида и 17,9 г хлористого тионила. После удаления растворителя выделяют 31 г (98%) хлорангидрида (III, R Cl).
В колбу, содержащую 10 мл н-гептана, 1 мл воды, 1,98 г феноксибензальдегида, 22 мл диазабицикло (2.2.2)октана и 0,59 г цианида натрия добавляют при 20оС раствор 3,32 г хлорангидрида дельтаметриновой кислоты в 10 мл н-гептана, перемешивают 2 ч, после чего фильтруют. Осадок на фильтре промывают 30 мл эфира, фильтрат высушивают сульфатом магния и после упаривания растворителя получают 4,4 г (96%) эфира (IX) в виде смеси двух диастереомеров.
К раствору 600 г смеси эфиров в виде диастереомеров в 1200 мл изопропилового спирта прибавляют 90 мл водного аммиака, охлаждают смесь до 0оС и перемешивают 48 ч при этой температуре, после чего отфильтровывают осадок, промывают его на фильтре 300 мл изопропилового спирта, охлажденного до минус 20оС и после высушивания получают 485 г дельтаметрина (81%).
Таким образом, целевой продукт оксинитрил продукт для синтеза дельтаметрина получают с выходом 70% в расчете на кетонитрил или 57% в расчете на 3-карен, в то время как известный полупродукт оксиэфир формулы
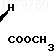 получают с выходом 31% в расчете на 3-карен.
получают с выходом 31% в расчете на 3-карен.Выход дельтаметрина при использовании предлагаемого промежуточного соединения составляет 3,8% в расчете на 3-карен, тогда как при использовании известного промежуточного соединения 2,6%
Кроме того, способ получения предлагаемого промежуточного соединения является более простым (число стадий процесса пять вместо шести по известному способу), не требует стадии озонолиза и поддержания низких температур (-68оС), что имело место при озонировании, большой продолжительности процесса (стадию метилирования по известному способу осуществляют в течение недели).
Изобретение касается 1R, 3S-2,2-диметил-3-(2-метил-2-оксипропил) циклопанкарбонитрила, который может быть использован в качестве промежуточного соединения в синтезе пиретроидного дельтаметрина. Цель - создание нового способа получения нового полезного продукта. Синтез ведут реакцией соответствующего нитрила с избытком метилмагнийиодида сначала при 0 - 5°С, затем при комнатной температуре и далее при кипячении с обратным холодильником. Полученный при этом оксинитрил растворяют в низшем алканоле и обрабатывают перекисью водорода в присутствии водного раствора едкой щелочи при 30 - 40°С с последующей обработкой полученного продукта гипобромитом щелочного металла (полученным in sicu) в присутствии катализатора межфазного переноса - четвертичной аммониевой соли , - сначала при комнатной температуре, а затем при кипячении с обратным холодильником. Полученный сырой продукт хроматографируют на силикагеле с элюэнтом - диэтиловым эфиром. Выход оксинитрила 70%, брутто-формула C10H17NO,[
Заявка
4772972/04, 25.12.1989
Новосибирский институт органической химии СО АН СССР
Рукавишников А. В, Ткачев А. В
МПК / Метки
МПК: C07C 253/30, C07C 255/48
Метки: 2-диметил-3-(2-метил-2-оксипропил, 3s-2, дельта-метрина, инсектицида, пиретроидного, промежуточного, промежуточное, синтезе, соединение, соединения, циклопропанкарбонитрил
Опубликовано: 09.06.1995
Код ссылки
<a href="https://patents.su/1-1679760-1r-3s-2-2-dimetil-3-2-metil-2-oksipropil-ciklopropankarbonitril-kak-promezhutochnoe-soedinenie-v-sinteze-piretroidnogo-insekticida-delta-metrina-i-sposob-polucheniya-promezhutochno.html" target="_blank" rel="follow" title="База патентов СССР">1r, 3s-2, 2-диметил-3-(2-метил-2-оксипропил) циклопропанкарбонитрил как промежуточное соединение в синтезе пиретроидного инсектицида дельта-метрина и способ получения промежуточного соединения</a>
Предыдущий патент: Устройство для контроля угла установки стабилизатора летательного аппарата
Следующий патент: Способ термической обработки заготовок
Случайный патент: Устройство для гидроабразивной очистки деталей





