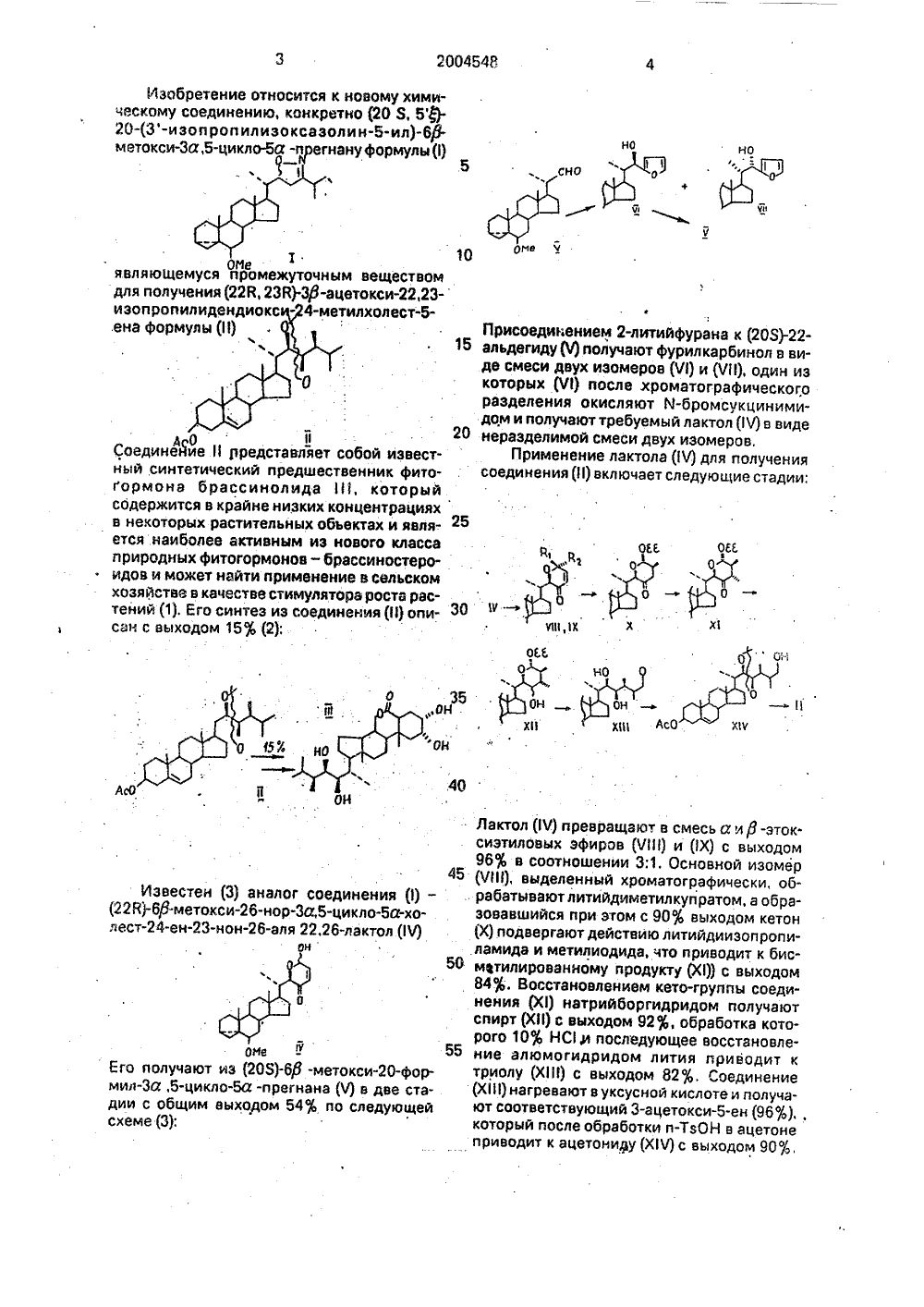
(20 s, 5 )-20-(3 -изопропилизоксазолин-5 -ил)-6 метокси-3, 5-цикло-5 -прегнан в качестве полупродукта в синтезе (22 r, 23r)-3 -ацетокси-22, 23 изопропилидендиокси-24-метилхолест-5-ена
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 2004548
Авторы: Ахрем, Барановский, Литвиновская, Хрипач
Текст
Е ИЗОБРЕТЕНИЯ ОПИ ПАТЕНТУ Комитет Российской Федерации по патентам и товарным знакам(71) Институт биоорганиуеской химии АН БССР(73) Хрипау Владимир Александрович; ЛитвиновскэРаиса Павловна; Барановский Апександр Вячеславович; Ахрем Афанасий Андреевич- ПРЕГНАН В КАЧЕСТВЕ ПОЛУПРОДУКТА ВСИНТЕЗЕ (22 й, 23 й)-З-АЦЕТОКСИ,(В) И 5 (11) 20045(57) Использование: как полупродукт в синтезе известного фитогормона-брассинолида Сущность: продукт - (20 8, 5) -20-(3 - изопропилидоксазопин-ил) -69-метокси-За, 5-циклоа - прегнан Выход 90% БФ С Н ЙО . Реагент27 43:Я1(203)-20-формил Д -метокси-зв, 5-цикпо -5 а - прегнан. Реагент 2: реагент Виттига Реагент 3: изобутиронитрилоксид в присутствии бутиллитиа Условия реакции: в среде тетрагидрофурана2004548 но сно 10 являюще для получ изопроп ена Фор му Присоединением 2 15 альдегиду(Ч) получаде смеси двух иэом которых (Ч 1) после разделения окисл дом и получают треА 01 20 неразделимой смес Соединеййе И рредставляет собой иэвест- Применение ла ный синтетический предшественник фито- . соединения (И) вклю гормона брассинолида 111, которыйсодержится в крайне низких концентрацияхв некоторых растительных объектах и является. наиболее активным из нового классаприродных Фитогормонов - брассиностеро- ,Л идов и может найти применение в сельскомхозяйстве в качестве стимулятора роста растений (1). Его синтез из соединения (И) опи фсан с выходом 15 (2): литийфурана к (203)-22- ют фурилкарбинол в виеров(Ч 1) и(ЧИ), один иэхроматографическог,о яют й-бромсукцинимибуемый лактол (1 Ч) в виде и двух изомеров.ктола ( Ч) для получения чает следующие стадии: н (3) аналог соединения охси-нор-За,5-цикло3-нон-аля 22,26-лактол Известе-хо 1 Ч)50 Оне фт иэ (208)-6 ф -метокс клоа -прегнана (Ч) в м выходом 54 по сл го получамил-За,5-цдии с общ хеме (3): ста- щей Изобретение относится к новому химическому соединению, конкретно (20 8, 5- 20-(3-изоп роп илизоксазоли н-б-ил)-6 ф. метокси-За,5-цикло-ба -прегнану Формулы (1) Оне муся промежуточным веществом ения (22 В, 23 В)-Зф-ацетокси,23- и 4 тилхолест.5 Лактол (1 Ч) превращают в смесь а лф -этоксиэтиловых эфиров (ЧИ 1) и (Х) с выходом 96 в соотношении 3:1. Основной изомер (ЧИ), выделенный хроматографически, об рабатывают литийдиметилкупратом, а образовавшийся при этом с 90 О выходом кетон (Х) подвергают действию литийдииэопропиламида и метилиодида, что приводит к бисмвтилированному продукту (Х 1 с выходом 84. Восстановлением кето-группы соединения (Х) натрийборгидридом получают спирт (ХИ) с выходом 92, обработка которого 10 НС 1,и последующее восстановление алюмогидридом лития приводит к триолу (ХИ) с выходом 82%, Соединение (Х 111) нагревают в уксусной кислоте и получают соответствующий 3-ацетокси-ен (96, который после обработки и-ТзОН в ацетоне приводит к ацетониау (Х 1 Ч) с выходом 90, 2004548Последнее соединение превращают в (228, 238)-3 ф -ацетокси,23-изопропилидендиокси-метилхолест-ен (11) последовательной обработкой метансульфонилхлоридом в пиридине, восстановлением образовавше гося эфира алюмогидридом лития и ацетилированием с общим выходом 80%.Общее количество стадий при получении предшественника брассинолида (11) по данной схеме, из 20-альдегида (Ч) равно 9 10 при общем выходе около 12%.Недостатками использования лактола (Ч) в качестве промежуточного продукта для получения соединения (П) является многостадийность процесса. его сложность и 15 недостаточно высокий выход.Целью изобретения является упрощение процесса получения (228,2 ЗЙ)-Зф -ацетокси,23-изопропилидендиокси-метилхолест-ена (1) из альдегида(Ч) и сокра щение числа стадий.Указанная цель достигается описываемым соединением (203,5 Е-(3-изопропилизоксазолин-ил)6 ф-метокси а.5-цикло 5 а-прегнаном (1). Описываемое соединение ( олучают из 20-альдегида (Ч) в одну стапо схеме: НО. АсОН2, НеСО со Изоксазолин (1) восстановительным расщеплением на никеле Ренея превращают в ф-кетол (ХЧ), последний алкилируют метил- литием, окисляют вторичную гидроксильную группу реактивом Саррета (СгОзхРу) и дегидратируют путем обработки п-ТэОН.После обычного ацетилирования получают енкетон(ХЧ 1) с общим выходом 80%, Восстановление енкетона (ХЧ) диизобутилалюмогидри 30 дом, эпоксидирование в-хлорнадбензойнойкислотой и раскрытие эпоксида гидридом алюминия приводит к диолу(ХЧ 1) с выходом 60%, Последний путем кипячения в уксусной кислоте и обработкой и-толуолсульфо 35 кислотой в ацетоне превращают в целевоесоединениес выходом 90%.Таким образом, (22 Я,231)33 -ацетокси 22.23-иаоп ропилидендиокси-метилхолест-ен (1) получают иэ альдегида (Ч) по0 данной схеме с использованием заявляемого соединения (1) в 5 стадий с выходом 37%.Сущностьиэобретения поясняется примерами конкретного выполнения.П р и м е р 1. Получение (205,5 Я-(3- 5 изопрспилизоксазолин-ил)фЗ-метоксиа,5-циклоа -прегнана .К суспензии 13,09 г(36,6 ммоль) метилтрифенилфосфонийбромида в сухом эфире (150 мл) добавляют в атмосфере аргона при комнатной температуре 14,8 мл 2,25 М раствора бутиллития. Перемешивают 2 ч и добавляют 11,47 г(33,3 ммоль) 20-ал ьдегида (Ч) в сухом ТГФ. Смесь кипятят 5 ч, Затем фильтруют, сушат над йаг 304, упаривают и рас 55 творяют в хлороформе в 30 мл. Полученный /ы 1-йе раствор в один прием вносят в раствор изовоъ бутиронитрилоксида, полученного из 8,96 г(66,6 ммоль) й-хлорсукцинимида в 300 мл хлороформа, 0,12 мл пиридина и 5,78 г 1) и дию НО 1, РЬР=СН 2. 1 Ргсмо е Ч. Альдегид(Ч) подвергают действию реагента 4 Виттига и образовавшийся стероидный олефин путем 1,3-диполярного циклоприсоединения изобутиронитрилоксида превращают в заявляемое соединение(1) с выходом 90%. Необходимо отметить, что заявляемое сое динение (1) используется в дальнейшей схеме в виде двух изомеров по С. В случае же синтеза его аналога (Ч) на двух стадиях его синтеза требуется тщательное хроматографическое разделение изомеров. Пре вращение заявляемого соединения (1) в известный синтетический предшественник брассинолида (11) осуществляется по схеме;сноРьзР=.сн ОМе Ч(66,6 ммопь) оксима изомасляного альдегида, Через несколько минут добавляют 7,12 г (66,6 ммоль) триэтиламина в хлороформе в течение 6 ч, Реакционную смесь перемешивают при комнатной температуре 24 ч и растворитель упаривают. Остаток обрабатывают водой и экстрагируют эфиром. Эфирный раствор пропускают через фильтр с окисью алюминия, растворитель упарива. ют, Получено 12,78 г (900/) (203,5 9-20-(3- изо пропил изоксазолин-ил)-6%метоксиЗа 5-циклоа-прегнана ,ПМР спектр(200 МГц,д, мд): 042 м(1 Н, циклопр.), 0,65 м (1 Н, циклопр.), 0,71 с (ЗН, 18-Ме), 0,87 д(ЗН 3-7 Гц, 21-Ме), 1,01 с(ЗН, 19-Ме), 1,15 д (6 Н, 5=7 Гц, 26 и 27-Ме), 2,63 дд (1 Н, 3 1-16 Гц, АГц, Сгз-Н), 2,71 септ. (1 Н, 1=7 Гц, С 25-Н), 2,78 м (1 Н, С 6-Н), 2.94 дд (1 Н, 1=16 Гц, 2=11 Гц, С 2 з-Н), 3.33 с (ОМе, Зн), 4,67 м (1 Н, С 22 Н)ИК-спектр (пленка, см 1): 1620, 1100.Масс-спектр (п 1 Й): 427 (М)+. 412 (М-Ме)+, 395 (М-МеОН), 372,П р и м е р 2, Получение (22 В,23 В)-33- ацетокси,23-изопропилидендиокси- метипхопест-ена ,К хорошо перемешиваемому в этиловом спирте никелю Ренея добавляют 18,6 г (ЗОО ммопь) борной кислоты и 12,35 г (29 ммоль) изоксазолина . Реакционную смесь выдерживают при комнатной температуре и перемешивают в атмосфере водорода 7 ч. Затем катализатор отделяют на фильтре, растворитепь упаривают, Полученный остаток растворяют в этилацетате, промывают водой и сушат над Ма 2804. Растворитель упаривают на 2/3 объема и остаток пропускают через фильтр с силикагелем. После упаривания. растворителя получают 11,84 г (95) (22 -6 В-метокси-За,5-цикл оа-хоп еста н-он-ола (ХЧ),ПМР-спектр (200 МГц, д, м.д,): 0,44 м (1 Н, циклопр.), 0,65 м (1 Н, циклопр.), 0,74 с (ЗН, 18-Ме), 0,95 д(ЗН, -7 Гц, 21-Ме), 1,02 с (ЗН, 19-Ые), 1,11 д (6 Н, =7 Гц, 26 и 27-Ме), 2,41 дд (1 Н, . 1-17 Гц, 32" 10 Гц, С 2 з-Н), 2,54 дд (1 Н,1-17 Гц, 2-3 Гц, С 2 з-Н), 2,63 септ, (1 Н, ф 7 Гц,.С 25-Н), 2,78 м (1 Н, Сб-Н), 3,33 с (ЗН, ОМе), 4,10 м(1 Н, С 22-Н).ИК-спектр (пленка, см ): 3510, 1710, 1100;Масс-спектр (а/а): 430 (М), 415 (М-че), 398 (М-МеОН), 397 (М-Ме-Н 20), 375, 329,К раствору 11,01 г (25,5 ммоль) р-кетола (ХЧ) в 350 мл абсолютного эфира в атмосфере аргона добавляют по каплям 150 мл 1,0 н. эфирного раствора метиллития, поддерживая температуру 0-5 С. Перемешивают реакционную смесь 2 ч и добавляют хлористыйаммоний, воду и зкстрагируют эфиром. Сушат над Мж 304, упаривают, остаток растворяют в 145 мл хлористого метилена и5 добавляют 1,2 г реактива Саретта. Растворперемешивают при комнатной температуре2 ч и пропускают через слой окиси алюминия, промывают эфиром (Зх 50 мл), фильтраты сушат над йа 2504 и упаривают. Остаток10 растворяют в 300 мл безводного бензола.добавляют каталитическое количество паратолуолсульфокислоты и хлорида кальция.Реакционную смесь нагревают до кипенияи кипятят 5-10 мин. Затем реакционную15 смесь охлаждают и пропускают через слойокиси алюминия, упаривают. Голучают8,67 г (80 ) 24-метил-бф -метокси-За,5-циклоа-холест-ен-она (ХЧ).ИК-спектр (Квг, см ): 1680 1620, 1040.20 Масс-спектр (а/а): 426(М), 384(ММеОН),ПМР-спектр (200 МГц, д, м,д.): 0,44 м и0,65 м (2 Н, циклопр,),0,70 с(ЗН, 18-Ме), 1,02 с(0,012 моль) кетона (ХЧ) в 50 мл ТГФ в токе30 аргона добавляют 38 г 860 ь-ного ДИБАГ вТГФ приС, Реакционную смесь перемешивают 30 мин и осторожно выливают приохлаждении на ледяной бане в смесь метанола и петролейного эфира. Образовав 35 шуюся суспензию перемешивают 1 ч,растворитель упаривают, добавляют 200 млводы и экстрагируют хлористым метиленом,промывают раствором ЙН 4 С и чаНСОз, сушат над йа 2304. К полученному раствору40 приливают раствор 2,40 г (0,014 моль)метахлорнадбензойной кислоты в 25 млметиленхлорида. Реакционную смесь выдерживают при комнатной температуре20 ч, затем промывают раствором МаНСОз.45 органический слой отделяют и фильтруютчерез слой окиси алюминия. Растворительупаривают, Остаток растворяют в эфире иприливают к гидриду алюминия, приготовленному из 0,34 г .АН 4 и 0,31 г АОз в50 эфире при комнатной температуре. Переме, шивают 1 ч и обрабатывают 150 мл 50-ного АсОН, экстрагируют этилацетатом,экстракты промывают раствором йаНСОз,водой, сушат над йа 304, упаривают, Оста 55 ток подвергают колоночной хроматографиина сипи кагеле (элюент-гексан-эфир). Получают 3,21 г (60) (228,23 В,243)-22,23-дигидрокси-метилф -метокси-За,5-цикло 5 а -холестана (ХЧ ).2004548 Составитель И.Федосеевадектер А,Самерханова Техред М,Моргентал Корректор М.Петро ТиражПодписное НПО "Поиск" Роспатента113035, Москва, Ж, Раушская наб., 4/5 каз 3377 Производственно-издательский комбинат "Патент", г, Ужгород, ул.Гагарина, 101 ПМР-сггектр (200 МГц, д, м.д.): 0.82 с(ЗН, 18-Ме), 1,04 д (ЗН, 21-Ме), 1,06 с (ЗН, 19-Ме), 1,11 д(ЗН, 28-Ме), 1,17 и 1,20, 2 д(бН,27- и 28-Ме), 2,78 м (1 Н, 6-Н), 3,33 с (ЗН, ОМе), 4,91-5,41 с (2 Н, 22-Н и 23-Н).ИК-спектр (пленка, см ); 3450.Масс-спектр аг): 446(М)+, 431(М-Ме)+, 404(М-Ме ОН),2,37 г (5 ммоль) диола (ХЧ 11) растворяют в 50 мл уксусной кислоты и кипятят 0,5 ч, После охлаждения реакционную смесь выливают в раствор гидрокарбоната натрия и экстрагируют эфиром, промывают водой, сушат над Ка 2304 и упаривают. Остаток растворяют в ацетоне (50 мл), добавляют несколько кристалликов и-толуолсульфокислоты и кипятят 2 ч, Реакционную смесь выливают в раствор карбанвта калия и экст",вгируют эфиром, сушат над Ма 2 ЯО, пропускают через фильтр с окисью алюминия и упаривзют. Получают 2,31 г(90 О) (22 В, 23 В)- ,ЗВ-ацетокси,23-изопропилидендиокси-метилхолест-енз (1). ИК-спектр (КБг, см ): 735, 1250,ПМР-спектр(200 МГц, д, м,д,): 0,80 с(ЗН, 18-Ме), 1,03 д(ЗН, 21-Ме), 1,06 с (ЗН, 19-Ме), 1,". 3 д (ЗН, 28-Ые), 1,17 д и 1,29 д (6 Н, 26 и 27-Ме), 1,34 с и 1 Я с (СН, Ме-ацетон защисьориула изобретенияг 203,5-;,-20 в (3 -Язопаопилизокса лин-Ь-ил)- ба -метакси- За, 5 -цикло прегнан формулы ты), 3,90-4,42 (2 Н, 22-Н и 23-Н), 4,59 м (1 Н, З-Н), 5,38 и (1 Н, 6 Н).Масс-спектр (ай): 514(М), 454(МАсОН) .5 Таким образом, применение веществав качестве полупродукта синтеза (22 В,22 В).319-ацетокси,23-изопропилидендиокси-метилхолест-ена (Н) иэ альдегида (ч) позволяет осуществить пятистадий ный переход к целевому продукту, что на 4стадии меньше до сравнению со схемой с использованием аналога (И), повысить выход в 2,5 раза и упростить схему, исключив кропотливую работу по разделению смесей 15 эпимеров в ряде случаев.(56) ТЬоврзоп в,1., Меобс 90. Мапбача й.В.ЯуптЬезз оФ Вгазз 1 позтего 1 бз апб ВеабопзЫр оГ Ятгос 1 оге (о Рам Оговй ргоаобпд Еттес 1 з.-Зтего 1 бз, 1982. ч, 39, р,2894.ТаКасзцто 8;, Уаава й., 1 зЫдого М.51 егеозе 1 есс 1 че Зупйез 1 з о 1 Р 1 ам Огоюйрговот 1 пд Йегобз. - СЬеа. Зос., Рей, Тг, 25 1. 1984, р, 139.Капвтап 1 ТКе 1 по К., К 1 дачча М.ЯегеосоптгоПеб зупйез 1 з о 1 йе Ьгазз 1 поИбе з 1 бе сйа 1 п ча а ругапопе бег 1 чатче - Тенг.1.епг. 1989, ч, 30, р. 3141.30
СмотретьЗаявка
04930620, 23.04.1991
Институт биоорганической химии АН БССР
Хрипач Владимир Александрович, Литвиновская Раиса Павловна, Барановский Александр Вячеславович, Ахрем Афанасий Андреевич
МПК / Метки
МПК: C07J 43/00
Метки: 20-(3, 23r)-3, 5-цикло-5, ацетокси-22, изопропилидендиокси-24-метилхолест-5-ена, изопропилизоксазолин-5, ил)-6, качестве, метокси-3, полупродукта, прегнан, синтезе
Опубликовано: 15.12.1993
Код ссылки
<a href="https://patents.su/5-2004548-20-s-5-20-3-izopropilizoksazolin-5-il-6-metoksi-3-5-ciklo-5-pregnan-v-kachestve-poluprodukta-v-sinteze-22-r-23r-3-acetoksi-22-23-izopropilidendioksi-24-metilkholest-5-ena.html" target="_blank" rel="follow" title="База патентов СССР">(20 s, 5 )-20-(3 -изопропилизоксазолин-5 -ил)-6 метокси-3, 5-цикло-5 -прегнан в качестве полупродукта в синтезе (22 r, 23r)-3 -ацетокси-22, 23 изопропилидендиокси-24-метилхолест-5-ена</a>
Предыдущий патент: Способ получения комплексов диоксомолибдена (vi) с аминокислотами
Следующий патент: Способ получения пектина
Случайный патент: Гидропривод исполнительного органа металлорежущего станка