Способ получения замещенных карбоксамидотиазолов
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 253685
Авторы: Виль, Иностранна, Маршалл, Соединенные
Текст
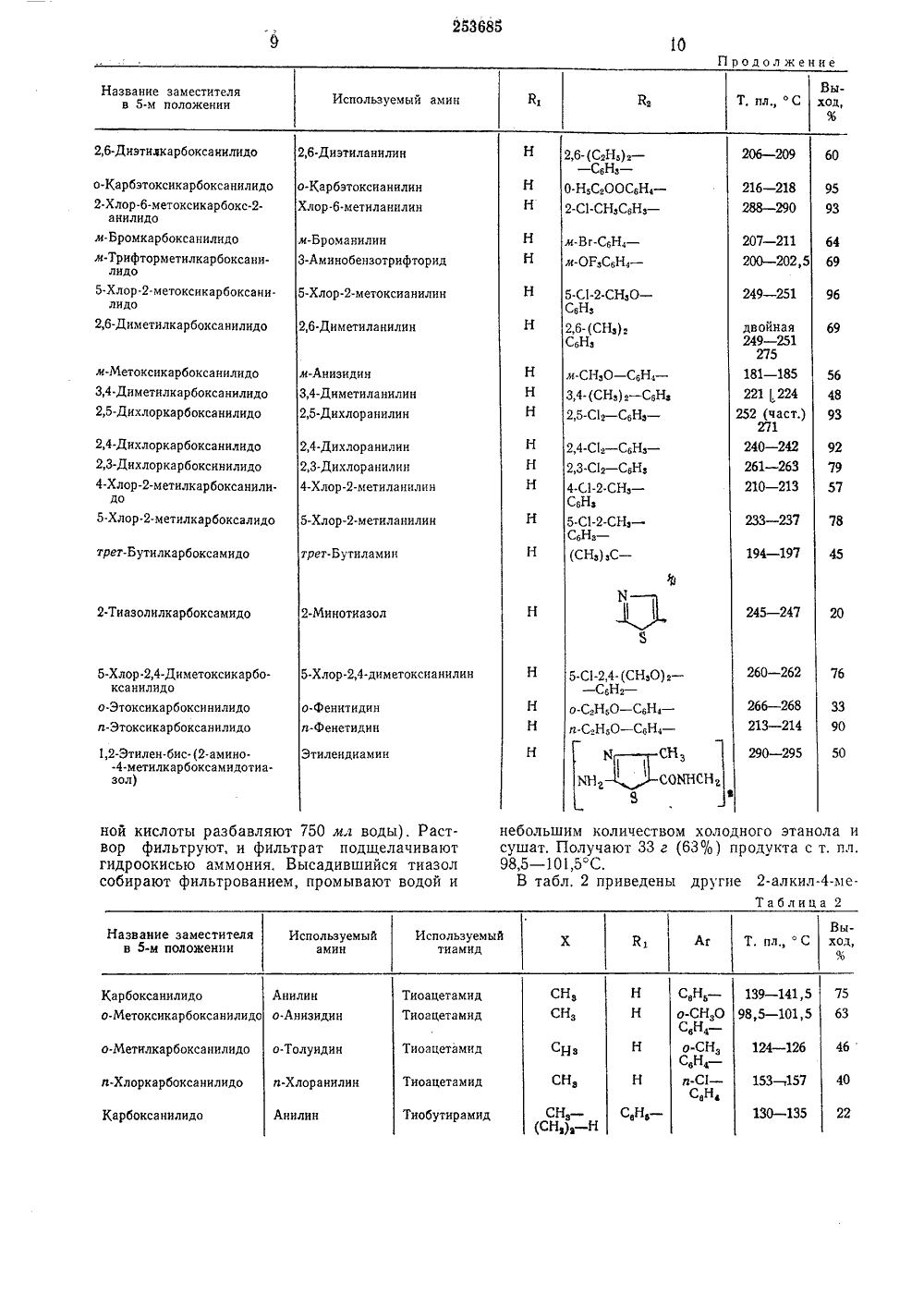
ОПИСАНИЕИЗОЬЕИТИНИЯПАТЕНТУ 23 б 85 Союз Советских Социалистических Республикависимый от патентааявлено 20,Х 1,1967 (ЛЪ 1197460/2 Кл. 12 р,МПК С 07 с 1 оритет 07,Х 11,1966 ( 599734, СШ Комитет по делам зобретеиий и открытий при Совете Министров СССРОпубликовано 30,1 Х,1969, Бюллете 30 ния 5.111.197 а опубликования опи туулка вторызобретения Иностранцыльям Ашлей Гаррисон и Марша(Канада) аявите Иностранная фирма Юниройл Инк,эединенные Штаты Аме и) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ КАРБОКСАМИДОТИАЗОЛОВ2 носится к способу п оксамидотиазолов, ти свойствами, а та ов роста растений. способ получения отиазолон общей Изобретение от замещенных карб щих фунгицидныв ствами регулятор Предлагается ных карбоксамидлучения бладаюже свойО =С-СНЭ.й2 - .СН- С-Ы1 В амещен- формулы 1 В,С-С 1О О замещенная илиаминогруппа,водород, замещеннщенная углеводорзамещенная или нлеводородная групдо 12 атомов угле амещенн ая или незамеодная группа;езамещенная угпа, содержащая рода, 2 К 2 зам еще леводо содерж водоро щенна арил,или Х Способ зкалючаетсятоацетоамид общей ф м, что а-галоидацелы. исоединен- разовывать иная или незамещенная угродная алкильная группа,ащая до 8 атомов углерода; д, замещенная или незамея углеводородная группа; алкарил или галоидарил. где К, и К, имеют вышеуказанные значения, а 7 - хлор или бром, подвергают взаимодействию с тиомочевиной или тиоамидом в воде или в среде органического растворителя, получаемый продукт выделяют в виде основания или известными приемами переводят в кислые аддитивные соли.Углеводородные группы, приведенные выше, могут быть прямолинейными, разветвленными или циклическими, а также насыщенными или ненасыщенными, включая как ароматическую, так и неароматическую ненасыщенность. Таким образом, углеводородная группа может быть алкилом, арилом, аралкилом, алкарилом, циклоалкилом или алкенилом, Заместители в углеводородных группах, если они существуют, могут быть, например, одним или более галоидом, нитрогруппой, карбоксилом, простым или сложным эфиром. Замещение может быть также осуществлено с помощью гетероатома, такого, как азот, кислород или сера, например фурфурил, а-пиридил, бензотиазолил.Две углеводородные группы, прные к атому азота, могут также обгетероциклическое кольцо вместе с атомом азота. Примером такой группы является морфолидогруппа. Одна или более углеводородных групп могут образовывать цепь со следующей карбоксамидотиазольной группой, обра. зуя бис-соединение.Предпочтительными соединениями являются те, у которых Х представляет собой МИ- группу, а К - водород, а также те у которых Х представляет собой алкильную или галоидалкильную группу или аралкил; причем галоид - хлор или бром.П р и м е р 1, 2-Амино-метил-карбоксанилидотиазол.Метод А.846 г (4 моль) а-хлорацетанилида, 310 г тиомочевины и 1400 мл этанола смешивают при комнатной температуре. Вскоре начинается экзотермическая реакция, и растворение фактически завершается за несколько минут. Реакционную колбу помещают затем на паровую баню и нагревают 15 - 20 мин. Осаждение хлоргидрата начинается почти немедленно, Реакционную смесь охлаждают, и хлоргидрат отделяют фильтрацией. Хлоргидрат растворяют в теплой воде, фильтруют и подщелачивают гидроокисью аммония. Высадившееся основание отфильтровывают и сушат. Сырой продукт (815 г, выход 87%) начинает плавиться при 211 С и расплавляется с разложением при 262"С, После перекристаллизации из этанола получают 692 г 2-амино-метил- тиазолкарбоксанилида с началом плавления при 221 С или выше. Выход 744. (Очищенное основание частично плавится при 222 - 223 и затем вновь затвердевает. Разложение протекает медленно тогда, когда температура поднимается, и конечная температура плавления меняется).Метод Б.Реакционную смесь из 528 г а-хлорацетоацетанилида (2,5 моль), 190 г (2,5 моль) тиомочевины и 1600 мл воды нагревают до 80 - 90 С, пока не растворится твердый продукт (примерно 1 час). Горячий раствор профильтровывают, и фильтрат подщелачивают концентрированной гидроокисью аммония (28 - 30%-ной, 203 мл) и водой (300 мл). Белый осадок отфильтровывают, промывают водой и сушат. Получают 526 г (907 ю) белого продукта с т. пл. 220 - 223 С.П р и м е р 2, 2-Амино-метил-м-метилкарбоксанилидотиазол.41 г хлористого сульфурила добавляют по порциям к смеси 57 г ацетоацет-м-толуидипа, 46 г тиомочевины и 100 мл бензола, Для контролирования реакции требуется охлаждение, После первоначальной реакции смесь нагревают 1 час на паровой бане и оставляют на ночь при комнатной температуре, Большую часть ее упаривают под вакуумом. Раствор, который получают путем обработки твердой массы горячей водой, профильтровывают и10 15 го 25 30 35 40 45 50 55 60 65 4подщелачивают гидроокисью аммония. Высадившееся основание собирают фильтрованием и перекристаллизовывают из этанола. Получают 33 г (457 ю) желтых кристаллов с т. пл.189 - 191 и 193 - 194 С (двойная температура плавления). П р и м е р 3, 2-Амино 4-метил-гг-метилкарбоксанилидотиазол.К 40 г перемешиваемой суспензии гг-метилацетоацетанилида и 200 мл бензола в течение 10 мин по каплям добавляют 30 г хлористого сульфурила. Температуру поддерживают 20 - 25 С с помощью охлаждения. Полученный раствор перемешивают при комнатной температуре в течение 2 час, затем отгоняют растворитель в вакууме при температуре, не превышающей 50 С. К оставшемуся сырому а-хлор- и-метилацетоацетанилиду добавляют раствор 25 г тиомочевины в 50 г воды и 100 мл этанола. Смесь нагревают при кипячении с обратным холодильником в течение 15 мин. Полученный раствор подщелачивают водным раствором гидроокиси натрия, Белый осадок отфильтровывают, промывают водой, бензолом и этанолом и сушат. Получают 40 г (78 ю/о) продукта с т. пл. 234 в 2 С; после перекристаллизации из этанола т. пл. 238 в 2 С,П р и м е р 4. 2-Амино-метил-о-хлоркарбоксанилидотиазол.Раствор 33 г хлористого сульфурила в 50 мл бензола прибавляют по каплям в колбу, содержащую 51 г о-хлорацетоацетанилида и 200 мл бензола. Реакционную смесь выдерживают при комнатной температуре в течение 2 час. Затем удаляют бензол под вакуумом, К остатку, который кристаллизуется при охлаждении, добавляют 225 мл этанола и 20 г тиомочевины, После сильной экзотермической реакции смесь нагревают 10 мин на паровой бане, Смесь сырого хлоргидрата с водой обрабатывают водным аммиаком, чтобы выделить основание. Это основание перекристаллизовывают из этанола, в котором оно только слабо растворимо. Получают 55 г (86%) белых кристаллов с т. пл. 258 - 259 С (с разложением). П р и м е р 5. 2-Амино 4-метил-Х-этил-ометилкарбоксанилидотиазол.К перемешиваемому раствору 50 г К-этило-метилацетоацетанилида в 100 м г бензола по каплям добавляют 35 г хлористого сульфурила в течение 10 мин. Температуру реакционной смеси поддерживают 25 - 80 С с помощью охлаждения. Этот раствор оставляют стоять при комнатной температуре на 2 час, а затем отгоняют растворитель в вакууме при температуре, не превышающей 50 С. К оставшемуся сырому а-хлор-этил-о-метилацетоацетанилиду добавляют раствор 30 г тиомочевины в 60 мл воды и 60 мл спирта. Смесь нагревают при кипячении с обратным холодильником в течение 15 мин. Этанол отгоняют, а водный остаток подщелачивают разбавленным водным раствором гидроокиси натрия. Белый осадок отфильтровывают, промывают водой и бензолом и сушат. Получают 40 г (80%) продукта с т. пл. 210 - 213 С,После перекристаллизации из бензола, содержащего небольшое количество метанола, образуются белые кристаллы с т. пл, 219 - 222 С,П р и м е р 6, 2-Амино-метил-Х-бензилкарбоксамидотиазол.К суспензии 30 г М-бензилацетоацетамида в 100 мл бензола порциями добавляют 23 г хлористого сульфурила (избыток 11%) в течение 10 мин, поддерживая температуру 20 - 25 С охлаждением, Полученный раствор оставляют при комнатной температуре на 2 час, а затем удаляют растворитель в вакууме при температуре, не превышающей 50"С. К полученному сырому а-хлор-Х-бензилацетоацетамиду добавляют раствор 20 г тиомочевины в 50 мл. воды и 50 мл спирта. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 15 мин. Этанол отгоняют, а оставшийся водный раствор подщелачивают гидроокисью натрия. Белый осадок отфильтровывают, промывают водой и бензолом и сушат. После кристаллизации из изопропанола получают 23 г (60%) белого твердого продукта с т. пл. 143 - 145 С.П р и м е р 7, 2-Амино-метил-М,М-диметилкарбоксамидотиазол.К раствору 40 г Х,М-диметилацетоацетамида в 100 мл бензола по каплям в течение 15 мин добавляют 45 г хлористого сульфурила, поддерживая температуру реакционной массы 20 - 25 С охлаждением. Полученный раствор оставляют при комнатной температуре на 3 час, а затем удаляюг растворитель в вакууме при температуре, не превышающей 50 С. К оставшемуся сырому а-хлор-Х,М-диметилацетоацетамиду прибавляют раствор 30 г тиомочевины в 60 мл воды, Раствор нагревают на паровой бане в течение 10 мин. После этого его обрабатывают избытком на-. сыщенного водного расгвора бикарбоната натрия. Белый осадок отфильтровывают, промывают холодной водой и сушат. Получают 30 г (52%) продукта с т. пл. 220 - 225 С (с разложением). После:перекристаллизации из изопропилового спирта т. пл. 236 - 238 С (с разложением).П р и м е р 8, 2-Метиламино-метил-карбоксанилидотиазол.Смесь 63,5 г а-хлорацетоацетанилида, 27 г метилмочевины и 150 мл 95%-ного этанола нагревают при кипячении с обратным холодильником в течение 2,5 час. Твердые продукты быстро растворяются сразу же после нагревания, а затем образуется осадок. Реакционную смесь охлаждают, и твердый осадок отфильтровывают, Твердый продукт (хлоргидрат получаемого соединения) растворяют в теплой воде, раствор отфильтровывают, а 5 10 15 20 25 30 35 40 45 50 55 60 65 6фильтрат подщелачивают при помощи гидро- окиси аммония. Осажденное основание собирают фильтрованием, промывают водой и сушат, Получают 48 г (65%) продукта с т, пл.222 в 2 С.П р и м е р 9, 2-Анилино-метил-карбоксанилидотиазол.63,5 г а-хлорацетоацетанилида, 46 г фенилтиомочевины и 165 мл 95%-ного этанола нагревают при кипячении с обратным холодильником в течение 2,5 час. Образуется раствор. Из реакционной смеси не выделяется никакого осадка. После ее охлаждения образуется кристаллический осадок, которьш является хлоргидратом. Его отфильтровывают и перекристаллизовывают из этанола, Получают 73 г (78%) серо-белого твердого вещества с т. пл. 189 - 191 С.В табл. 1 приведены другие 2-амино-метил-карбоксамидотиазолы, получаемые предлагаемым способом, общей формулыКН СОЧВ,В3П р и м е р 11. 2,4-Диметил-карбоксанилидотиазол.211,5 г (1 моль) а-хлорацетоацетанилида, 75 г (1 люль) тиоцетамида и 400 мл этанола вместе нагревают при кипячении с обратным холодильником на паровой бане. Экзотермическая реакция начинается с момента закипания смеси, Реагенты переходят в раствор за несколько м инут. Внешнее нагревание прекращают до тех пор, пока не утихает экзотермическая реакция, затем возобновляют и продолжают примерно 1 час. После охлаждения реакционной смеси образуется осадок хлоргидрата тиазола, который снова растворяют некоторым количеством разбавленной соляной кислоты. Затем смесь нагревают. Небольшие количества нерастворимого вещества удаляют фильтрованием раствора, а фильтрат подщелачивают разбавленным раствором гидроокиси аммония. Осажденный тиазол собирают фильтрованием, дважды промывают холодным водно-этанольным раствором (1: 1) и сушат.Получают 175 г (75%) тиазола с т. пл, 138 - 140,о С.П р и м е р 12, 2,4-Диметил- (о-метоксикарбоксанилидо) тиазол.Раствор 27 г (0,2 моль) хлористого сульфурила в 50 мл бензола, прибавляют по порциям к 41,4 г (0,2 моль) ацетоацет-о-анизида в 100 мл бензола. Смесь оставляют на 1 час при комнатной температуре, затем упаривают растворитель под уменьшенным давлением, К остатку прибавляют 120 мл этанола и 16 г (0,21 моль) тиоацетамида. Полученную смесь нагревают при кипячении с обратным холодильником в течение 30 мин. Примерно через 10 мин образуется осадок. Реакционную смесь охлаждают, а осадок отфильтровывают и растворяют в теплой, очень разбавленной соляной кислоте (примерно 25 мл концентрированКарбоксанилидо о.Метилкарбоксанилидо м-Метилкарбоксанилидо и-Метилкарбоксанилидоо-Этилкарбоксанилидоо-Хлоркарбоксанилидом-Хлоркарбоксанилидол-Хлоркарбоксанилидол.Бромкарбоксанилидоо.Метоксикарбоксанилидои-Метоксикарбоксанилидоп.Нитрокарбоксанилидо2,4-Диметплкарбоксанилидо 2,5-Диметилкарбоксанилидо 2-Метокси-метилкарбоксанилидо4-Метокси-метилкарбоксанилидо3,4-Дихлоркарбоксанилидо 3-Хлор-метилкарбоксанилидо 2,4,6-Триметилкарбоксанилидо 2,4,5-ТрихлоркарбоксанилидоИ-а-нафтилкарбоксамидо 11-а.пиридилкарбоксамидо И-метилкарбоксанилидоХ.этилкарбоксанилидоМ-р-цианэтилкарбоксанилидо Х-этил-о-метилкарбоксанилидоИ-бензолкарбоксамидо И-этилкарбоксамидо М-н-бутилкарбоксамидо 11-циклогексилкарбоксамидо и-Фенилкарбоксанилидо 11,Х-диметилкарбоксамидо Х,И-диэтилкарбоксамидо Х,Х-диизопропилкарбоксамидо 11,Я-ди-и-бутилкарбоксамидо Карбоксморфолидо Используемый амин л-Нитроанилин2,4-Диметиланилин 2,5.Диметнланилин 2-Метокси-метиланилин 4-Метокси-метила нилин 3,4-Дихлоранилин3-Хлор-метиланилин2,4,6-Триметиланилин 2,4,5-Трихлоранилина-Нафтиламин а-Аминопиридин Х-р-цианитиламин 11.этил-о.толуидин и-Бутил аминЦиклогексиламин Х,И-диметиламин1 Ч,11-диэтиламин11,11-диизопропиламин-1 Гсоннен 50 290 в 2 азбавляют 750 мл воды), Растт, и фильтрат подщелачивают ммония. Высадившийся тиазол трованием, промывают водой и небольши сушат. П 98,5 - 101В табл м количеством холодног олучают ЗЗ г (63%) прод о2 приведены другие 2Т этанола таст.п алкил-м еблица 2 Выход, % Используемый амин, пл о-СН О СНСН 139 в 1,5 85 в 1,5 Карбоксанилидо Тиоацетамид Тноацетамид Тиоацетамид пили о Метоксикарбоксанилидо о.Анизиднн О.СНзС 6 Н 4и-С -6 124 в 1 153 в т 1 130 в 1 о.Метнлкарбоксанилндо о Толундн Хлоркарбоксанил-Хлоранилин Тиоацет амид Тиобутнрами СН, - СН,), -Нз -окса нилидо ннли Название заместителя в 5-и положении2,6-Диэтилкарбоксаиилидо о-Карбэтокснкарбоксаннлидо 2.Хлор-б-метоксикарбоксанилидом.Бромкарбоксанилидо м-Трифторметилкарбоксанилидо5.Хлорметоксикарбоксани.лидо2,6-Диметилкарбоксанилидо м-Метоксикарбоксанилидо3,4-Диметилкарбокса нилидо2,5-Дихлоркарбоксанилндо 2,4-Дихлоркарбоксанилндо 2,3-Дихлоркарбоксинилидо 4-Хлор-метилкарбоксанилидо5-Хлор.2-метилкарбоксалндо трет- Б утили а рб окса мкдо 2.Тиазолилкарбоксамидо 5-Хлор,4-Диметоксикарбоксанилидоо.Этокснкарбоксинилидо п-Этоксикарбоксанилидо 1,2-Этилен-бис. (2.амино- -4-метилкарбоксамидотиазол) нои кислоты р вор фильтрую гидроокисью собирают фил Используемый амин 2,4-С 16 - СбНз -2,3-Сз - СбНз4-С 1-2 СНз -СбНз5-С 1-2-СНз -СбНз -/ 11 ИО 0 15 20 Составитель С. ПоляковаТехред В. Рыбакова Корректор А. П. Васильева Редактор С. Лазарева Заказ 1348/4 Тираж 480 ПодписноеЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров СССРМосква Ж, Раушская наб., д. 4/5 Типография, пр. Сапунова тил-карбоксанилидотиазолы, получаемые предлагаемым способом, формулы1 ч сН,х СГ СОЩ,ЬгП р и м е р 14, 2,4-Диметил-карбоксанилидотиазол.177 г (1,0 моль) ацетоацетанилида и 1 л толуола помещают в трехлитровую колбу, снабженную холодильником, капельной воронкой и эффективной мешалкой. К перемешиваемой смеси добавляют в течение 15 - 20 лгин 137 г (1,01 моль) хлористого сульфурила, Смесь перемешивают в течение 30 - 60 мик, и затем через нее пропускают слабый ток азота или воздуха в течение 1 час 12 мин - 2 час для удаления хлористого водорода и двуокиси серы. К смеси прибавляют 75 г (1,0 моль) тиоацетамида и затем нагревают при энергичном перемешивании до 70 - 75 С в течение примерно 15 - 20 иин. Как только температура поднимается, суспендированное твердое вещество превращается в вязкую жидкость, которая оседает на стенки колбы. Нагревание прекращают, как только температура реакционной смеси достигает 75 С, однако она увеличивается до 80 - 85 С, так как идет экзотермическая реакция. Вязкую жидкость кристал. лизуют в течение нескольких минут. После перемешивания в течение 20 - 30 мин реакционную смесь охлаждают, Как только температура снижается до 50 С или ниже, к массе прибавляют разбавленную соляную кислоту (75 мл концентрированной соляной кислоты разбавляют 1500 мл дистиллированной воды). Смесь перемешивают несколько минут, чтобы растворить твердый хлоргидрат тиазола. За. тем разделяют слои. Водный слой фильтруют и подщелачивают разбавленным раствором гидроокиси аммония. Высадившийся тиазол собирают фильтрованием, промывают дистиллированной водой и сушат. Получают 181 г (78%) продукта с т, пл. 139,5 С. Дополнительные 15 г менее чистого продукта получают путем экстракции толуольного слоя два ил 11 более раза разбавленной соляной кислотой (50 мл концентрированной соляной кислоты разбавляют до 500 мл дистиллированной во дой каждый раз). Общий выход продукта84 5% 10 Способ получения замешенных карбоксамидотиазолов общей формулы где Х - замешенная или незамещеннаяаминогруппа,К, - водород, замешенная или незаме.щенная углеводородная группа;К - замещенная или незамещенная углеводородная группа, содержащаядо 12 атомов углерода, или25 Х - замещенная или незамещенная алкильная группа, содержащая до 8атомов углерода;К - водород. замещенная или незамещенная углеводородная группа,30 К 2 - арил, алкарил или галоидарил,отличающийся тем, что я-галоидацетоацетамид общей формулы.1=С - СН3д,35 2 - СН-С - Х,0В где К 1 и Кз имеют вышеуказанные значения, 40 а 2 - хлор или бром, подвергают взаимодействию с тиомочевиной или тиоамидом в воде или в среде органическото растворителя, полученный при этом продукт выделяют в виде основания или известными приемами перево дят в кислые аддитивные соли.
СмотретьЗаявка
1197460
Виль Ашлей Гаррисон, Маршалл Кулка, Иностранна фирма Юниройл Инк, Соединенные Штаты Америки
МПК / Метки
МПК: C07D 277/56
Метки: замещенных, карбоксамидотиазолов
Опубликовано: 01.01.1969
Код ссылки
<a href="https://patents.su/6-253685-sposob-polucheniya-zameshhennykh-karboksamidotiazolov.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения замещенных карбоксамидотиазолов</a>
Предыдущий патент: Способ получения замещенных 2-анилинбензоксазолов
Следующий патент: Способ получения аминозамещенных фталанов
Случайный патент: Антифрикционный материал на основе меди