13-(1-оксил-2, 2, 6, 6-тетраметилпиперилиденил-4)гидразон рубомицина хлоргидрат с парамагнитным центром, проявляющий противоопухолевую активность, и способ его получения
Формула | Описание | Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 977462
Авторы: Денисова, Дьячковская, Коновалова, Поваров, Сускина, Шапиро, Эмануэль
Формула
1. 13-(1-Оксил-2,2,6,6-тетраметилпиперилиденил-4)гидразон рубомицина хлоргидрат с парамагнитным центром формулы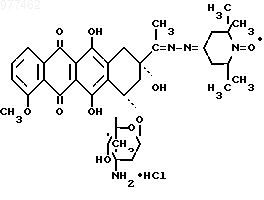
проявляющий противоопухолевую активность.
2. Способ получения 13-(1-оксил-2,2,6,6-тетраметилпиперилиденил-4)гидразона рубомицина хлоргидрата по п.1, отличающийся тем, что хлоргидрат рубомицина обрабатывают щелочным агентом, затем осуществляют взаимодействие полученного основания рубомицина с гидразоном 1-оксил-2,2,6,6-пиперидона-4 при их молярном соотношении 1 1,5 - 2 в среде хлороформа и метанола, взятых в объемном соотношении 8 1, в присутствии уксусной кислоты, взятой в четырехкратном молярном избытке по отношению к основанию рубомицина, при 20 25oС с последующей обработкой отделенного от осадка раствора спиртовым раствором хлористого водорода, взятого в двухкратном молярном избытке по отношению к основанию рубомицина, и выделение целевого продукта с осаждением диэтиловым эфиром.
Описание
Известен рубомицин (даунорубицин), который применяется в клинике при лечении острых лейкозов, хорионэпителиомы матки, опухолевых ретикулезов.
Однако рубомицин обладает также различными видами побочного действия: кардиотоксичен, угнетает кроветворение, имеет ограниченный спектр действия и недостаточно высокую противоопухолевую активность.
Известны также производные замещенные гидразоны даунорубицина (рубомицина) общей формулы
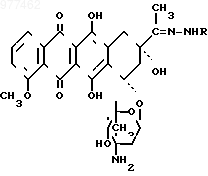 где R COCH3; -COC2H5; -COCH(CH3)2; -CO(CH2)14CH3; -COC6H5; -COC6H4; -COC6H4 (n-OCH3); -CHO, обладающие противоопухолевой активностью.
где R COCH3; -COC2H5; -COCH(CH3)2; -CO(CH2)14CH3; -COC6H5; -COC6H4; -COC6H4 (n-OCH3); -CHO, обладающие противоопухолевой активностью.Большинство этих соединений сохраняет активность даунорубицина, некоторые имеют более низкую токсичность. Среди них наилучшим является бензоилгидразон даунорубицина (рубидазон, R COC6H5, который обладает меньшей кардиотоксичностью.
Цель изобретения получение нового, более эффективного соединения, обладающего пониженной токсичностью, более высокой противоопухолевой активностью и более широким спектром действия.
Поставленная цель достигается путем получения нового производного рубомицина, а именно 13-(1-оксил-2,2,6,6-тетраметилпиперилиденил-4)гидразон рубомицина хлоргидрата с парамагнитным центром
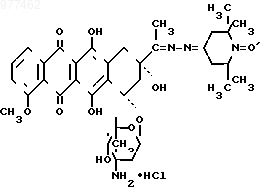 проявляющего противоопухолевую активность.
проявляющего противоопухолевую активность.По химическому строению данное соединение представляет собой несимметричный бис-гидразон, который можно рассматривать также как несимметричный азин, и является новым типом производных рубомицина, в молекуле которого имеется парамагнитный центр. Соединение условно названо Рубоксил.
Данное соединение тормозит рост злокачественных опухолей и может быть применено в онкологической практике для лечения злокачественных заболеваний крови и опухолей различных локализаций, обладает пониженной токсичностью, а также более высокой противоопухолевой активностью и более широким спектром действия по сравнению с указанными известными соединениями.
Наличие парамагнитного центра в соединении дает возможность проводить фармакокинетические исследования методом ЭПР (электронного парамагнитного pезонанса). Это позволяет проследить за накоплением и выведением препарата, содержащего в качестве действующего начала данное соединение, из органов и тканей животных и человека, не прибегая к синтезу меченого соединения, представляющего собой активный изотоп.
Новое соединение с парамагнитным центром представляет собой красное кристаллическое вещество, растворимое в воде, этиловом спирте, хлороформе.
Спектр ЭПР триплет c
Найдено, C 59,02; 58,80; H 6,42; 6,57; N 7,60; 7,55.
C36H45N4O10
Вычислено, C 59,20; H 6,36; N 7,68.
ИК-спектр (KBr): отсутствует полоса с
Цель изобретения новый способ получения 13-(1-оксил-2,2, 6,6-тетраметилпиперилиденил-4)гидразона рубомицина хлоргидрата.
Поставленная цель достигается тем, что хлоргидрат рубомицина обрабатывают щелочным агентом для перевода хлоргидрата в основание рубомицина, затем осуществляют взаимодействие основания рубомицина с гидразоном 1-оксил-2,2,6,6-тетраметилпиперидона-4 при их молярном соотношении 1:1,5-2 в среде хлороформа и метанола, взятых в объемном соотношении 8:1, в присутствии уксусной кислоты, взятой в четырехкратном молярном избытке по отношению к основанию рубомицина, при 20-25оС с последующей обработкой, а оставшийся отделенный от осадка раствор, содержащий продукт реакции, обрабатывают спиртовым раствором хлористого водорода, взятого в двухкратном молярном избытке по отношению к основанию рубомицина, полученный продукт осаждают диэтиловым эфиром. Целевой продукт выделяют известными приемами.
Взаимодействие основания рубомицина с гидразоном 1-оксил-2,2,6,6-тетраметилпиперидона-4 и последующая обработка полученного продукта реакции хлористым водородом протекают по следующей схеме:
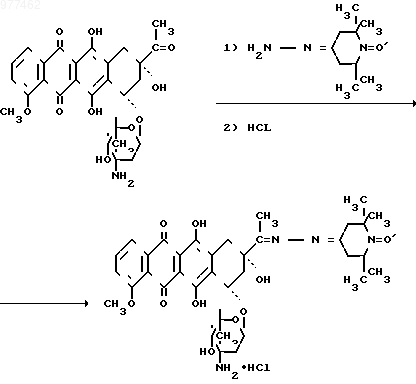
Способы получения несимметричных азиновых производных антрациклиновых антибиотиков неизвестны. При действии гидразонов на хлоргидрат рубомицина происходит их диспропорционирование с образованием смесей двух симметричных и несимметричных азинов. При действии гидразонов на основание рубомицина в спиртах также происходит их диспропорционирование.
П р и м е р. Cинтез 13-(1-оксил-2,2,6,6-тетраметилпиперилиденил-4)гидразона рубомицина хлоргидрата.
К раствору 1,5 г (2,66 ммоль) хлоргидрата рубомицина в 50 мл воды добавляют 25 мл 0,2 н. Na2CO3, основание рубомицина экстрагируют 250 мл хлороформа, экстракт упаривают в вакууме до объема 75 мл и добавляют 0,9 г (4,9 ммоль) гидразона 1-оксил-2,2,6,6-тетраметилпиперидона-4, 0,5 мл уксусной кислоты и 10 мл метанола. Раствор выдерживают в течение 2 суток при 20-25оС, осадок отфильтровывают, к фильтрату добавляют 10 мл 0,6 н. HCl в метаноле и продукт осаждают диэтиловым эфиром.
Получают 800 мг 13-(1-оксил-2,2,6,6-тетраметилпиперилиденил-4)гидразона рубомицина хлоргидрата (выход 41,5% от исходного хлоргидрата рубомицина).
В системе хлороформ метанол вода (объемное соотношение 13:6:1)Rf для полученного целевого продукта равно 0,64, для хлоргидрата рубомицина Rf равно 0,55. Активность в отношении Bacillus mycoides составляет 26% от активности хлоргидрата рубомицина.
Соединение испытывают в эксперименте на животных на биологическую активность. При этом острую и хроническую токсичность указанного соединения определяют на белых беспородных мышах и оценивают по методу Бернса. Под острой токсичностью понимается однократное введение соединения, под хронической многократное, в данных экспериментах семикратное ежедневное. 13-(1-Оксил-2,2,6,6-тетраметилпиперилиденил-4)гидразон рубомицина хлоргидрата вводят внутрибрюшинно в физиологическом растворе при концентрации соединения в растворе
Противоопухолевую активность определяли на моделях экспериментальных лейкозов La, P-388, L-1210, перевиваемых на мышах ВДF1, и на солидной опухоли эритромиелоз Швеца у крыс. Во всех случаях данное соединение и известные (рубомицин и рубидазон) используют, растворяя их в физиологическом растворе, и вводят при лечении внутрибрюшинно. Указанные соединения начинали вводить на следующий день после прививки опухолей. На всех моделях применяемые дозы нового соединения и рубомицина были эквитоксичными. На модели лейкоза Lа соединение по предлагаемому способу вводят ежедневно в дозе 5 мг/кг в течение 7 дней, рубомицин по той же схеме в дозе 0,5 мг/кг. Лейкемию Р-388 лечат данным соединением в дозе 15 мг/кг, вводимой через 72 ч 7 раз. Рубомицин вводят в дозе 1,4 мг/кг по той же схеме, рубидазон ежедневно в течение 9 дней в дозе 4 мг/кг. Лейкемию L-1210 лечат данным соединением в дозе 20 мг/кг.
Сделано 4 инъекции. Интервал между инъекциями 6 сут. Рубомицин вводят в дозе 2,8 мг/кг по той же схеме. Рубидазон вводят в максимально переносимой дозе 1,5 мг/кг ежедневно в течение 9 дней. В экспериментах лейкемию L-1210 перевивают лейкемическими клетками, взятыми в количестве 105, в то время, как при испытании противоопухолевой активности рубидазона лейкемию L-1210 перевивают меньшим количеством клеток, а именно 103. Наличие меньшего количества лейкемических клеток создает более благоприятные условия для химиотерапии в случае использования любого противоопухолевого агента, в том числе рубидазона.
Критерием противоопухолевой активности на моделях Р-388 и L-1210 является увеличение средней продолжительности жизни леченых животных по сравнению с контрольными по формуле,
Lоп время жизни животных в леченой группе;
Lк время жизни животных в нелеченой контрольной группе.
На модели лейкоза Lа критерием противоопухолевой активности являлся кинетический критерий (
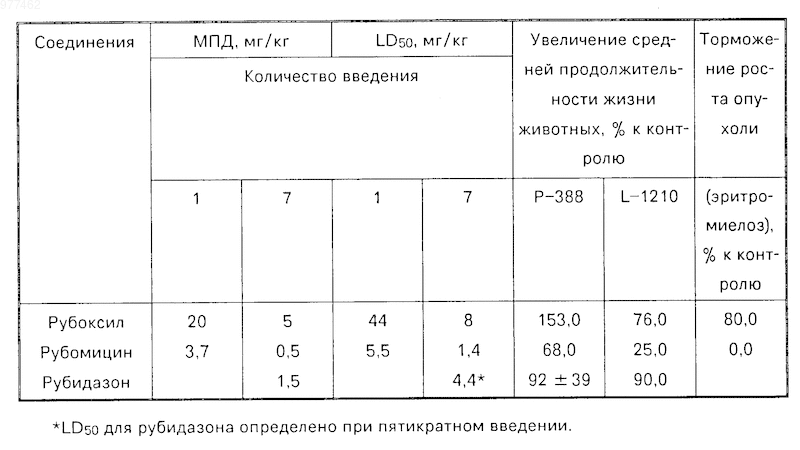
Из таблицы видно, что как острая, так и хроническая токсичность предлагаемого соединения значительно ниже токсичности известных соединений.
Данное соединение значительно увеличивает среднюю продолжительность жизни животных с экспериментальной лейкемией Р-388 по сравнению с действием рубомицина и рубидазона, а в случае L-1210 увеличивает среднюю продолжительность жизни животных по сравнению с действием рубомицина. В случае лечения рубидазоном лейкемии L-1210 условия эксперимента были гораздо мягче, чем в настоящем эксперименте (прививка происходила в 100 раз меньшим количеством клеток и лечение было ежедневным, а не раз в шесть суток, как в предлагаемом эксперименте). Отсюда и более высокий результат по средней продолжительности жизни животных, равной 90% (соответствующий процент для нового соединения, согласно таблице, равен 76,0). Использование же рубидазона в условиях настоящего эксперимента привело к более худшему показателю по средней продолжительности жизни по сравнению с действием предлагаемого соединения.
При использовании для лечения эритромиелоза Швеца рост опухоли тормозится на 80% по сравнению с контролем. Применение рубомицина не дает никакого эффекта.
Таким образом, предлагаемое новое соединение обладает более низкой токсичностью и более высокой противоопухолевой активностью по сравнению с известными сравниваемыми соединениями и представляет значительный интерес для использования в фармацевтической промышленности и медицине.
Предварительная клиническая апробация предлагаемого соединения на небольшом количестве опухолей разных локализаций позволяет рекомендовать это соединение в качестве действующего начала лекарственного препарата при лечении злокачественных заболеваний крови, опухолей легкого и желудочно-кишечного тракта.
Лекарственный препарат на основе данного соединения рекомендуется выпускать в виде порошков, таблеток, капсул для введения в виде раствора в физиологическом растворителе для парентерального введения ex tempore.
Рекомендуемая доза для однократного введения препарата 400 мг/м2. Более эффективным является лечение большими дозами с длительными интервалами между введениями лекарственного препарата (например, 1000 мг/м2 один раз в две недели).
Лекарственный препарат рекомендуется хранить в темном холодном месте при температуре от 2 до 0оС. Порошки, таблетки и капсулы хранят в обычной картонной упаковке. Растворы для парентерального введения хранят во флаконах.
Рисунки
Заявка
2893526/04, 24.03.1980
Отделение Института химической физики АН СССР
Эмануэль Н. М, Коновалова Н. П, Поваров Л. С, Шапиро А. Б, Дьячковская Р. Ф, Сускина В. И, Денисова Л. К
МПК / Метки
МПК: C07H 15/252
Метки: 13-(1-оксил-2, 6-тетраметилпиперилиденил-4)гидразон, активность, парамагнитным, противоопухолевую, проявляющий, рубомицина, хлоргидрат, центром
Опубликовано: 27.06.1995
Код ссылки
<a href="https://patents.su/0-977462-13-1-oksil-2-2-6-6-tetrametilpiperilidenil-4gidrazon-rubomicina-khlorgidrat-s-paramagnitnym-centrom-proyavlyayushhijj-protivoopukholevuyu-aktivnost-i-sposob-ego-polucheniya.html" target="_blank" rel="follow" title="База патентов СССР">13-(1-оксил-2, 2, 6, 6-тетраметилпиперилиденил-4)гидразон рубомицина хлоргидрат с парамагнитным центром, проявляющий противоопухолевую активность, и способ его получения</a>
Предыдущий патент: Устройство для защиты линии электропередачи
Следующий патент: Фотополимеризующаяся композиция
Случайный патент: Способ устранения углового смещения костных отломков в аппарате для внеочагового остеосинтеза