Способ получения замещенных имидазолов или их нетоксичных фармацевтически приемлемых аддитивных солей
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
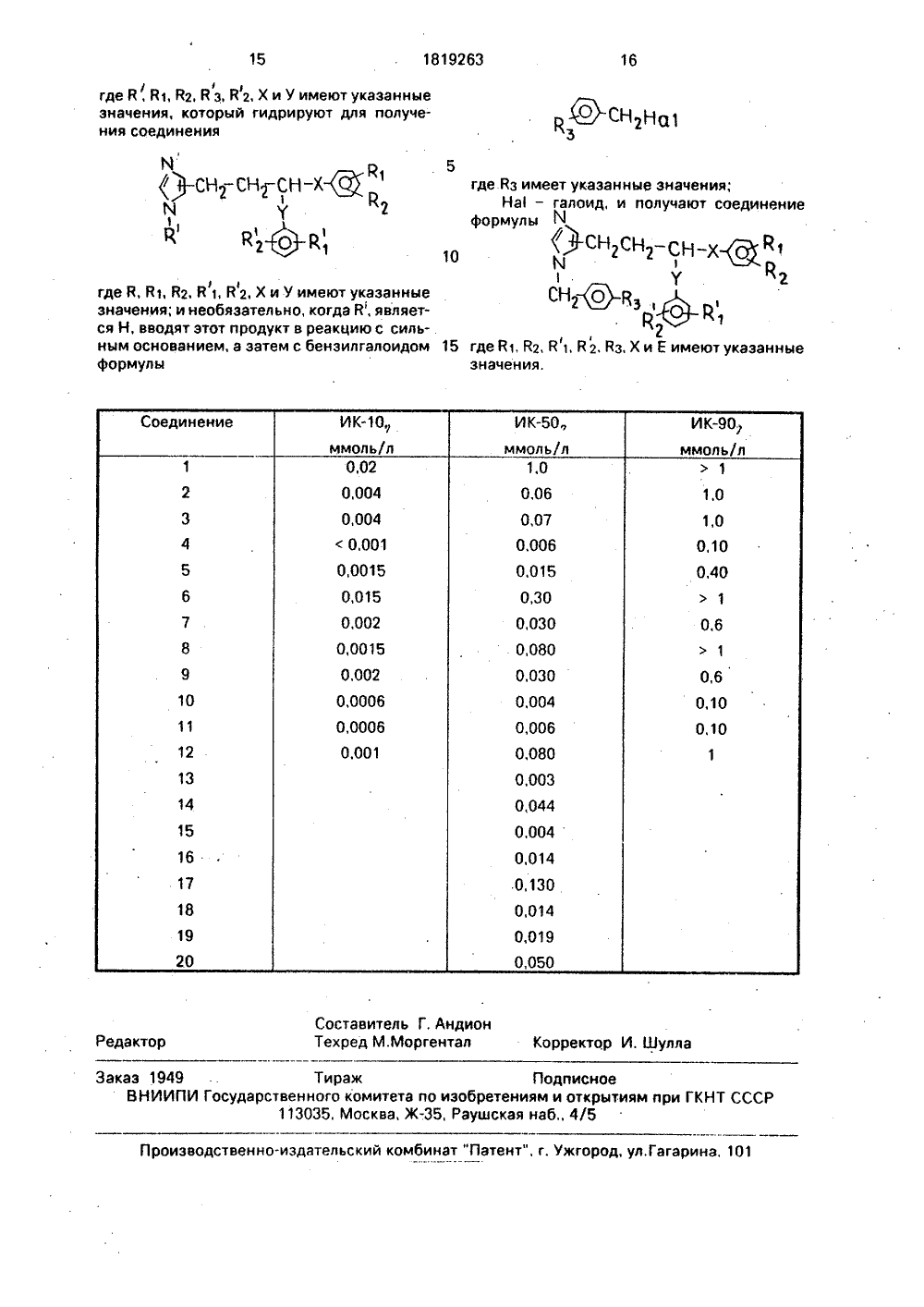
Текст
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСКИХРЕСПУБЛИК ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕВЕДОМСТВО СССР(72) Арто Йоханнес Карьялайнен, ЛауриВейкко Матти Кангас и Каукр Ойва АнтероКуркела (Р)(54) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХИМИДАЗОЛОВ ИЛИ ИХ НЕТОКСИЧНЫХФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ АДДИТИВНЫХ СОЛЕЙ(57) Изобретение касается замещенныхимидазолов, в частности получения соединений общей ф-лы Изобретение относится к способу получения новых замещенных имидазолов или их нетоксичных фармацевтически приемлемых аддитивных солей. которые подавляют выработку ароматазы и поэтому являются ценными при лечении эстрогензависимых(51)5 С 07 О 233/64 // А 61 К 31/415 где Й 1, В 2 и В,В 2(равны или различны)- Н, СНз, С 2 Н 5, ОСНз, или галоген; В = Н, СН 2- С 6 Н 4 - 3-Вз при Вз = Н, СНз, галоген; Й 4 = ВБ = Н, или В 5 = ОН, или (В 4+ВБ) образуют связь, Х и У (равны или различны) -связь или С 1 - С 2- алкилен, или их нетоксичных фармацевтически приемлемых солей, подавляющих .выработку ароматазы, что может быть использовано для лечения эстрогензависимых заболеваний, например рака молочной железы, Цель - создание новых веществ с активностью, не характерной для данного класса. Синтез включает: а) реакцию алкилового эфира 4(5)имидазолпропионовой кислоты или соответствующего амида этой кислоты с реактивом Гриньяра ф-лы ВВ 2 - С 6 НЗ-Х-М 9-НА), где Х,ВГ Й 2 указаны выше, НА)-галоген; б) обработку другим реактивом Гриньяра ф-лы: В 1 В 2 С 6 Нз-У - М 9 НА, где В 1,В 2, У указаны выше; в)дегидратацию; г) гидрирование, причем необязательно Й=Н.Этот продукт обрабатывают сначала сильным основанием, а затем бензилгалоидом ф-лы ВЗСБНа-СН 2-НА. Новые вещества ин- в гибируютароматазу при концентрации ИК 50 (ф = 300 мкмолей/л, что более селективно, чем в у аминоглютетимида. 1 табл. 0 заболеванийнапример рака молочной железы.Цель изобретения - синтез новых замещенных имидазола, обладающих ценными свойствами, не характерными для данного ряда соединений и по своей активности пре 1819263восходящих применяемый для тех же целей аминоглютетимид,Следующие примеры иллюстрируют изобр.етение,П р и м е р 1. 4-(З,З-Дифенил-З-гидроксипропил)-1 Н-имидаэола) 5-(1-бензилимидаэол)акриловая кислота.В пробирку поместили 18,6 г 5-(1-бензилимидазол)-карбальдегида, 10,4 г малоновой кислоты и 4,8 мл пиридина, Смесь нагревали на водяной бане в течение 16 ч. Затем ее охладили и разбавили водой. Осадок, который являлся целевым продуктом, отфильтровали и промыли водой. Выход 15 г. Т. пл. 221 - 226 С, Н ЯМ Р: 5,15 (с, 1 Н), 5,64 (с, 2 Н) 6,58 (д, 1 Н) 7,3 - 75 (м, 5 Н), 7,61 (д, 1 Н) 8,08 (с,1 Н) 9,07 (с,1 Н),б) этиловый эфир 4(5)-имидазолпропионовой кислоты,5-(1-бенэилимидаэол)акриловую кислоту (15 г) растворили в 50 мл 4 н. соляной кислоты, Добавили 60 мг 10 Рб/С и смесь интенсивно перемешивали в атмосфере водорода при 85 С до тех пор, пока водород не перестал расходоваться. Реакционную смесь профильтровывали и выпарили досуха. Остаток растворили в 50 мл абсолютного этанола, через раствор продували сухой хлористый водород в течение 4 ч, причем смесь поддерживали при температуре дефлегмацими и перемешивали. Затем смесь выпарили досуха и получили маслянистый остаток, который представлял собой сухой продукт, использованный в последующей редакции Гриньяра.Н ЯМР: 1,237 (т,ЗН) 2,656.(т,2 Н) 2,936 (т,2 Н) 4,137 (к,2 Н) 6,804 (с,1 Н) 7,559 (с,1 Н).. О) 4-(З,З-дифенил.-З-гидроксипропил)- 1 Н-имидазол.3,3 г стружки магния покрыли 100 мя сухого тетрагидрофурана. В эту смесь после этого добавили по каплям раствор 21,8 г бромбензола в 30 мл сухого тетрагидрофурана с такой скоростью, что поддерживалась плавная реакция. После завершения добавления реакционную смесь дефлегмировали в течение дополнительного 1 ч и охладили до комнатной температуры. После. этого данную реакционную смесь по каплям добавили в раствор этилового эфира 4(5) имидазолпропионовой кислоты (7,8 г) в 50 мл тетрагидрофурана при комнатной температуре, После завершения добавления реакцинную смесь перемешивали 1 ч при 40-50 С. Смесь затем охладили и вылили в холодную воду. Тетрагидрофуран испарилии в раствор добавили концентрированную соляную кислоту (20 мл). Раствор охладили и осадок, который содержит продукт в виде хлористоводородной соли удалилифильтрацией, промыли и обезводили, Получили 11,2 г т.пл. 189-191 С,5 Н ЯМР; 1,703 (с, 4 Н) 4,578 (с,ЗН) 7,2147,429 (м,11 Н) 8,457 (с,1 Н),Аналогично при помощи реакции Гриньяра, начиная с этилового эфира 4(5) имидазолпропионовой. кислоты и10 соответствующего замещенного боромбен зола, можно также получить другие соединения настоящего изобретения, Например,получены следующие замещенные производные:154-(3,3-бис(4-хлорфенил)-З-гидроксипропил)-1 Н-иомидаэол. Т.пл. хлоргидрата 8589 С.4-3,3-бис(2-метилфенил)-З-гидроксипропил)1 Н-имидаэол,Т.пл, хлоргидрата 211-213 С.4-(3,3-бис(З-метилфенил)-З-гидроксипропил).1 Н-имидазол.Т.пл, хлоргидрата 170-172 С.25 П р и м е р 2. 4-(З,З-Дифенилпропенил)-1 Н-.имидазол.2 г хлоргидрата 4-(З,З-дифенил-З-гидро-ксипропйл)-1 Н-имидазола смешали с 20 гбезводного бисульфата калия и смесь нвгре 30 вали на масляной бане при 150-55 С 4 ч.Затем смесь охладили и добавили 20 млводы. Смесь подщелачивали раствором едкогО.натраиОхладили. Осадок, представляющий собой продукт, профильтровали,35 промыли вщой и обезводили, Выход 1,25 г,После рекристаллизации из смеси вода-этанол, продукт плавился при 124-128 С,Н ЯМР; 3,42 (д, 2 Н) 4,756 (с. 1 Н) 6,284 .(т,1 Н) 6,768 (с,1 Н) 72-7,4 (м, 10 Н) 7,55940 (с,1 Н),8 соответстаии с такой же процедуройполучили, например, следующие замещенНЫВ ПРОИЗЕОДНЫЕ.4-3,3-бис(4-хлорфенил)про песн-ил 148 Н имиевэац идрсхпорид. т.пп. 188-183 С.4 3,3 бис(2.метипреиип)пропеи.2-ип Н имидаеептмдрохпсридТ.пп. 198-198 С.4 З,Э бис 9 метипбеиипропеп.ип1 Н-имидазол. Т;пл, 115-118 С.50 4-(З,З-бис(З-фторфенил)п ропе н-ил)- 1 Н-имидазол. Т пл. хлоргидрата 125-128 С.П р и м е р 3. 4-(З,З-Дифенилпропил)-1 Нимидазол.54-(З.З-Дифенилпропен-ил)-1 Н-имидазол (0,7 г растворили в зтаноле и добавиликаталитическое количество Рб/С (10). Реакционную смесь сильно перемешивали при комнатной температуре в атмосфере во 1819263дорода, пока не прекратилось поглощениеводорода. Смесь профильтровали и фильтрат испарили до сухости. Остаток рекристаллизовали иэ смеси вода-этанол, Выход0,4 г т.пл. 115-117 С.Н ЯМР; 2,3-2,5 (м,4 Н) 3,919(т.1 Н) 4,752(с,1 Н),В соответствии с такой же процедуройполучили, например, следующие замещенные производные:4-(3,3-бис(2-метилфенил)пропил)-1 Н-имидаэол, хлоргидрат. Т.пл. 84-87 ОС;4 3,3-бис(3-метилфени)пропил 1 Н-имидазол. Т.пл; 111-114 С. Н ЙМР (как основание);2,272 (с,6 Н) 2,2-2,5 (м,4 Н) 3,823 (т,1 Н)6,691 (с,1 Н) 6,8-7,2 (м,8 Н) 7,440 (с,1 Н);4-3 Змбис(З-фторфенил)пропил)-1 Н-имидазол Н ЯМР(как НС);2,3-2,8 (м,4 Н) 4,060 (т.1 Н) 4,784 (с,2 Н)6,7-7,4 (м,9 Н) 8,743 (с,1 Н),П р и м е р 4. 1-Бензил(3,3-бис(4-хлорфенил)-З-гидроксипропил)-1 Н-имидазол,а) Метиловый эфир 1-бензил-имидазолакриловой кислоты,В колбу поместили 12,0-(1-бензилимидвзол)акриловой кислотй (полученной впримере 1), 70 мл метанола и в течение 4 чв раствор пропускали сухой газообразныйхяористый водород, в течение этого процессе реакционную смесь поддерживали при .температуредеФлегмации, Смесь затем испарили до сухости и остаток растворили вхолодной воде. Раствор сделали щелочнымкэрбонатом натрия и осадок, представляющий собой продукт, профильтровали, про: вели водой.и обвзводили. Выход 12,2 г,т,пл. 37-139 С,1 Н ЯМР: 3,781 (с,ЗН) 5,490 (с,2 Н) 6,452(д,1 й) 7,2-7,5 (м,5 Н) 7,493 (д,1 Н) 7,710 (с,1 Н)ЗЛИИ (с, Фн),6) 1-Бензил-имидазолпропио новойислоты метиловый эфир.Двойную связь боковой цепи гидрогенизировали в абсолютном этаноле, используя как катализатор Рб/С. Когдапоглощение водорода прекратилось, реакционную смесь профильтровали и фильтратиспарили до сухости, Остаток растворили вхлористом метилеие, который промыли водой. Фазу хлориСтого метилена затем обезводили и испарили до сухости и получилипродукт, который использовали как таковойв следующих реакциях Гриньяра.1 зН яМР; Алифатические углероды обнаруживаются при следующих частях на миллион: 19,374; 32,573; 48,466; 51,675; ароматические углероды обнаруживаются придо малого обьема. Добавили воду и смесь сделали щелочной при помощи едкого на тра, Осадок, представляющий собой продукт, профильтровали, промыли водой и обезводили. Продукт рекристаллизовали из воды-этанола. Выход 2,3 г, Нитрат получили в воде при помощи азотной кислоты.Н ЙМР: 3,923 (д,2 Н) 5,287 (с,1 Н) 6,010(т,1 Н) 6,9-7,4 (м,14 Н) 9,330 (с,1 Н).П р и м е р 6. 4-3-(44 лорфенил)-3-гидрокси -3-фенилпропил)-1 Н-имидазола) Кетон 3-(4-имидазолил)пропилхлорфен ила.0,85 г стружек магния покрыли 20 млсухого тетрагидрофурана, смесь нагрели докипения и в нее добавили 6,8 г 4-бромхлорбензола е тетрагидрофуране с такой скоростью, что поддерживалась плавная реакция. 1015 20 25303540 следующих частях на миллион; 126, 569; 128, 022; 128, 748; 128,960; 130,474; 136,074;137,88 и карбонил при 172,522.Ь) 1-Бензил-(З,З-бис(4-хлорфенил) -3- гидроксипропил)-1 Н-имидаэол.Реактив Гриньяра получают из 2,4 г стружек магния и из 19,1 г и-хлорбромбензола в тетрагидрофуране как описано в примере 1 с.Метиловый эфир 1-бензил-имидазолпропионовой кислоты (6,4 г) в тетрагидрофуране нагревали до 60 С и в него по каплямдобавляли приготовленный бромистый ихлорфенилмагний. После завершения добавления реакционную смесь дефлегмировали еще 3 ч, охладили и вылили в холодную воду, Тетрагидрофуран испарили, добавили толуол и смесь подкислили соляной кислотой, Осажденный продукт прбфильтровывали, промыли эфиром и обезводили. Выход 12,2 г, т,пл, 210 - 213 С; т.пл. нитрата 157 - 160 С (получен в смеси вода-простой эфир), Т.пл, хлоргйдрата (из этилацетата) 178-187 С.Н ЯМР: 2,985 (с,4 Н) 4,854 (с,2 Н) 5,330(с,2 Н) 7,06 - 7,46 (м, 14 Н) 8,993 (с,1 Н)Аналогично получили также другие 1-бензилззмещенные производные. Например, 1- бензил-(5-(2,6-диметил фенил)-3- -гидрокси- (2,6-диметилфенил)-пентил)- 1 Н-имидазол из метилового эфира 1-бензил-имидазолпропионовой кислоты и бромистого 2-(2,6-диметилфенил)этилмагния, Точка плавления хлоргидрата 67-71 С,П р и м е р 5. 1-Бензил-(З,З-бис(4-хлорфеиил)пропен-ил) -1 Н-имидазол 4,1 г 1 бенз ил-(3,3-бис(4-хлорфенил) -3-гидроксипропил 1-1 Н-имидазола и 22 г безводного бисульфата калия нагревали до 150 С 4 ч. Смесь охладили, добавили 100 млэтанола для растворения продукта. Смесь затем отфильтровали и фильтрат испарилиПосле завершения добавления реакционную смесь дефлегмировали еще 1 ч. Затем реакционную смесь охладили и по каплям добавили при комнатной температуре в раствор этилового эфира 4(5)-имидазолпропионовой кислоты (4 г) в тетрагидрофуране, После добавления реакционную смесь перемешивали 1 ч при комнатной температуре. Затем ее вылили в холодную воду и сделали кислой при помощи соляной кислоты. После этого реакционную смесь промыли хлористым метиленом, сделали щелочной при помощи едкого натра и продукт экстрагировали до хлористого метилена, Выход 2,2 г. В концентрированной соляной кислоте получили хлористоводородную соль. Т.пл. 160 - 161 С,б) 4-(3-(4-Хлорфенил)-3-гидрокси-фенилпропил)-1 Н-имидазол,В тетрагидрофуране получили фенилмагнийбромид из 0,51 г стружек магния и 3,3 г бромбензола. Кетон 3-(4-имидазолил)пропил-хлорфенила (2,3 г) растворили в тетрагидрофуране и по каплям в этот раствор при комнатной температуре добавили фенилмагнийбромид. После добавления реакционную смесь перемешивали при 40- 50 С еще 3 ч, Затем ее охладили и вылили в холодную воду. Воду сделали кислой при помощи соляной кислоты, Продукт экстрагировали в хлористом метилене, который испарили до сухости. Продукт как хлоргидрат рекристаллизовали иэ смеси вода-этанол, Выход 3,2 г.П р и м е р . 1-Бензил-(З,З-дифенилпропил)1 Н-имидазол и 1-бензил-(3,3-дифенилпропил)-1 Н-имидазол.4-(З,З-Ди фен илп ро пил)-1 Н-имидазол (2,6 г) растворили в 6 мл сухого диметилформамида, При перемешивании в течение 0,5 ч добавили при комнатной температуре 0,5 г МаН (60). После добавления реакционную смесь перемешивали еще 1 ч. При комнатной температуре по каплям после этого добавили 1,7 г бензилбромида и перемешивание продолжалось 4 ч, Реакционную смесь вылили в холодную воду (ЗО мл) и смесь экстрагировали толуолом. Экстракты толуола затем промыли водой и испарили до сухости. Остаток, который представлял собой смесь продуктов, очистили и разделили для очистки изомеров колоночной хроматографией (хлористый метилен/метанол) 9,5/0,5).Н ЯМР продуктов:Один изомер: 2,57(м, 4 Н) 3,52(1 Н),3,877 (т,1 Н) 5,362 (с,2 Н) 6,531(с, 1 Н) 7,05-7,40 (м, 15 Н) 9,567 (с,1 Н).Другой иэомер: 2,375 (м,4 Н) 3,858 (тЛН) 5,253 (с, 2 Н) 7,01-7,36 (м, 16 н) 9,441 (с,1 Н).50 ( 5 г) в 40 мл тетрагидрофурана при 60 СПосле добавления реакционную смесь дефлегмировали 2 ч, охладили и вылили в холодную воду, Тетрагидрофуран испарили и в раствор добавили концентрированную соляную кислоту. Раствор охладили, добавилитакой же эфир и осадок, который содержит продукт. в виде хлористоводородной соли, удалили фильтрацией, промыли и обезводили. Выход 4,1 г. Т.пл, 120-124 С. 5 10 1520 2530 3540 П р и м е р 8. 1-(4-Хлорбенэол)-4-(3,3-дифенилпропил)-1 Н-имидазол и 1-(4-хлорбензол)-5-(3,3-дифенил пропил)-1 Н-имидазолСоединения получили аналогичносоединениям в примере 7 из 4-(З,З-дифенилпропил)-1 Н-имидазола и 4-хлорбенэилхлорида.Н ЯМР продуктов;Один изомер: 2,48 (м,4 Н) 3,934 (т,1 Н)4,999 (с.2 Н) 6,514 (с,1 Н) 7,0-7,3 (м,14 Н) 7,517(с,1 Н).Другой изомер: 2,33 (м,4 Н) 3,887 (т,1 Н)4,852 (с,2 Н) 6,7-7,5 (м,16 Н),П р и м е р 9, 4-(5-(2,6-диметилфенил)-3(2,6-диметил фен илэтил)Пентил)-1 Н-имидазол,4 г хлоргидрата 1-бенэил-(5-(2,6-диметилфенил) -З-гидрокси-З-(2,6-диметилфенилэтил)пентил)-1 Н-имидазола и 20 гбисульфата калия обьединили и смесь 6 ч нагревали при 150 С. Добавили этанол (40 мл) и смесь профильтровали, Добавили 20 мл концентрированной соляной кислоты и смесь гидрогенизировали, используя катализатор палладий на угле (10), пока поглощение водорода не прекратилось. Реакционную смесь профильтровали, добавили воду и смесь сделали щелочной при помощи едкого натра. Продукт затем экстрагировали в толуоле, промыли водой и испарили до сухости. Остаток, который является продуктом как основанием, преобразовали в нитрат при помощи азотной кислоты в воде. Т,пл, 147-150 С,П р и м е р 10. 4-(З,З-бис(3;5-диметилфенил)пропил 1-1 Н-имидазол,а) 1-бензил-(3,3-бис-(3,5-диметилфенил)3- гидроксипропил)-1 Н-имидазол.1,06 г стружек магния покрыли 30 млсухого тетрагидрофурана. В смесь после этого добавили по каплям раствор 5-бром- кислоты (8,14 г) в 10 мл сухого тетрагидрофурана с такой скоростью, что поддерживалась плавная реакция, Последобавления реакционную смесь дефлегмировали 1 ч и охладили до комнатной температуры. После этого реакционную смесь по каплям добавили в раствор этилового эфира 1-бензил-имидазолпропионовой кислоты10 15 20 25 30 35 40 45 50 55 б) 1-Бензил-З,З-бис(3,5-диметилфенил)пропен-ил)-1 Н-имидазол.4 г 1-Бензил-3,3-бис(3,5-диметилфенил) -3-гидроксипропил)-1 Н-имидазола растворили в 30 мл этанола и добавили 2 мл концентрированной соляной кислоты. Реакционную смесь затем дефлегмировали 4 ч и испарили до сухости, Остаток, который является продуктом, рекристаллизовали из этилацетата.Выход 3,1 г. Тял. 170-176 С.В соответствии с описанной в примере процедурой получили следующие замещенные производные;1-бензил-(З,З-дифенилпропен-ил)- 1 Н-имидазол, хлоргидрат, т.пл, 173-175 С;1-бензил-3,3-бис(2-метоксифенил)пропен-илН-имидазол, хлоргидрат, т.пл.191-194 С;1-бензил-3,3-бис(З-метоксифенил)п" ропен-ил 1-1 Н-имидазол, хлоргидрат, т. пл.132 - 135 С;1-Бенэил-З,З-бис(4-метоксифенил)пропен-ил)-1 Н-имидазол хлоргидрат, т.пл, 157-163 ОС;1-бензил-3,3-бис(2,3-диметилфен ил) пропен-ил)-1 Н-имидаэол, хлоргидрат.Н ЯМР (как основание) 2,055 (с,ЗН) 2,159 (с.ЗН) 2,251 (с,бН) 3,467 (д,2 Н) 4,781 (с,1 Н) 5,281 (с,2 Н) 5,761 (т,1 Н) 6,8 - 7,4 (м,12 Н) 9,97 (с,1 Н).. 1-бензил-3.3-бис(2-метилфенил)пропен-ил)-1 Н-имидазол, гидрохлорид, тял.84-87 С;1-бензил-3,3-бис(З-метилфенил)пропен-ил)-1 Н-имидазол, гидрохлорид, т.пл, 115-117 С.с) 2-бензил-3,3-бис(3,5-диметилфе.нил)пропил)-1 Н-имидазол 1-бензил,3- бис(3,5-диметилфенил)п ропен-илН-имидаэол гидрохлорид растворили в этаноле и добавили в смесь каталитическое количество РИС (10). Реакционную смесь интенсивно перемешивали при комнатной температуре в атмосфере водорода до тех пор, пока не прекращается поглощение водорода. Смесь профильтровали и фильтрат выпарили досуха, Остаток, который представляет собой целевой продукт, очистили с помощью испарительной хроматографии, используя в качестве элюента смесь метиленхлориаа с метанолом.Таким жв способом получили:1-бензил-3,3-бис(З-метоксифенил)пропилН-имидазол гидрохлорид, т.пл.165-167 С и 1-бенэил-З,З-дифенилпро- пил 1 Н-имидазол гидрохлорид, тял. 160- 162 С.б) 413,3-бис(3,5-диметилфенил)пропил Н-имида зол 20 г 1-бензил-З,З-бис(3,5-диметилфенил)пропил)-1 Н-имидаэол гидрохлорида гидрировали в смеси 30 мл 2 н. соляной кислоты и.10 мл этанола при 80 С, используя Р 6/С в качестве катализатора (10). .Когда поглощение водорода прекратилось, реакционную смесь охладили, профильтровали и выпарили досуха. Затем добавили воду и подщелачили смесь с помощью едкого натра. Продукт затем зкстрагировали до этилацетата, который промыли водой, обезводили с помощь сульфата натрия и выпарили досуха. Остаток представлял собойцелевой продукт в виде основания и его превратили в соль соляной кислоты в этилацетате, использовав безводную соляную кислоту. Выход 0,6 г, т,пл, 101 - 105 С.Н ЯМР: 2,247 (с. 12 Н) 2.2 - 3,7 (м,4 Н) 3,798 (т.1 Н) 4,788 (с,2 Н) 6,8 - 7.2 (м,бН) 7,214 (с,1 Н) 8,715 (с,1 Н),Таким же способом получили следующие соединения:4-3,3-бис(2.3-диметил фен ил) пропил)- 1 Н-имидазолН ЯМР (как основание); 2,097 (с,бН)2,260 (с, 6 Н) 2,3 (м,2 Н) 2,6 (м,2 Н) 4,389 (с,1 Н) 6,0 (с,1 Н) 6,712 (с,1 Н) 7.011 (с,бН) 7,508(м,9 Н) 8,727 (с,1 Н).П р и м е р 11. 1-Бензил-3,3-бис(4-метилфенил)пропен -2-ил 1-1 Н-имидазол.8 сухую пробирку поместили 4,8 г (0,2 моль) йаН (промыли свободно от масла из циклогексана). На него по каплям вылили 100 мл безводного диметилсульфоксида. Реакционный сосуд нагревали при 80 С до прекращения выделения водорода, Полученный раствор метилсульфинилкарбаниона охладили на водно-ледяной бане идобавили к нему 54,1 г 3-(1-бензил-имидазол)-пропилтрифенилфосфобромида в 200 мл1819263 12 диана и вырабатывающей ЙАОРН 30 40 диметилсульфоксида. Реакционную смесь затем перемешивали при комнатной температуре в течение 0,5 ч.и добавили в нее малыми порциями 23 г 4,4-диметилбензофенана. Реакционную смесь перемешивали при комнатной температуре 1 ч и дистиллировали часть диметилсульфоксида. Остаток вылили в воду, которую подщелачивали едким натром, Продукт экстрагировали иэ толуола, промыли водой, обеэводили с помощью сульфата натрия и выпарили досуха. Остаток, который представлял собой сырой продукт в виде основания, превратили в гидрохлорид в этилацетате. Выход 32 г, т.пл. 216-220 ОС,Н ЯМР: 2,289 (с,ЗН) 2,370 (с,ЗН) 3,467 (д.2 Н) 4,764 (с,1 Н) 5,302 (с,2 Н) 6,030 (т,1 Н) 6,8-7;4 (м,9 Н) 8,9 (с,1 Н).Способность соединений по изобретению подавлять выработку ароматазы исследоавли и Ю 1 го по известной методике. Использовали ароматазу человека, Фермент приготовили из плаценты человека, богатой этим Ферментом. С помощью .центрифугирования получили микросомаяьные Фракции (100000 хг осадок); Препарат . испольэовали без дополнительной очистки, Испытываемые соединения добавили вместе с 100000 бра 1,23 Н/-андростен,17 системой. Концентрации испытцваемых соединений были 0,001, 0,01, 0,1 и 1,0 мМ. Инкубирование, проводили при 37 С 40 мин. Введение 1,2/ЗН/-андростен,17-диона привело к восстановлению ЗН 20. Насыщен ные тритием воду и субстрат легко отделяли с помощью миниколонки Зер-Рей, которая адсорбирует стероиды, но щапускеет свободную воду. Радиоактивность определяли с помощью жидкого. сцинтилляционного счетчике. йодавлениевыреботки врометазы оценили вутем сравнения ЗН 20-радиоактивности обработаиных ингибитором образцов с онтральнымиобразцами, которые нв содержали ингибитор. ИК;10, ИК-БО и ИК- это концентрации препарата, которые подавляют активность фермента на10, 50 и 90, соответственно. Эти концентрации представлены в таблице. Испытываемые соединения:1) 4-5-(2,6-диметилфенил)-З-гидрокси 3- (2,6-диметилфенилэтил)пентилН-имидазол,2) 4-З,З-бис(4-хлорфенил)-З-гидроксипродил) 1 Н-имидазол,3) 4-(З,З-дифенил-З-гидроксипропил)1 Н-имида зол,4) 4.(З,З-дифенилпропен-ил)-1 Н-имиДЭЗОЛ,5) 4.(З,З-дифенилпропил)-1 Н-имидазол,5 10 15 20 6) 4-З,З-бис(2-метилфенил)-З-гидроксипропил)-1 Н-имидазол,7) 43,3-бис(4-хлорфенил)-пропен-ил)1 Н-имидазол,8) 4-3,3-бис(2-метилфенил)пропен- ил)-1 Н-имидазол,9) 4-З,З-бис(2-метилфенил)пропил)-1 Н- имидаэол,10) 1-бензил-(З,З-дифенилпропил)-1 Н- имидазол,11) 4-З,З-бис(3-метилфенил)пропил Н-имидазол,12) 4-3,3-бис(З-метилфенил)пропен- ил)-1 Н-имидазол,13) 4-3,3-бис(З-метоксифенил)пропил)- . 1 Н-имидазол,14) 4-З,З-бис(2,3-диметилфенил)пропил)-1 Н-имидаэол,15) 1-бенэил-3,3-бис(З-метоксифенил)пропил)-1 Н-имидазол,16) 1-бенэил-З,З-бис(З-метоксифенил)пропен-ил)-1 Н-имидазол,17) 4-3,3-бис(3;5-диметилфенил)пропил 1-1 Н-имидазол,18) 4-3,3-бис(4-метоксифенил)пропил)- 1 Н-имидазол,19) 4-З,З-бис(З-фторфенил)пропил)-1 Н- имидазол,20) 1-бенэил-(3,3-дифенилпропен- ил)-1 Н-имидаэол. В таблице приведены данные подавления выработки ароматаэы у человека с помощью испытываемых соединений, ИК,ИКи ИКпредставляютсобой концентрации, при которых выработка ферментаподавляется на 10, 50 и,90 соответственно,Суточная доза пре одному пациенту колеблется от 20 до 200 мг,.Токсичность производных имидазолапо изобретение изучали на крысах, В каждой группе бйло по Ь женских особей крыс,которым давали препарат в течение 8дней. Препарат вводили в рот в дозе10 мг/кг/день. Испытывали 4-(3,3-дифенилпропен-ил)-1 Н-имидазол, 4-(З,З-дифен и л и р о и и л)-1 й - и м и д а э о л,4-3,3-бис(2-метилфенил)пропил)-1 Н-имидаэол, 1-бензин-(3,3-дифенилпропил)-1 Нимидаэол и -бенэил-(З,З-дифенилпропен 2-ил)-1 Н-имидазол. Животных наблюдалиежедневно. Их взвесили до и после периодавведения препаратов. Органы подвергалимакроскопическому исследованию привскрытии. Печень, матку и яичники взвесили. Никаких повреждений не было. Вес вовсех группах был нормальный. В тех группах, где животные получали 4-(3,3-дифенил-пропен-ил)-1 Н-имидазоли1819263 15 16 р -сн,ню3 где Вз имеет указанные значения; 10 значения. Составитель Г. АндионТехред М.Моргентал едактор орре, Шулла Заказ 1949 Тираж Подписное ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СС 113035, Москва, Ж, Раушская наб 4/5 Производственно-издательский комбинат "Патент", г. Ужгород, ул,Гагарина, 101 где й, 81, 82, В з, й 2, Х и У имеют указанные/значения, который гидрируют для получения соединения где й, 81, 82, В 1, В 2, Х и У имеют указанные значения; и необязательно, когда В, является Н, вводят этот продукт в реакцию с сильным основанием, а затем с бенэилгалоидом формулы На - галоид, и получают соединениеформулы
СмотретьЗаявка
4356681, 07.10.1988
Орион-Ихтюмя Ой
АРТО ЙОХАННЕС КАРЬЯЛАЙНЕН, ЛАУРИ ВЕЙККО МАТТИ КАНГАС, КАУКО ОЙВА АНТЕРО КУРКЕЛА
МПК / Метки
МПК: C07D 233/64
Метки: аддитивных, замещенных, имидазолов, нетоксичных, приемлемых, солей, фармацевтически
Опубликовано: 30.05.1993
Код ссылки
<a href="https://patents.su/8-1819263-sposob-polucheniya-zameshhennykh-imidazolov-ili-ikh-netoksichnykh-farmacevticheski-priemlemykh-additivnykh-solejj.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения замещенных имидазолов или их нетоксичных фармацевтически приемлемых аддитивных солей</a>
Предыдущий патент: Способ получения производных дихлоранилина или их физиологически приемлемых солей, или их сольватов
Следующий патент: Способ получения 2, 4-диамино-5-(замещенных) пиримидинов
Случайный патент: Ный конденсатор переменной емкости