Способ получения эрголин-8-илалкилэфиров, -тиоэфиров и амидов простановых кислот
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 741794
Автор: Роланд
Текст
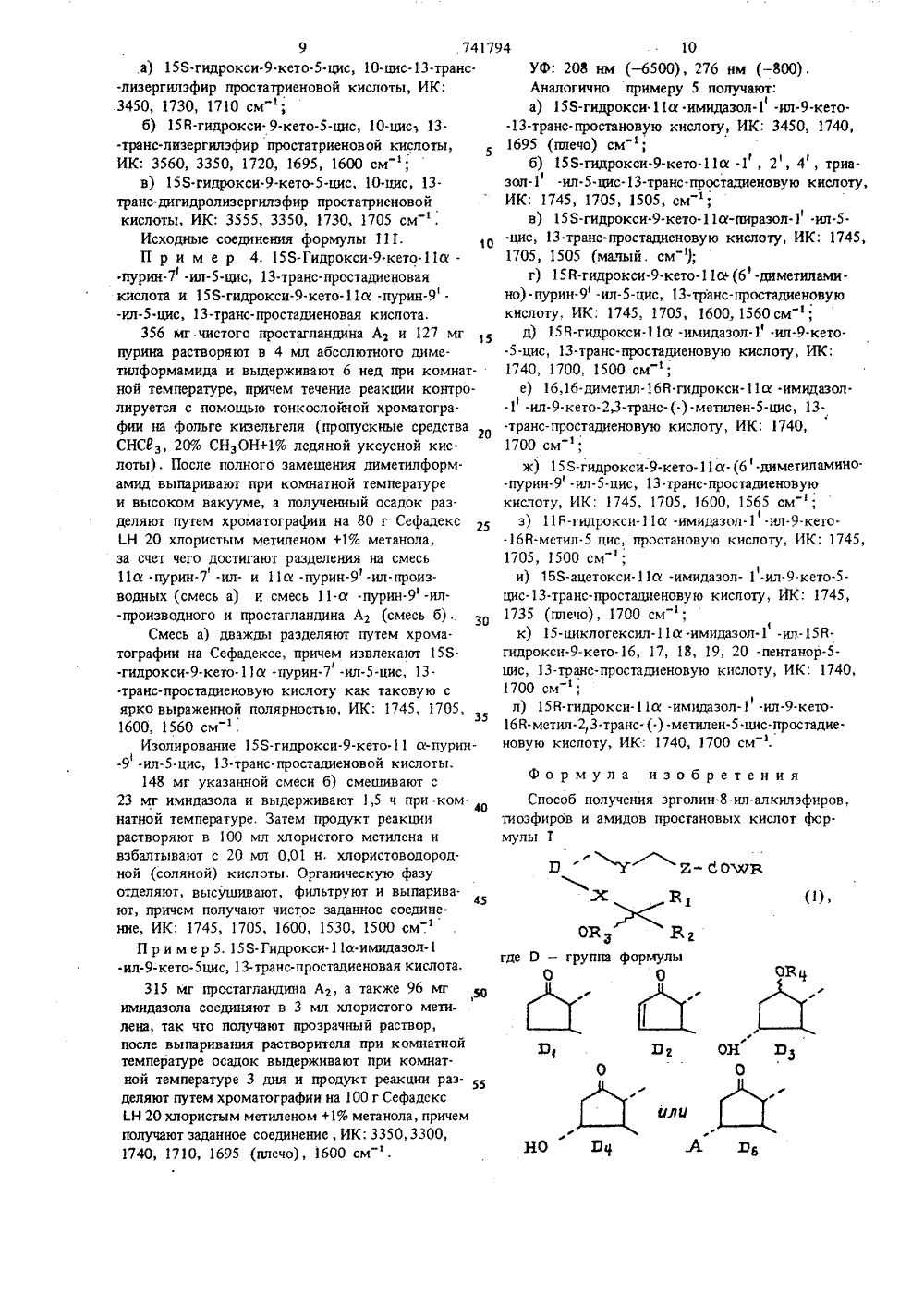
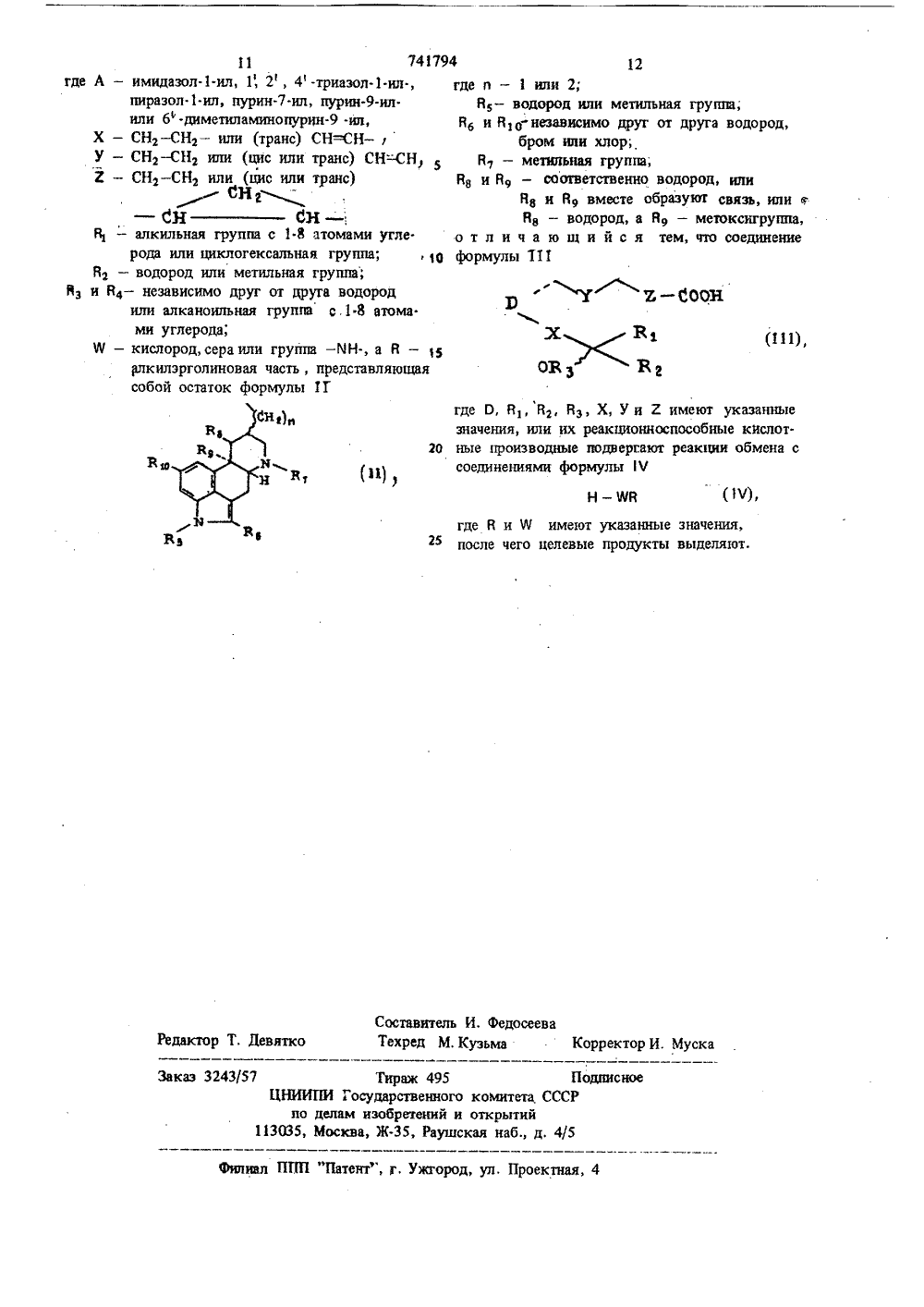
,06,80. та опубликования описа 5.06.80(Швейцария) Иностранная фирма андос АГ, Швейцария) 1) Заявите(54) СПОСОБ ПОЛУЧЕНИ ЭФИРОВ, ТИОЭФ 1 гРОВ И РГОЛИЕ-8-ИЛ-АЛКИЛДОВ ПРОСТАНОВЫХ КИСЛ де А - имид 1-ил, 1,л.ил,тение относится к способу получения оизводных простановых кислот, в част пособу получения эрголин.ил.алкилиоэфиров или амидов простановых щей формулы 1 ол-ил,пурин 1-диметиламин или 5У - СНг - 2 - СЕ.1 г -Нг Нг или (транс и (цис или и (цис илю СИ 01 Вт),Сс 1-8 атомами утлксильная группа;ная группа;от друга водородгруппа с 1-8 атома ильная группа рода или циклогеВг - водород или метильи В - независимо другили алканоильнаями углерода;Ю - кислород, сера илВ - ,алкйлэрголиляюшая собои ост где О - груп Оппа -ЕчН-, а часть, представ ормулы 11 овал О НО в Гасударственна 1 й номнт СССР па делам нзобрвтенн н откритнйИэобре новых пр ности к эфиров,кислот об ф5 74179макологические подобные простагландину свой.ства, чем соответствующие простановые кислоты. Они, в частности, способствуют понижениюартериального давления крови.Кроме того, эрголин.8-ил-алкиловые эфиры,тиоэфиры и амиды простановых кислот, в частности, где О - Оь, задерживают развитие тром.боцитопенни.Соединения формулы П 1 а также способствуют понижению артериального давления крови изадерживают развитие тромбоцитопении в указанных для эфиров, тиоэфиров и амидов дозах.П р и м е р 1. 11 а. 15 З-Дигидрокси.9.-кето-транс-дигидроизолизергиламид простановой кислоты. 15Раствор 150 мг чистого простагландина Е,добавляют в 4 мл абсолютного диметилформамида с 76 мг карбонилдиимидазола и помешиваютв атмосфере азота при комнатной температуре3,5 ч. Затем туда добавляют 130 мг мелкопорошкового дигидроизолизергиламина. После 7дней перемешивания при комнатной температурерастворитель выпаривается при комнатной температуре и высоком вакууме и маслянистыйосадок хроматографируется на 250 г сефадекс 21.Н 20 (ЯерЬадех 1 Н 20) с хлористым метиленом при добавлении 1% метанола, причем полу.чают требуемое соединение.ИК: 1740, 1660, 1520 см ,Свободное основание реакцией замещения Зрс метансульфоновой кислотой переводится всульфонат метана. Получение эфиров формулы 1.Аналогично примеру 1 и при применении ЗБ соответствующих простагландинов формулы 111 и соединений формулы Я, где й - , кислород, которые добавляются вместе со свежеприготовленным каталитическим количеством раствора имидазол-натрий в тетрагидрофуран, 4 О получают следующие эфиры формулы 1:а) 9 а, 11 а, 155-тригидрокси-цис, 13-транслизергилэфирпростадиеновой кислоты, т. пл. гидротартрата 117-120 С;б) 11 а, 153-дипщрокси.кето.транс лизергилэфир простановой кислоты, т. пл. гидротартрата 158-160 С;в) дигидролизергилэфир 11 а, 158-дигидро- -9-кето-транс- (2, 13 -дибромо) простановой кислоты, ИК: 1740 см(широкий);г) лизергилэфир 11 а. Т 55-дигидрокси- -9-кето-цис, 13.транс" простадиеновойкисло. ты, ИК: 1740 см(широкий);д) 11 а, 153-дигидрокси.кето 13.транс- (1 -метил) лизергиловый эфир простановой кислоты, ИК: 1740, 1735 (плечо/см );е) 11 а, 158-дигидрокси-кето-траис-(10 а -метокси) дигидролизергилэфир простановой кислоты, ИК: 1740 см(широкий); 4 6ж) 11 й, 153-дигидрокси.кето.транс.2.-хлоро.б -метилэрголинР-ил-этиловый эфирпростановой кислоты, ИК: 1740, 1735 см ;з) 11 а, 153-дигидрокси.9-кето-метил.2,3. -транс- (.) . метилен-транс-лизергилэфир проста. новой кислоты, ИК: 1740, 1930 см ;и) 11 а, 155-дигидрокси-кето.15-метил. -цис, 13-транс, лизергилэфир простадиеновой кислоты, ИК: .1745, 1735 (плечо) см ;к) 11 а, 158-дигидрокси.9-кето-лизергилэфир простановой кислоты, ИК: 1740 (широкий) см ;л) 11 й, 15 В-дигидрокси-кетоВ-метил- .5-цис-лизергилзфир простановой кислоты, ИК:1740, 1735 (плечо) см ;м) 11 а, 15 В-дигидрокси.9-кетоВ-метил.2,3. -транс- (+) .менжен.цис-лизергилэфир простановой кислоты, ИК: 1740, 1735 (плечо) см ;н) 15-циклогексил.11 а, 15 В-дигидрокси- -кето,17,18,19,20- пентанор-цис-лизергилэфир простановой кислоты, ИК: 1740 (широкий) см ;о) 11 а, 15 В-дигидрокси.9.кето.16 В.метил,3- -транс- (.) -метилен-цис-лизергиловый эфир простановой кислоты, ИК: 1740, 1735 (плечо)смАналогично примеру 1 и при применении простагландинов формулы 111, где О - О 2, или соответствующих простагландинов формулы 111, где О - Оь, и соответствующих соединений формулы 1 Ч, где Я - кислород, вместе с каталитическим количеством раствора имидазол-натрий в тетрагидрофуране:аа) 15 Я-гидроксиа.имидаэол.ил-кето. -5-цис, 13-транс-лизергилэфир простадиеновой кислоты, ИК:3450, 1740,1730 см ;аб) 15 В- гидроксиа -имидазол- ил-кето- -5-цис, 13-транс-лизергилэфир простадиеновой кислоты, ИК: 3550, 3450, 1745-1740 смав) 155-гидроксий-имидазол-ил-кето. .13-транс-лизергилэфир простановой кислоты, т. пл, нщротартрата 104-106 С;аг) 153-гидрокси.11 а -имидазол-ил-кето -5-цис.,13-транс-дигидроизолизергилэфир простадиеновой кислоты, ИК 3450, 1740, 1720, 1500 см ;ад) 158-гидроксий -имидазол.ил.кето- .5-цис, 13-транс(2, 13-дибромо)-дигидролизер. гилэфир простадиеновой кислоты, ИК: 3450, 1740, 1715, 1500 см ;ае) 158-гидрокси-кетоа - 1, 2, 4 -три.азол-ил-цис, 13.транс-лизергилэфир проста.диеновой кислоты, ИК: 1740, 1720 см ;аж) 15 В гидроксиа имидазол-ил.9-кето 168-метил-цис-лизергилэфир простановой кислоты, ИК: 1740, 1720, 1500 см ;аз) 155-гидроксиа -имидазол-ил-кето. .5-цис, 13-транс- (1-метил) -лиэергилэфир простадиеновой кислоты, ИК: 1740, 1725 см ;аи) 15-циклогексилЯ-гилроксиа имидазол-ил-кето, 17, 18, 19, 20.пентанор-16 Я.метил,3.транс. (.) -метилен-цис-лизергилэфир простановой кислоты, ИК: 1740, 1720 см ;ал) 158.гидроксиа -имидазол .ил.9.кето.13-транс. (2, 13-дибромо) -дигидролизергилэфирпростановой кислоты, ИК: 1740, 1715, 1500 см ;ам) 15 Я-гидроксиа имидазол-ил-кето-цис; 13-транс.дигидроизолизергилэфир простадиеновой кислоты, ИК: 3450, 1740, 1720,1500 см ,Получение тиоэфиров формулы 1.Аналогично примеру 1, но при применении 1соответсщующих простагландинов и пригодныхтиолов формулы 1 Ч вместе с каталитическимколичеством раствора имидазол-натрий в тетрагидрофуране получают следующие соединенияформулы 1:20ба) 11 а, 158.дигидрокси-кето.13-транс-лиэергилтиоэфир простановой кислоты, ИК; 1740,1695 см";бб) 158-гидроксиа -имидазол-ил-кето 1.5-цис.транс-лизергилтиоэфир простадиеновойкислоты (исходя из простагландина Аз), ИК:1740, 1700 см ,Получение амидов формулы 1.Аналогично примеру 1, однако, при применении пригодных простагландинов и пригодныхаминов формулы 1 У получают следующие соединения формулы 1:ва) 11 а, 158-дигидрокси-кето-транс-лизергиламид простановой кислоты, ИК:.При применении описанного в примере 1 спо.соба получают следующие эфиры, тиоэфиры иамиды формулы 1, где часть Я означает лизергил,дигидролизергил, изолизергил, дигидроизолиэергил, 2-бромлизергил, 13-бромдитидролизергил,13-дибромгидролизергил, 10 й . метоксидигидролизергил, 10 а метоксидигидроизолизергил, 2,13-диброма -метоксидигидролизергил, 2- или13.бром.10 й -метоксидигидролизергил, а частьпростановой кислоты имеет следующие значения: 16,16-диметил ПГЕ, 16,16-диметил ПГФ,15-метил ПГЕз, 15-метил ПГФз , 16 Я и 8-метил,14-дигидро ПГЕз , 11-дезокси-ПГЕэ, их15-эпи-изомер, а также их 5,6.дигидро- и5, 6, 13, 14-тетрагидропроизводное; ПГЕэ, его15-эпи-изомер, а также его 5,6-дигидро- и5, 6, 13, 14-дигидропроизводное, ПГфа, его15-эпиизомер, а также его 13, 14-дигидрбпроизводное.П р и м е р 2. 158-Гидрокси-кетоцис,10-цис, 13-транс-лизергиламид простатриеновойкислоты:а) 159 мг простагландина Аз и 167 мг 2,2 дитиодипиридина и 199 мг трифенилфосфинав 5 мл ксилола перемешивают при 20 С 24 ч.После выпаривания растворителя осадок разделяют путем хроматографии на 100 г Сефа.декс 1 Н 20 с хлористым метиленом +2% метанола, причем получают 2-тиопиридилэфир простагландина Аз,б) 131 мг простагландина Аэ -2.тиопиридил.эфира при 20 С перемешивают 24 ч с 93 мглизергиламина в 5 мл тетрагидрофурана. Реакционную смесь разделяют путем хроматографиина 100 г Сефадекс Н 20 с хлористым метиленом +0,5% метанола, причем получают требуемое соединение, ИК: 3450, 1730, 1710 см .Аналогично примеру 2 получают:а) 158-гидрокси-кето-цис, 13-транс-дигидролизергиламид простадиеновой кислоты,ИК: 3450, 1705, 1665, 1520 см ;б) 15 Я-гидрокси-кето.16 Я- метил,3-транс:(-) .метилен,10-цис.лизергиламид простадиеновой кислоты, ИК: 3450, 1700, 1665,1520 см,а также соединения согласно примерам 1 и 1 ва-транс-лизергилэфир простатриеновой кислоты,ИК: 3560, 3350, 1720, 1695, 1600 см ;в) 158-гидрокси.кето.5-цис, 10-цис, 13 транс-дигидролизергилэфир простатриеновойкислоты, ИК: 3555, 3350, 1730, 1705 см ,Исходные соединения формулы 111.10П р и м е р 4. 158-Гидрокси.кетойпурин.ил-цис, 13-транс-простадиеноваякислота и 158-гидрокси-кетой -пурин-илцис, 13-транс-простадиеновая кислота.356 мг чистого простагландина Аз и 127 мгпурина растворяют в 4 мл абсолютного диметилформамида и выдерживают 6 нед при комнатной температуре, причем течение реакции контролируется с помощью тонкослойной хроматогра.фии на фольге кизельгеля (пропускные средстваСНС 0 з, 20% СНзОН+1% ледяной уксусной кислоты). После полного замещения диметилформамид выпаривают при комнатной температуреи высоком вакууме, а полученный осадок разделяют путем хроматографии на 80 г Сефадекс1 Н 20 хлористым метиленом +1% метанола,за счет чего достигают разделения на смесь11 й пурин-ил- и 11 й .пурин-ил-производных (смесь а) и смесь 11-й -пурин-ил производного и простагландина А 2 (смесь б).Смесь а) дважды разделяют путем хроматографии на Сефадексе, причем извлекают 158-гидрокси-кетой -пурин-ил-цис, 13.транс-простадиеновую кислоту как таковую сярко выраженной полярностью, ИК: 1745, 1705,1600, 1560 см .Изолирование 158-гидрокси-кетои-пурин-ил-цис, 13-транс.простадиеновой кислоты.148 мг указанной смеси б) смешивают с23 мг имндазола и выдерживают 1,5 ч при ком.натной температуре. Затем продукт реакциирастворяют в 100 мл хлористого метилена ивзбалтывают с 20 мл 0,01 н хлористоводородной (соляной) кислоты, Органическую фазуотделяют, высушивают, фильтруют и выпарива.45ют, причем получают чистое заданное соединение, ИК: 1745, 1705, 1600, 1530, 1500 см.П р и м е р 5. 158- Гидроксиа.имидаэолил-кетоцис, 13-транс-простадиеновая кислота,315 мг простагландина А 2, а также 96 мг3имидазола соединяют в 3 мл хлористого метилена, так что получают прозрачный раствор,после выпаривания растворителя при комнатнойтемпературе осадок выдерживают при комнатной температуре 3 дня и продукт реакции разделяют путем хроматографии на 100 г Сефадекс1 Н 20 хлористым метиленом +1% метанола, причемполучают заданное соединение, ИК; 3350, 3300,1740, 1710, 1695 (плечо), 1600 см ,94 10Уф: 208 нм ( - 6500), 276 нм ( - 800).Аналогично примеру 5 получают:а) 158-гидрокси.11 й имидазол-ил.9-кето- .13-транс-простановую кислоту, ИК: 3450, 1740, 1695 (плечо) см ;б) 158-гидрокси-кетой .1, 2, 4, триа 11зол-ил.цис-транс-простадиеновую кислоту, ИК: 1745, 1705, 1505, см ;в) 158-гидрокси-кетой-пираэол.1 ил.5-.цис, 13-транс.простадиеновую кислоту, ИК: 1745,1705, 1505 (малый, см );г) 158-гидрокси.9.кетой (6 -диметиламино) -пурин-ил-цис, 13-транс-простадиеновую кислоту, ИК: 1745, 1705, 1600, 1560 ем ;д) 15 В-гидрокси.11 й -имидазол.илкето- -5-цис, 13-транс-простадиеновую кислоту, ИК: 1740, 1700, 1500 см";е) 16,16-диметил.гидроксий -имидазол- -1 -ил.9.кето,3.транс-(.) .метилен-цис, 13..транс-простадиеновую кислоту, ИК: 1740,1700 см ;ж) 158.гндрокси.9-кетой- (6.диметиламино. -пурин.9 .ил-цис, 13-транс-простадиеновую кислоту, ИК: 1745, 1705, 1600, 1565 см ;з) 118-гидроксий -имидазол.1 .ил-кетобй-метил 5 цнс, простановую кислоту, ИК: 1745, 1705, 1500 см ;и) 158-ацетоксий -имидазол -ил.9.кето- цис 13.транс-простадиеновую кислоту, ИК: 1745, 1735 (плечо), 1700 см ;к) 15-циклогексилй -имидазол-ил,-15 Я- гидрокси.9-кето, 17, 18, 19, 20 -пентанор- цнс, 13-транс-простадиеновую кислоту, ИК: 1740, 1700 см ;л) 158-гидроксий -имидазол-ил.9-кето 168-метил.2,3 транс ( ) -метилен.цис-простадие новую кислоту, ИК: 1740, 1700 см . Формула изобретения Способ получения эрголин.8-ил-алкилэфиров, тиоэфиров и амидов простановых кислот формулы 1 3 Э У Е- б 041 ЯВг ОВ 3 Вг где О - группа формулы0 О11 741794 12где А - имидазол-ил, 1, 2, 4-триазол.1.ил., где о - 1 или 2;пиразол 1-ил, пурин.7.ил, пурин-ил. Я, - водород или метильная группа;или 6" -диметиламинопурин-ил, Вб и В 1 О независимо Друг от друга воДороД,Х - СНз - СНз - или (транс) СН=.Н -бром ипи хлор;У - СНз-СНз или (цис или транс) СН-СН, 5 В 7 - метнпьная группа;2 - СНт - СНз или (цис или транс) йа и В - соответственно водород илиСн, йа и В 9 вместе образуют связь, или 4- Сн СН - ., Вв - водород, а В 9 - метоксигруппа,Я, - алкильная группа с 1.8 атомами угле. о т л и ч а ю щ и й с я тем, что соединениерода вли циклогексальная группа;,1 о формулы 111Яз - водород или метильная груши;Нз и В 4 - независимо друг от друга водородили алканоильная группа с,1 8 атома.ми углерода, (111)Ф - кислород, сера или группа - М Н-, а й - 15алкилэрголиновая часть, представляющаясобой остаток формулы 1 Г Рт ъ - ооон.Я ов, в,где О, Я йз, Вз, Х, У и 2 имеют указанные значения, или их реакционноспособные кислот.20 ные производные подвергают реакции обмена ссоединениями формулы 1 Ч где В и й имеют указанные значения, после чего целевые продукты выделяют Составитель И. Федосеевадактор Т. Девятко Техред М. Кузьма Корректор И. Муска О 57 Тираж 495 П ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж, Раушская наб., д, 4/5
СмотретьЗаявка
2457126, 03.03.1977
Заявитель К ПАТЕНТУ
РОЛАНД ВЕНГЕР
МПК / Метки
МПК: A61K 31/5575, C07C 405/00, C07D 457/02
Метки: амидов, кислот, простановых, тиоэфиров, эрголин-8-илалкилэфиров
Опубликовано: 15.06.1980
Код ссылки
<a href="https://patents.su/6-741794-sposob-polucheniya-ehrgolin-8-ilalkilehfirov-tioehfirov-i-amidov-prostanovykh-kislot.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения эрголин-8-илалкилэфиров, -тиоэфиров и амидов простановых кислот</a>
Предыдущий патент: Способ получения эргопептидалкалоидов или их солей
Следующий патент: Способ получения спирогидантоиновых соединений или их солей
Случайный патент: Устройство для защиты от перенапряжений