Способ получения этилового эфира 6, 7-дифтор-1, 4-дигидро-4 оксо-3-хинолинкарбоновой кислоты
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
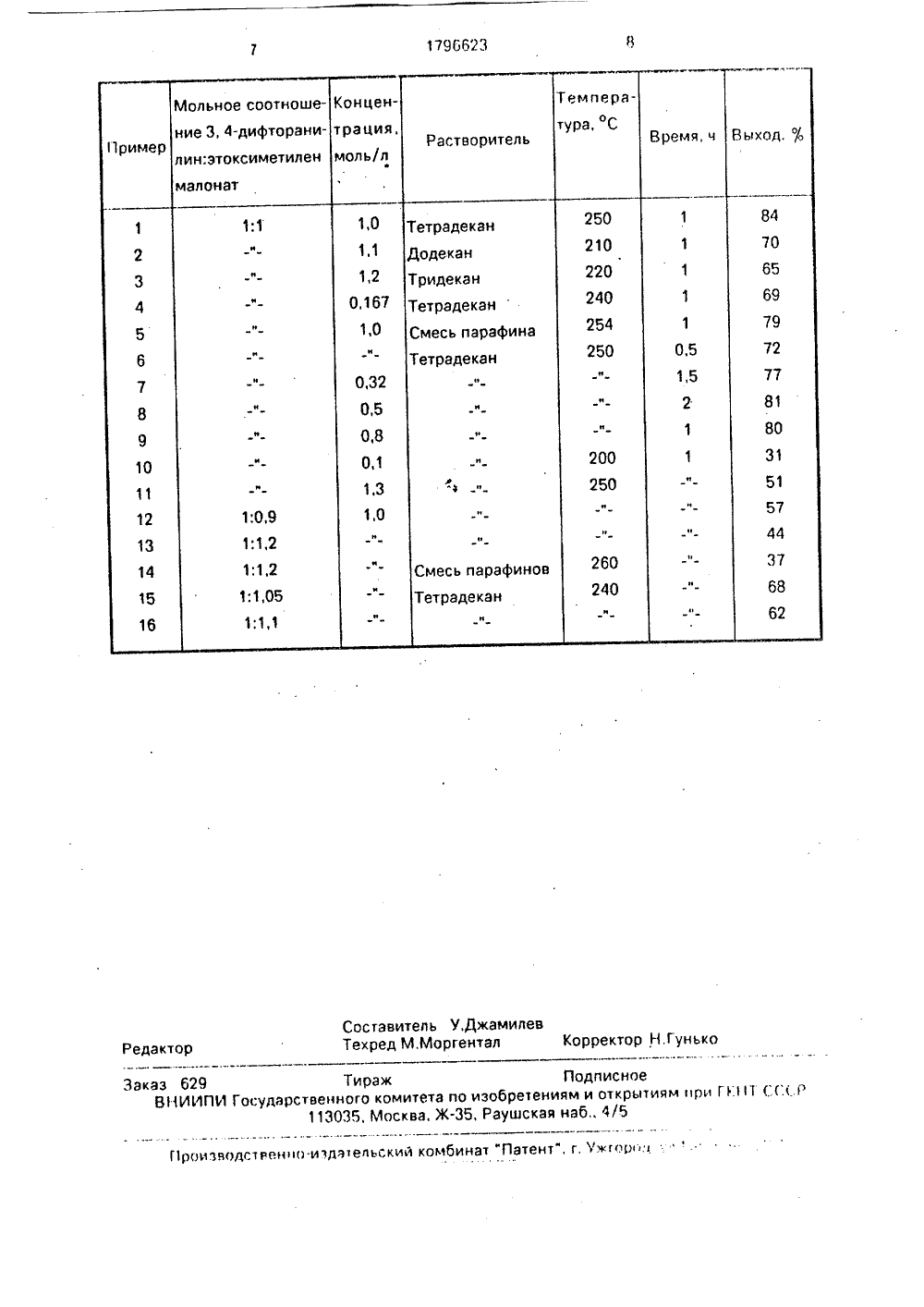
(71) Институт химии Башкирскогцентра Уральского отделения АНститут органической химии им. Нского и Уральский политехинститут им. С.М,Кирова(56) Европейский патент М 000кл, С 07 0 215/233, 1980.Европейский патент М 2кл. С 07 О 215/233, 1981. научного ССР, ИнД,Зелин- ический в, Г.А.Толн, С.М.Наултанов.,0203 50053,Изобретение относится к органической имии, конкретно к способу получения этилового эфира 6,7-дифто р,4-дигидро-оксо-хинолинкарбоновой кислоты, который находит широкое применение в качестве полупродукта в синтезе клинически важных и высокоэффективных антибактериальных препаратов - производных фторированных хинолонов (норфлоксацина, перфлоксацина,.ципрофлоксацина,дифлоксацина и др.). По биологической активности и спектру антибактериального действия производные этого класса антибиотиков превосходят широко применяемые в настоящее время химиотерапевтические средства, в том числе существующие пероральные антибиотики и цефалоспорины третьего поколения.Известен двухстадийный способ поля этилового эфира 6 7-дифтор,4-дих Недо 1. Двухные с эти обусловлен и очистки и трование,о ра 3,4-диф кислоты,учени ОСУДЛРСТВЕННОЕ ПАТЕВЕДОМСТВО СССРГОСПАТЕНТ СССР)(54) СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО ЭФИРА 6,7-ДИФТОР,4-ДИГИДР 0-4-ОКСО-ХИНОЛИНКАРБОНОВОЙ КИСЛОТЫ (57) Использование; в качестве полупродукта в синтезе антибактериальных препаратов. Сущность изобретения: продукт - этиловый эфир 6,7-дифтор,4-дигидро- оксо-хинолинкарбоновой кислоты. т,пл.305-306 ЯС, БФ С 12 Н 9 МГгОз. Реагент 1; 3,4- дифторанилин. Реагент П: этоксиметиленмалонат при мольном соотношении, равном соответственно 1:(1-1,1) в среде насыщенных алканов С 2-С 1 в или их смеси при концентрациях исходных веществ 0,167-1,2 моль/л, температуре конденсации 210- 254 С, Выход 84%. 1 табл. гидро-оксо-хинолинкарбоновой кислоты, На первой стадии конденсацией 3,4- дифторанилина с этоксиметиленмалонатом синтезируют диэтиловый эфир 3,4-дифторанилинометиленмалоновой кислоты, затем внутримолекулярной циклизацией в растворе даутерма А (дифенилоксид) при 240-250 в течение 1 ч получают этиловый эфир 6,7- дифтор,4-дигидро-оксо-З-хинолин карб оновой кислоты. атками этого способа являются; стадийность процесса и связанм технологические трудности, ные необходимостью выделения ромежуточных продуктов (филь- чистка, сушка) диэтилового эфиторанилинометилен мал оновойментов, свввеннев с тем, что о он высокой во 2. Плохая воспроизводимость методасинтеза целевого продукта, связанная стем, что при высоких температурах диэтиловый эфир 3,4-дифторанилинометиленмалоновойкислоты взаимодействует сдифенилом или дифениловым эфиром, которые являются составляющими компонента. ми даутерма А, давая соответствующиепродукты конденсации, что и приводит кзначительному снижению выхода целевогопродукта;3. Укаэанные примеси затрудняют выделение целевого продукта, снижают его чистоту, что требует дополнительной очисткиэтилового эфира 6,7-дифтор,4-дигидрооксо-хинолинкарбоновой кислоты путемперекристаллизации иэ диметилформамида,4. Относительно низкий общий выход накаждой стадии синтеза целевого продукта60 р,5, Необходимость предварительнойректификации даутерма А. так как при длительном хранении в нем образуютея побочные вещества, наличие которых приводит кснижению выхода целевого продукта.6. Достаточно высокая токсичность иканцерогенность даутерма А по сравнениюс насыщенными углеводородами - парафинами.Известен двухстадийный принятый запрототип) способ получения этилового эфира 6,7-дифтор,4-дигидро-оксо-З-хинолинкарбоновой кислоты путемвзаимодействия 3,4-дифторанилина с этоксиметиленмалонатом при 120-140 С с последующим нагреванием полученныхпродуктов при 250 С в среде дифениловогоэфира в течение 50 мин, Выход целевого.продукта в этих условиях составляет 25 врасчете на 3,4-дифторанилин. ннт стньо совете 5К недостаткам этого процесса относятся:1, Низкий выход целевого продукта25;р,2, Плохая воспроизводимость экспери 3 Я со 2 2 5г .,й С 02 С 28Ч 1 - +. И1 СО,С 2 Н 5 Г 241Б температуре реакции исходное дифторанилиновое производное взаимодействует сдифениловым эфиром с образованием соответствующих продуктов конденсации.5 3, Необходимость применения избыткаэтоксиметиленмалоната (в 1,2 раза больше,чем 3,4-дифторанилина), что приводит к образованию высших олигомеров,4. Высшие олигомеры этоксиметилен 10 малоната и полиэтоксиметиленмалонат затрудняют выделение целевого продукта,снижают его чистоту, что вызывает необходимость дополнительной очистки последнего путем перекристаллизации из15 диметилформамида,5. Необходимость предварительнойочистки дифенилового эфира, так как образующиеся в нем при хранении примеси приводят к снижению выхода целевого20 продукта.6, Относительно высокая токсичность иканцерогенность дифенилового эфира посравнению с насыщенными углеводорода-ми - парафинами.257. Дифениловый эфир имееттемпературуплавления 26,9 С, что вызывает техниче- .ские трудности при его очистке путемректификации и использование в качестверастворителя в процессе синтеза целевых30 продуктов.8. Двухстадийность метода,Целью изобретения является повышениевыхода целевогопродукта, его чистоты, а также создание более экологически безопасного35 и технологичного процесса получения 6,7 дифтор,4-дигидро-оксо-З-хин олин ка рбоновой кислоты - ключевого синтона в синтезе антибиотика перфлоксацина,Поставленная цель достигается предла 40 гаемым способом синтеза этилового эфира6,7-дифтор,4-дигидро-оксо-З-хинолин карбоновой кислоты, заключающийся в том,что получение целевого продукта осуществляют путем взаимодействия 3,4-дифторани 45 лина с этоксиметиленмалонатом примольном соотношении, равном соответственно Ц 1-.1, 1) в среде насыщенных алканов(С 12-С 1 в) или их смеси при концентрацияхисходных веществ 0,167-1,2 моль/л и тем 50 пературе конденсации 210-254 С. Выходцелевого продукта в этих условиях достигае"г 84 оДОтличительной особенностью предла-,гаемого изобретения является применение55 насыщенных алканов в качестве раствори-.теля и проведение процесса при концентрациях 3,4-дифторанилина 0,167-1,2 моль/л,Этот факт не является очевидным, таккак не известно будет ли происходить обравание этилового эфира 6,7-дн Фтор,4-ди1796623 10 15 гидро-оксо-хинолинкарбоновой кислоты всреде насыщенных алканов, В данномслучае нельзя исключить возможность протекания процесса электрофильного замещения в ароматическом кольце анилинв сучастием молекулы углеводорода.Считается, что дифениловый эфир наиболее оптимальная среда для синтеза хинолинов по данной схеме.Наилучшие результаты по синтезу этилового эфира 6,7-дифтор,4-дигидро-оксо-хинолинкарбоновой кислоты полученыпри 210 - 254 С и концентрациях 3,4-дифторанилина 0,167 - 1,2 моль/л. При других значениях указанных физико-химическиххарактеристик и условии проведения процесса выход целевого продукта падает(примеры 10 - 14),К достоинствам предлагаемого методаотносятся:1. Высокий выход целевого продукта( 84%).2. Одностадийность метода.3. Возможность многократного применения исходного растворителя без дополнительной его очистки,4. Высокая чистота целевого продукта -этилового эфира 6,7-дифтор,4-дигидрооксо-хинолинкарбоновой кислоты, позволяющая использовать его в дальнейшихпревращениях без предварительной перекристаллизации.5. Низкий расход этоксиметиленмалоната по сравнению с прототипом (например, в прототипе этоксиметиленмалонат и3,4-дифторанилин берутся при мольном соотношении, равном 1,2:1, а в наших услови. ях 1-,(1,1:1) соответственно).6. Применение в качестве растворителядоступных и устойчивых насыщенных ациклических углеводородов, промышленноепроизводство которых налажено в нашейстране.7. Используемые в предлагаемом способе насыщенные углеводороды по сравнению с дифениловым эфиром или дифенилом Формула изобретения Способ получения этилового эфира 6,7- дифтор,4-дигидро-оксо-З-хинолинкарбоновой кислоты путем взаимодействия 3,4- дифторанилина с этоксиметиленмалонатом в среде растворителя при повышенной температуре,отл ича ю щийс ятем,что,с 20 25 30 35 40 45 обладают значительно меньшей токсичностью и практически безвредны для человекаи окружающей среды. 8. В результате применения парафинов в качестве растворителя удалось полностью избежать образования побочных продуктов.9, Насыщенные углеводороды (С 12-С и) и их смеси имеют низкую температуру плавления в обычных условиях жидкости и поэтому технологичны в работе, 10. Возможность выбора в предлагаемом изобретении растворителя с определенной температурой кипения облегчаетсоблюдение температурного режима процесса. Способ поясняется следующими примерами,П р и м е р 1. В круглодонную колбу, снабженную воздушным холодильником, загружают 12,91 г(0,1 моль) 3,4-дифторанилина и 21,6 г (0,1 моль) этоксиметиленмалоната в 100 мл тетрадекана и нагревали реакционную массу при 250 С в течение 1 ч, Колбу охладили до комнатной температуры, выпавшие кристаллы этилового эфира 6,7-дифтор,4-дигидро-оксо-хинолинкарбоновой кислоты отфильтровали и промыли на фильтре хлористым метиленом или хлороформом, Выделяют 21,25 г этилового эфира 6,7-дифтор,4-ди гидро-оксо-З-хинолин карбоновой кислоты. Вихор 84%, Т.пл. 305- 306 С. ИК-спектр (ю, см ): 820, 1100, 1195, 1300, 1395, 1505,.1625, 1695, 2800-3030, 3045-3300, Спектры ПМР (д, м,д.)Ж 1,52 т (ЗН, СНз,) = 7 Гц); 2,15 с (1 Н, К-Н), 4,64 кв (2 Н, СН 2, ) =.7 Гц); 8,03-8,60 м (2 Н, С Н); 9,47 с (1 Н, =СН). Найдено, %: С 57,20; 56,97; Н 3,47; 3,45; И 5,39, 5,38. Вычислено, %: С 56,92; Н 3,58; Й 5,53, С 12 Н 9 КР 20 з,Примеры 2 - 16 приведены в таблице.Чистота целевого продукта контролировалась определением температуры плавления и элементного анализа по азоту. целью повышения выхода целевого продукта и улучшения технологии процесса, последний ведут в среде насыщенных алканов С 12-С 18 или их смеси при молярном соотношении реагентов 3,4-дифторанилин:этоксиметиленмалонат, равном 1:1 - 1,1, температуре 210-254 С и концентрации исходных веществ 0,167-1,2 моль/л.1796623 Составитель У.ДжамилевРедактор Техред М.Моргентал Корректор Н.Гунь одстяенно издательский комбинат Патен мс г о р : ю Заказ б 29ВНИИП Тираж:ударственного комитета по изоб 113035, Москва, Ж, Рау
СмотретьЗаявка
4925258, 11.03.1991
ИНСТИТУТ ХИМИИ БАШКИРСКОГО НАУЧНОГО ЦЕНТРА УРАЛЬСКОГО ОТДЕЛЕНИЯ АН СССР, ИНСТИТУТ ОРГАНИЧЕСКОЙ ХИМИИ ИМ. Н. Д. ЗЕЛИНСКОГО, УРАЛЬСКИЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ ИМ. С. М. КИРОВА
ДЖЕМИЛЕВ УСЕЙН МЕМЕТОВИЧ, НЕФЕДОВ ОЛЕГ МАТВЕЕВИЧ, ТОЛСТИКОВ ГЕНРИХ АЛЕКСАНДРОВИЧ, ЧУПАХИН ОЛЕГ НИКОЛАЕВИЧ, ЧАРУШИН ВАЛЕРИЙ НИКОЛАЕВИЧ, НАВАШИН СЕРГЕЙ МИХАЙЛОВИЧ, ДОКИЧЕВ ВЛАДИМИР АНАТОЛЬЕВИЧ, СУЛТАНОВ САБИТ ЗИГАТОВИЧ, ГРУЗДЕВ ВИТАЛИЙ АЛЕКСАНДРОВИЧ, ЗВЕРЕВ ВАЛЕРИЙ НИКОЛАЕВИЧ
МПК / Метки
МПК: C07D 215/233
Метки: 4-дигидро-4, 7-дифтор-1, кислоты, оксо-3-хинолинкарбоновой, этилового, эфира
Опубликовано: 23.02.1993
Код ссылки
<a href="https://patents.su/4-1796623-sposob-polucheniya-ehtilovogo-ehfira-6-7-diftor-1-4-digidro-4-okso-3-khinolinkarbonovojj-kisloty.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения этилового эфира 6, 7-дифтор-1, 4-дигидро-4 оксо-3-хинолинкарбоновой кислоты</a>
Предыдущий патент: Способ получения 3-бромпиридина
Следующий патент: 3-амино-4-арил-2-(2-метоксифенил)-7-нитро-1(2н)изохинолоны, обладающие аналептическим действием
Случайный патент: Устройство для измерения нелинейности закона модуляции частоты сигналов