1, 2, 4-триазоло4, 3-c-10, 10-диметил-8, 10-дигидро-11н-пирано 4, 3: 4, 5пирроло 2, 3-d пиримидин
Формула | Описание | Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Формула
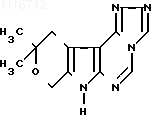
1,2,4-ТРИАЗОЛО[4,3-C] -10,10-ДИМЕТИЛ-8,10-ДИГИДРО-11Н-ПИРАНО [4 ![]() ,3
,3 ![]() :4,5] ПИРРОЛО [2,3-D] ПИРИМИДИН формулы
:4,5] ПИРРОЛО [2,3-D] ПИРИМИДИН формулы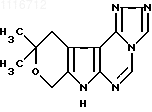
Описание
Известен 1,2,4-триазоло[4,3-c]-8,9,10,11-тетрагидробензо(b)тиено [2,3-d] пиримидин, который получают из 4-гидразино-5,6,7,8- тетрагидробензо(8)тиено[2,3-d]пиримидина кипячением с ортомуравьиным эфиром.
Известно производное пирроло[1,2-a]-1,2,3-триазоло[1,5-c]хиназолина формулы
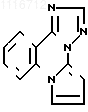 полученное циклизацией аминофенилтриазола формулы
полученное циклизацией аминофенилтриазола формулы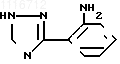
Целью изобретения является создания производной новой гетероциклической системы.
Поставленная цель достигается созданием производного новой гетероциклической системы 1,2,4-триазоло[4,3-c]-10,10-диметил- 8,10-дигидро-11Н-пирано[4',3':4,5]-пирроло[2,3-d]пиримидином формулы I
Указанное соединение получают взаимодействием 2,2-диметилтетрагидропиран-4-она с этиловым эфиром муравьиной кислоты с последующим получением монофенилгидразона 2,2-диметилтетрагидропиран-4,5-диона, который восстанавливают в 5-ацетамидо-2,2-диметилтетрагидропиран-4-он и вводят во взаимодействие с динитрилом малоновой кислоты. Полученный 2-амино-1-ацетил-5,5-диметил-3-циано-4,5,6,7-тетрагидропирроло[2,3-c] пиран при взаимодействии с ортомуравьиным эфиром образует 1-ацетил-5,5-диметил-4,5,6,7-тетрагидро-3-циан-2- этоксиметиленаминопирроло[2,3-c] пиран, который действием гидразингидрата переведен в 4-гидразин-6,6-диметил-5,6-дигидро-8Н-пирано[4',3':4,5] пирроло[2,3-d] пиримидин, циклизующийся ортомуравьиным эфиром в целевой продукт по схеме
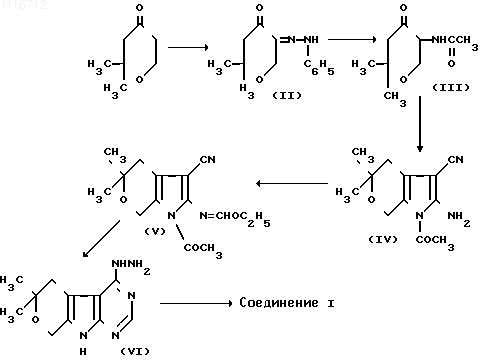
Строение полученных соединений доказано методами ИК-, ПМР-спектроскопии и масс-спектрометрически.
П р и м е р 1. 5-Монофенилгидразон 2,2-диметилтетрагидропиран-4,5-диона (II).
К смеси 12,8 г (0,1 моль) 2,2-диметилентетрагидропиран-4-она и 11,1 г (0,15 моль) этилового эфира муравьиной кислоты, охлажденной до 0-5оС, при перемешивании прибавляют раствор метилата натрия в метиловом спирте, приготовленный из 2,3 г (0,1 г.ат) натрия и 23 мл метилового спирта. Выпавшее натриевое производное формилтетрагидропиранона оставляют на ночь при комнатной температуре, затем осадок растворяют, прибавляя к реакционной смеси (от 0 до -5оС) воды. Полученный раствор приливают к охлажденному до 0оС водному раствору хлористого фенилдиазония, приготовленному обычным способом из 9,3 г (0,1 моль) анилина, 30 мл концентрированной соляной кислоты и 6,9 г (0,1 моль) нитрита натрия и доведенному до рН 5,0-6,0 ацетатом натрия. Выпавшие кристаллы отфильтровывают, промывают холодной водой и сушат, выход 19,0 г (81,9%), т.пл. 67-68оС (этиловый спирт).
Найдено, С 67,19; Н 6,98; N 12,09.
C13H16N2O2
Вычислено, C 67,21; Н 6,94; N 12,05.
В ИК-спектре имеются следующие полосы поглощения,
ПМР-спектр (CCl4),
5-Ацетамидо-2,2-диметилететрагидропиран-4-он (III).
К смеси 46,4 г (0,2 моль) 5-монофенилгидразона 2,2-диметилтетрагидропиран-4,5-диона (II), 20,5 г (0,24 моль) плавленного ацетата натрия, 55,0 г (0,53 моль) уксусного ангидрида и 200 мл уксусной кислоты, нагретой до 40оС, при энергичном перемешивании прибавляют небольшими порциями 40,0 г (0,6 г. ат) цинковой пыли. Затем реакционную смесь перемешивают 1,5 ч при кипячении, отфильтровывают шлам, промывают его горячей уксусной кислотой и уксуснокислый раствор упаривают при пониженном давлении. К остатку прибавляют воду, выпавший ацетанилид отфильтровывают, а водный раствор упаривают в вакууме. К остатку прибавляют хлороформ, отфильтровывают ацетат цинка, отгоняют хлороформ, продукт перегоняют, выход 27,1 г (73,3%), т.кип. 113-114оС/мм рт.ст.
Найдено, C 58,32; H 8,11; N 7,59.
C9H15NO3.
Вычислено, С 58,36; Н 8,16; N 7,56.
В ИК-спектре имеются следующие полосы поглощения,
ПМР-спектр (CCl4),
М 185 (масс-спектрометрически).
2-Амино-1-ацетил-5,5-диметил-3-циан-4,5,6,7-тетрагидропирроло [2,3-c] пиран (IV).
Смесь 18,5 г (0,1 моль) 5-ацетамидо-2,2-диметилтетрагидропиран-4-она (III), 6,6 г (0,1 моль) динитрила малоновой кислоты, 2 мл диэтиламина, 1 мл уксусной кислоты, 100 мл абсолютного бензола кипятят с водоотделителем в течение 1 ч. Выпавшие кристаллы отфильтровывают, промывают 30 мл бензола и сушат, выход 20,0 г (86,1%), т.пл. 180-181оС (этиловый спирт).
Найдено, С 61,69; Н 6,50; N 17,98.
С12H15N3O2.
Вычислено, С 61,80; Н 6,48; N 18,01.
В ИК-спектре имеются следующие полосы поглощения,
ПМР-спектр (CDCl3),
М 233 (масс-спектрометрически). 1-Ацетил-5,5-диметил-4,5,6,7-тетрагидро-3-циан-2-этоксиметиленаминопирроло [2,3-c]пиран (V).
К суспензии 2,3 г (0,01 моль) 2-амино-1-ацетил-5,5-диметил-3-циан-4,5,6,7-тетрагидропирроло[2,3-c] пирана (IV) в 25 мл ортомуравьиного эфира прибавляют 2 капли уксусного ангидрида. Смесь кипятят 2 ч с обратным холодильником, затем растворитель отгоняют в вакууме досуха. К остатку прибавляют петролейный эфир. Образовавшиеся кристаллы отфильтровывают и сушат, выход 2,7 г (93,4%), т.пл. 82-83оС (петролейный эфир-этиловый спирт 1:3).
Найдено, С 62,29; Н 6,59; N 14,55.
C15H19N3O3
Вычислено, С 62,27; Н 6,62; N 14,52.
В ИК-спектре имеются следующие полосы поглощения,
ПМР-спектр (CDCl3),
М 289 (масс-спектрометрически).
4-Гидразино-6,6-диметил-5,6-дигидро-8Н-пирано-4', 3':4,5]пирроло [2,3-d] пиримидин (VI).
К раствору 2,9 г (0,01 моль) 1-ацетил-5,5-диметил-4,5,6,7-тетрагидро-3-циан-2- этоксиметиленаминопирроло[2,3-c]пирана (V) в 15 мл этилового спирта прибавляют 5 мл гидразина гидрата. Смесь выдерживают при комнатной температуре в течение 24 ч. Затем суспензию кипятят 2 ч на водяной бане, отфильтровывают образовавшиеся кристаллы, промывают водой, спиртом и сушат, выход 1,55 г (62,5%), т.пл. 239-240оС (ДМФА).
Найдено, C 56,78; H 6,50; N 30,12.
C11H15N5O
Вычислено, C 56,63; H 6,48; N 30,01.
В ИК-спектре имеются следующие полосы поглощения,
М+ 233 (масс-спектрометрически).
Ацетат 4-гидразино-6,6-диметил-5,6-дигидро-8Н-пирано[4', 3':4,5] пирроло[2,3-d] пиримидина получают кипячением 2,3 г (0,01 моль) 4-гидразино-6,6-диметил-5,6-дигидро-8Н-пирано[4', 3': 4,5] пирроло [2,3-d]пиримидина с 10 мл ледяной уксусной кислоты, выход 2,7 г (93,1%), т.пл. 245-246оС (метиловый спирт-эфир, 1:2).
Найдено, С 53,19; Н 6,47; N 23,76.
С13Н19N5O3
Вычислено, C 53,23; H 6,52; N 23,87.
ПМР-спектр (CD3ОD),
1,2,4-Триазоло[4,3-c] -10,10-диметил-8,10-дигидро-11Н-пирано [4'3':4,5] пирроло[2,3-d]пиримидин (I).
Смесь 2,3 г (0,01 моль) 4-гидразино-6,6-диметил-5,6-дигидро-8Н-пирано[4'3':4,5]пирроло [2,3-d]пиримидина (VI) и 50 мл ортомуравьиного эфира кипятят в течение 10 ч. Отгоняют ортомуравьинный эфир в вакууме досуха. К остатку прибавляют этиловый спирт, образовавшиеся кристаллы отфильтровывают, промывают этиловым спиртом и сушат, выход 1,7 г (70,4%), т.пл. 270-271оС (метиловый спирт-хлороформ, 1:1).
Найдено, C 59,18; H 5,41; N 28,83.
С12Н13N5O
Вычислено, C 59,24; H 5,38; N 28,85.
В ИК-спектре имеются следующие полосы поглощения,
ПМР-спектр (пиридин-d5),
М+ 243 (масс-спектрометрически).
Заявка
3569549/04, 31.03.1983
Институт тонкой органической химии им. А. Л. Мнджояна
Норавян А. С, Пароникян Е. Г, Мирзоян Г. В, Вартанян С. А
МПК / Метки
МПК: C07D 491/22
Метки: 10-дигидро-11н-пирано, 10-диметил-8, 3-c-10, 4-триазоло4, 5пирроло, пиримидин
Опубликовано: 20.11.1995
Код ссылки
<a href="https://patents.su/0-1116712-1-2-4-triazolo4-3-c-10-10-dimetil-8-10-digidro-11n-pirano-4-3-4-5pirrolo-2-3-d-pirimidin.html" target="_blank" rel="follow" title="База патентов СССР">1, 2, 4-триазоло4, 3-c-10, 10-диметил-8, 10-дигидро-11н-пирано 4, 3: 4, 5пирроло 2, 3-d пиримидин</a>
Предыдущий патент: Способ регулирования крутящего момента ю. д. погуляева и устройство для его осуществления
Следующий патент: Пневматический трехпозиционный регулятор
Случайный патент: Устройство для автоматического перемещения электродов дуговой электропечи




