Рекомбинантная плазмидная днк rv7-ii, содержащая фрагмент rv7-ii для выявления ротавирусов человека, и штамм бактерий еsснеriснiа coli продуцент фрагмента rv7-ii для выявления ротавирусов человека
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
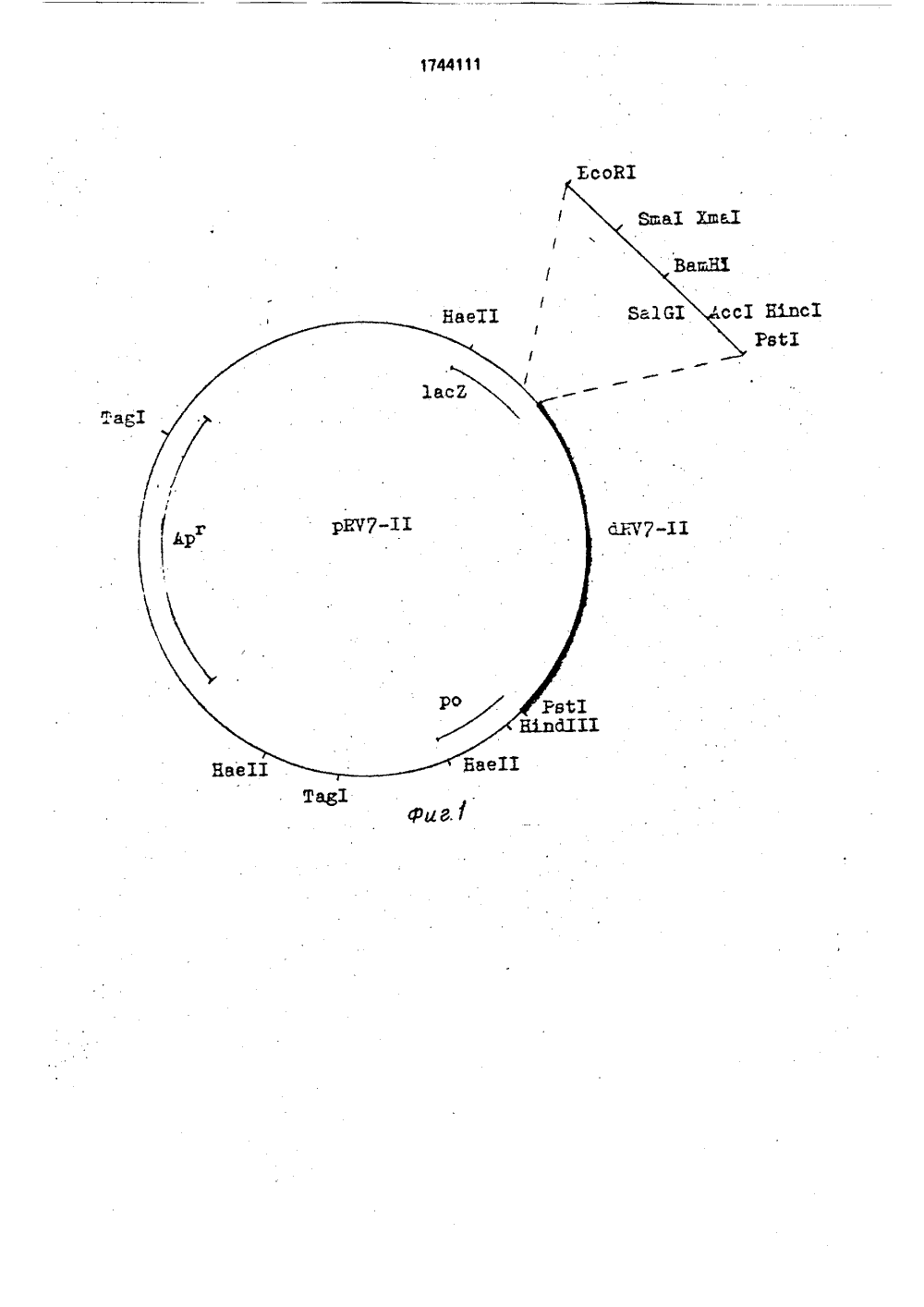
(51)5 С 12 й 15/33. 15/7 ОПИСАНИЕ ИЗОБРЕТЕК АВТОРСКОМУ СВИДЕТЕЛЬСТВУ 1(71) Нижегородскийский институт,эпидемлогии и Институт бимикроорганизмов АН 24 аучно-иссл иологии иохимии и фСССР ователкроби иологи 70 3, 1 ДНАЯ МЕНТ РУСОВ ЕРИЙ ФРАГ- РОТАГОСУДАРСТВЕННЫЙ КОМИТЕТПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМПРИ ГКНТ СССР.Оуа ЯвЮ МЛ е,а - МАР, 19рр,3351-3362,(54) РЕКОМБИНАНТНАЯ ПЛАЗМИ ДНК рРЧ 7-1, СОДЕРЖАЩАЯ ФРА бРЧ 7- ДЛЯ ВЫЯВЛЕНИЯ РОТАВИ ЧЕЛОВЕКАМИ И ШТАММ БАКТ ЕЯСНЕРСНА СО -ПРОДУЦЕНТ МЕНТА бРЧ 7- ДЛЯ ВЫЯВЛЕНИЯ ВИРУСОВ ЧЕЛОВЕКА Изобретение относится к медицине, генетической инженерии и биотехнологйи.Ротавирусы являются этиологическим, агентом острого гастроэнтерита, поражают преимущественно детей раннеговозраста и молодняк животных, вызывают в осенне- зимний период до 70 случаев острых кишечных инфекций неясной этиологии. Разработка современных способов выявления ротавирусов имеет большое научно-практическое значение, так как своевременная диагностика важна для выбора правильной стратегии лечения больного и необходима для проведения Ы1744111(57) Изобретение относится к медицине, генетической инженерии и биотехнологии, Целью изобретения является создание штамма ЕзсЬегСЫа со - продуцента ДНК- зонда для выявления ротавирусов человека, В результате генноинженерных разработок создан штамм Е,со Ф.ВКМСВ, содержащий плазмиду рРЧ 7 -- продуцент фрагмента сРЧ 7 -ДНК-зонда для выявления ротавирусов человека. Синтезированный фрагмент выявляет в реакции РНК-ДНК гибридизации ротавирусы человека как с "длинными", так и с "коротким" типами миграции сегментов РНК и обладает чувствительностью 0,1-0,5 нг тотальной РНК для ротавирусов человека и 1 нг РНК гетерологичного ротавируса ЯА, Использование фрагмента ЖЧ 7 - для индикации ротавирусов человека в клиническом материале позволяет выявить ротавирусы в большом количествепроб по сравнению с методами электронной микроскопии и электрофореза геномной РНК. 2 с,п.ф-лы, 2 ил., 2 табл. эпидемиологического изучения инфекции, вызванной ротавирусами,"Ротавирусы характеризуются широкой вариабельностью и многообразием генетических вариантов; что определило существование различных групп, субгрупп и серотипов ротавируса, Существующие в настоящее время иммуноферментные тест-системы, основанные на групповом и субгрупповом антигенах, не позволяют выявить все многообразие вариантов ротавирусов. Кроме того, иммуноферментный метод при анализе проб стула больных ротавирусным гастроэнтеритом дает опреде5 10 20 турный белок 25 30 35 40 45 50 55 ленный процент ложноположительных результатов, Одним иэ наиболее чувствительных и специфических методов индикациивирусов является метод молекулярной гибридизации,Геном ротавирусов состоит изсегментов двунитевой РНК. Известно, что гены,кодирующие неструктурные белки (ГНБ),могут гибридизоваться с РНК различныхштаммов ротавируса.Установлено, что степень гомологии одного и того же ГНБ у разных штаммов ротавируса может колебаться от 74 до 88,Разброс в чувствительности по отношениюк разным штаммам ротавируса связан с дивергенцией нуклеотидных последовательной генов.Кроме того, показано, что при применении в качестве "зонда" ДНК комплементарной РНК вирусов, циркулирующих в разныхгеографических регионах, возможно отсут-,ствие выраженного гибридизационного сигнала из-за дивергенции нуклеотидныхпоследовательностей,В связи с этим создание эффективного"зонда" для выявления в клиническом материале ротавирусов человека, циркулирующих на определенной территории.предполагает использование РНК, доминирующих на данной территории штаммов.Известны рекомбинантные плазмиды,содержащие фрагменты ДНК, комплементарные ГНБ ротавирусов обезьян штаммЯА 11) свиней (штамм ОБО)и крупного рогатого скота (штамм ОК), созданные на основе вектора рВВ 322. Использованиеданных гибридных плазмид для выявленияротавирусов человека неэффективно, таккак они несут фрагменты генетическогоматериала штаммов ротавируса, гетерологических по отношению к ротавирусам человека.Известен способ конструирования гибридных плазмид, содержащих ДНК, комплементарные сегментам генома ротавируса,При конструировании в качестве вектора использовалась плазмида рВВ 322. Клонирование проводилось в Рм сайт даннойплазмиды. Известно, что при использовании такого способа конструирования 500целевых плазмид теряют Рзт 1-сайт, в результате чего возникают сложности получения клонированной последовательности.Известен способ получения рекомбинантных плазмидных ДНК на основе векторарОС. Однако неизвестна возможностьприменения такого способа при клонировании флагментов ДНК, комплементарныхгенам ротавируеов, кодирующим неструктурные белки. Известны штаммы Езсйег 1 сЫа со 11, содержащие рекомбинантные плазмиды с кДНК ГНБ ротавирусов обезьян и животных, Использование этих клеток в качестве продуцентов гибридизационного, зонда для выявления ротавирусов человека нецелесообразно в связи с тем, что содержащийся в них генетический материал недостаточно эффективно гибридизуется с РН К ротавирусов человека (1,2),Цель изобретения - создание штаммаЕзсЬег 1 сЫа со 11-продуцента ДНК-зонда длявыявления ротавирусов человека,Поставленная цель достигается тем,что: А, Выделяют днРНК ротавируса человека, доминирующего на территории РСФСР.Б. Синтезируют ДНК фрагмент бВЧ 7 - 11, комплементарный 7-му сегменту генома ротавируса человека, кодирующему неструкВ, Конструируют плазмиду рВЧ 7 - 1, в которой синтезированный фрагмент кДНК встроен в Рзт сайт полилинкера плазмиды рОС 9.Г. Предлагают способ конструирования рекомбинантной плазмиды рВЧ 7 - 11, позволяющий введение ДНК, комплементарной 7-му сегменту генома ротавируса человека в Рз 11 сайт плазмиды рОС 9.Д, Создают штамм ЕзсЬег 1 сЫа со, содержащий плазмиду рВЧ 7-И-продуцент универсального зонда для выявления рота- вирусов человека,Сущность предлагаемых объектов изобретения состоит в следующем,А, ДНК-зонд бВЧ 7-для выявления ротавирусов человека представляет собой Рзб - Рзт фрагмент ДН К, гомологичный 7-му сегменту РН К генома ротавирусов человека, Фрагмент имеет размер 1,113 т.п,н., первичная последовательность представлена на фиг. 2. ДНК-зонд бВЧ 7-1 гибридизуется с РНК штаммов ротавируса, имеющих разные типы миграции РНК.Синтез ДНК зонда бВЧ 7-11 осуществляется в процессе репликации плазмиды рВЧ 7 - за счет участка инициации репликации плазмиды.рОС 9.Б. Плазмида рВЧ 7 - 11(фиг.1) состоит из: - Рзс 1 - Рзс 1 фрагмента ДНК (бВЧ 7 - 11) размером 1,113 т.п,н. с определенной последовательностью;- Рзб-Рзт 1 фрагмента ДНК векторной плазмиды рОС 9 размером 2,671 т,п,н. и имеет:уникальные сайты рестрикции для эндонуклеаз ЕсоВ 1, Яаа 1, Хгпа 1, Вав Н 1, За 61, Асс, Н 1 пс 1, Н 1 пс 111;5 10 15 20 25 30 35 40 45 55 два сайта рестрикции для эндонуклеазы Рэт 1;три сайта рестрикции для эндонуклеазы НаеИ;ог 1 репликации плазмиды рОС 9, селективный маркер Ар;область, кодирующую а -пептид ф-галактозидазы, синтез которого инактивирован встройкой бйЧ 7-П фрагмента кДНК.В; Сущность способа конструирования рекомбинантной плазмиды заключается в том, что к У-концам смеси синтезированных фрагментов кДНК генома ротавируса человека с помощью терминальной трансферазы присоединяют по 20-30 остатков цитоэина. Аналогично к вектору рОС 9, гидролизованному по Рзб сайту, присоединяют 20 - 30 остатков гуанина, Затем полученные таким образом ДНК вектора и фрагмента сплавляют. Полученной смесью ДНК трансформируют клетки ЕзспегсЫа со 285 и выращивают при 37 С на среде, содержащей ампицилинбром-хлор-индолилгалактозид и изо-пропил-тиогалактоэид,Отбирают клоны, образующие колонии.белого цвета, из которых выделяют плазмиду ДНК и идентифицируют целевую плаэмиду по гибридизации с седьмым сегментом РНК ротавируса человека. Г. Штамм продуцент ДН К-эонда для выявления ротавирусов человека получают трансформацией клеток Е.со 1 285 с помощью рекомбинантной плазмиды рЯЧ 7-11.Штамм бактерий Езспег 1 сЬа со, содержащий плазмиду рЯЧ 7 - 11, депонирован во Всесоюзной коллекции микроорганизмов под М ВКМ Св, характеризуется следующими признаками,Морфологические признаки, Клетки прямые, палочковидные (1,2-1.6 х 2,0 х х 6,0 мкм), подвижные, имеютперитрихи альные жгутики, грамотрицательные, неспороносные.Культуральные признаки. Клетки хорошо растут на обычно используемых питательных средах, На 1,57 ь питательном агаре Дифко колонии гладкие, серые, бестящие, края ровные, мутные. При выращивании в жидких средах - мясопептонном бульоне и-бульоне образуют ровную интенсивную . муть.физико-биохимические признаки, оп. тимальная температура 37 С. рН 6,8-7,5, В качестве источника углерода используют многие углеводы, органические кислоты, спирты. В качестве источника азота используют минеральные соли (в амонийной или нитратной форме), органические соедийения (в .виде пептона, триптона, аминокислот),Устойчивость к антибиотикам: проявляет устойчивость к ампицилину (100150 мг/л),Генетические признаки; ГЬас М 15.Присутствие в штамме Е.со ДНК плаэ.миды рЯЧ 7-И, содержащей фрагмент д ЯЧ 711, гомологичный 7-му сегменту РНК геномаротавируса человека, подтверждается путем проверки его устойчивости к ампицилину, а также путем выделения и анализаплазмидной ДНК, а затем с помощью блотгибридиэации,Изобретение иллюстрируется следующими примерами,П р и м е р 1, Конструирование ДНКзонда для выявления ротавирусов человека.А. Выделение очищенной РНК ротавирусов человека.РН К ротавирусов человека выделяют изинфекционного материала больного ротавирусным гастроэнтеритом (изолят М 4097),содержащего ротавирусы с "длинным" типом миграции РНК. Ротавирусы с такимэлектрофоторетипом доминируют на территории РСФСР в течение ряда лет,. 1 г инфекционного материала гомогениэируют в 3 мл буфера, содержащего 0,01 МСНзСООКа, 0,3 М йаС 1, 4 м М ЭДА. рН 5,2,1% ДСН, инкубируют 1 ч при 37 ОС добавляют равный объем прогретой до 65 С фенол-хлороформенной (1;1) смеси,перемешивают и инкубируют 3 - .5 мин при65 С. Смесь центрифугируют при 5 тыс.об.в 1 мин в течение 10.мин и отбирают супернатант. Экстракцию повторяют еще раз при65 С, а затем при комнатной температуреаналогично описанному выше,. К полученному препарату добавляют 2объема этанола, выдерживают 18 - 20 ч при-20 С и центрифугируют при 5 тыс.об/мин втечение 1 ч. Осадок растворяют в 1 мл буфера, содержащего 0,01 М трис рН 8.0, 0,001 ММ 9 С 2, 0.3 М йаС 1, 20 мкг/мл панкреатической ДН Казы, инкубируют 30. мин при 25 С,добавляют равный объем фенола (рН 8,0),интенсивно перемешивают и центрифугируют.при 5 тыс.об /мин в течение 10 мин,Водную фазу отбирают, добавляют 0,1 объема 3 М ацетата натрия и два объема этанола, Осадки РНК, сформированные при -20 Св течение ночи, дважды промывают 700 ным этанолом с 0,05 М ацетатом натрия рН5,2, растворяют в стерильньй воде и переосаждают еще раэ. Осадки РНК хранят при-20 ЯС,Б. Синтез двух цепочечной кДН К.Синтез кДНК осуществляют по известному методу Мак-Крас,Препарат днДНК(5 - 10 мг) в буфере, содержащем 10 мМ трис-НС 1. рН 8,00 1 мМЭДТА (ТЕ),денатурируют при 100 С 5 мин и охлаждают при 0 С;Реакцию полиаденилирования 3 концов РНК проводят в объеме 200 мкл при 37 С в буфере, содержащем 50 мМ трис-НС 1 рН 7,9,10 мМ М 9 С 12. 2,5 мМ МпС 2, 20 мУ йаС 1, 50 мкг/мл БСА, 0,1 мМ АТФ (включая 20 мк КиН; АТФ и 1/10 объема поли-А-полимеразы (0,5 мкг,Степень аденилирования определяют по известной методике, Определяют время реакции, необходимое для присоединения 15 - 20 остатков АМФ. Полученный препарат экстрагируют фенолом и осаждают 2,5 объемами спирта.К препарату полиаденилированной РН К в буфере ТЕ добавляют 5 мкг олиго-ОТ 2-в денатурируют 3 мин при 100 С и охлаждают во льду. Синтез кДНК проводят в буфере, содержащем 50 мМ трис-НС 1, рН 8,3, 50 мМ КС 1, 10 мМ МдС 2, 10 мМ ДТТ, 4 мМ пирофосфата натрия, по 0,5 мМ б АТР, б СТР, б 6 ТР, б ТТР, 10 мк Ки Р АТР в объеме реакционной смеси 100 мкл. Добавляют 25 ед,обратной транскриптазы из вируса миелобластоза птиц и инкубируют 2 ч при 42 С,Цепи РНК удаляют щелочным гидролизом (0,25 М йаОН 20, при 70 С). Препарат нейтрализуют НС 1, депротеинизируют равнымм объемом фенола (рН 8,0), осаждают нуклеиновую кислоту этанолом и растворяют в 50 мкл ТЕ-буфера,Препарат очищают от невключившихся ойТР на колонке с сефадексом 6 50, уравновешенной ТЕ-буфером, Отбирают фракции, содержащие кДНК. Для получения дн кДНК полученный препарат прогревают 2 мин при 1000 С, добавляют до 0,2 М и отжигают комплементарные молекулы ДНК 30 при 65 С, 60 при 50 С,30 при 40 С.Дву иитевую кДНК осаждают этанолом,Достройку дн кДНК до образования "тупых" концов проводят с помощью фрагмента Кленова по стандартной методике, Затем проводят экстракцию фенолом и хроматографию на колонке с сефадексом 6-50, Фракции, содержащие кДНК. объединяют, кДНК осаждают этанолом.Реакцию достройки поли-коннекторов проводят в 25 мкл инкубационной смеси следующего состава: 0,2 М какодилат йа, рН 7,9, 8 мМ МоС 12, 1 мМ 1 о-меркаптоэтанола, 2 мМ СТР. В реакционную смесь добавляют 20 ед, концевой нуклеотидилтрансферазы и 0,5 мкг дн кДНК. Реакцию проводят при 37 С в течение 30 мин, экстрагируют фенолом и осаждают этанолом, как указано выше,П р и м е р 2. Клонирование к ДНК в векторной плазмиде рОС 9152025 А, 5 мкг векторной плазмиды рОС 9 гидролизуют рестрикционной нуклеазой Рз, затем депротеинизируют 2-кратной экстракцией фенолом (рН 8,0), Фенол удаляют зкстракцией равным объемом хлороформа, и плазмидную ДНК осаждают спиртом,Достройку поли-коннекторов проводят при 37 С 30 мин, как указано (за исключением того, что вместо б СТР берут б 6 ТР, а вместо М 9 С 2- СоС 12),Плазмидную ДНК и дн кДНК смешивают в эквимолярных соотношениях в 20 мкл буфера, содержащего 10 мМ трис-НС 1, рН 7,5, 1 мМ ЭДТА, 0,1 М йаС 1.Инкубируют 5 мин при 65 С, затем 2 ч при 42 С и охлаждают до 0 С, Полученным препаратом ДНК трансформируют компетентные клетки Е,со 285,Иэ выросших при 370 С клонов трансформантов белого цвета выделяют плаэмидную ДНК щелочным методом.Б. Рестрикционный анализ рекомбинантной плазмиды рВЧ 7-1,Выделенные плазмидные ДНК расщепляют эндонуклеазой рестрикции Рм 1. Полученные препараты анализируют в10-ном агарозном геле,По данным рестрикционного анализаотбирают плазмидые ДНК, содержащие30 различные по размеру вставки,П р и м е р 3. Идентификация рекомбинантной плазмиды рВЧ 7-11, содержащейуниверсальный зонддля выявления ротавирусов человека.35 Идентификацию рекомбинантной плазмиды, .содержащей вставку ДНК, комплементарную 7-му сегменту РНК геномаротавирусов, проводят методом блот-гибридизации-40 Радиоактивные зонды для гибридизации получают по стандартной методике.Плазмидную ДНК очищают от невключившихся дезокситрифосфатов на колонке сефадексом 650 ведал.45 С целью нанесения сегментов РНК нанейлоновую мембрану проводят электрофорез РНК ротавирусов человека в ПААГ,Готовят гелевую ячейку 115 х 115 х 2, состоящую из 10 разделяющего и 3; кон 50 центрирующего гелей, Гели. готовят иэ.концентрированных растворов: 30;(, акриламид-бисакриламид(27:1), х 4-кратного буфера для разделяющего геля (1,5 Мтрис-НС 1, рН 8,4, 0,4% ДСН), х 4-кратного55 буфера для концентрирующего геля (0,5 Мтрис-НО, рН 6-8, 0,4 ДСН), воды, катализатора(10 -ный персульфат аммония) и инициатора полимериэации (й-й-й - й-ТЭМЭД),Перед гибридизацией мембрану предгибридиэуют 2-3 ч при 42 С в растворе,содержащем 5 х ЗЗС, 50 мМ Фосфата Иа (рН 6,5), 500 мкг/мл денатурированной при 100 С в течение 10 мин тимусной ДНК, 0,1% ДСН, 0,1% БСА, поливинилпиролидона и фикола. После предгибидизации в раствор добавляют меченную Р денатурированную ДНК рекомбинантной плазмиды и проводят гибридизацию при 55 С 24 ч, после чего мембранный блот отмывают 4 раза по.10 мин при комнатной температуре в 200 мл 2 хЗЗС 1% ДСН и 30 мин при 55 С в растворе 0,1% ЗЗС - 0,1% ДСН, высушивают и радиоавтографируют при -70 С в течение 24 ч. На основании данных радиоавтографии идентифицируют целевую плазмиду рВЧ 7-И, содержащую фрагмент ДНК, комплементарный 7-му сегменту РНК ротавируса человека.П р и м е р 4, Определение нуклеотидной последовательности фрагмента бВЧ 7- И.А. Получение производных фрагмента бВЧ 7-И, укороченных с Н 1 пб И 1-конца.ДН К плазмиды рВЧ 7-И (2 мкг) гидролизуют эндонуклеазой, рестрикции Н 1 пб 1 И (5 ед.) в буфере: 10 мМ трис-НС 1, рН 7,5,50 мМ йаС 1, 10 мМ М 9 С 12. 1 мМ ДТТ в объеме реакционной смеси 40 мкл в течение 2 ч при 37 С. Препарат экстрагируют равным объемом фенола, осаждают 2,5 объема этанола и растворяют полученный осадок в 10 мкл буФера ТЕ.Полученный препарат обрабатывают нуклеазой Ва 31 (2 ед.) в 20 мкл буфера: 20 мМ трис-НС рН 7,3, 0.6 М йаС 1, 12,5 мМ М 9 С 2, 12,5 мМ СаС 2 при 30 С в течение 10 мин. Реакцию останавливают добавлением ЭДТА до 20 мМ, препарат экстрагируют фенолом, осаждают 2,5 объемами этанола и после промывают 70-ным этанолом в осадок растворяют в 20 мкл ТЕ. Гидролизуют ДНК эндонуклеаэой рестрикции Есо 81 (5 ед.) в 30 мкл буфера: 100 мМ трис-НС рН 7,5, 100 мМ йаС 1, 10 мМ М 9 Сг. 1 мМ ДТТ при 37 С 2 ч. Препарат подвергают электрофорезу в 0,9-ном агарозном геле. Набор укороченных с Н 1 пб И 1-конца фрагментов ДНК вырезают и элюируют из геля с по мощью электроэлюции.Полученные фрагменты ДН К клонируют в плазмиде рОС 9 (предварительно гидролизованной эндонуклеазами рестрикции Есой и Згла) по известной методике. Клоны анализируют на. наличие плазмидной ДН К с помощью электрофореза в агарозном геле и отбирают клоны, несущие плазмиды с делециями фрагмента бВЧ 7-,И размером 200, 300, 400 и 500 н.п,Б, .Получение производных фрагмента бВЧ 7-11, укороченных с Есой-конца.20 дизации 25 30 нитевых РНК в полученных.препаратах 40 10 15 50 55 Аналогично получают делеции фрагмен та бйЧ 7 - И с Есой 1-конца, для чего ДНК плазмиды рВЧ 7 - И первоначально гидролизуют эндонуклеазой рестрикции Есой.В, Определение нуклеотидной последовательности фрагмента бВЧ 7-И.Плазмиду рйЧ 7-И, а также плазмиды с делеционными производными фрагмента бВЧ 7-И гидролизуют соответствующей зндонуклеазой рестрикции(Н 1 пб 1 И или Есой 1). Концевое мечение фосфоромполученйых препаратов ДНК осуществляют с помощью ДН К-полимеразы(фрагмент Кленова) по известной методике, Выделение и очистку меченого, фрагмента ДНК проводят как описано выше, Нуклеотидную последовательность . меченых; фрагментов определяют по методу Максама - Гилберта, Полученная в результате полная нуклеотидная последовательность фрагмента бВЧ 7-И представлена на фиг.2,П р и м е р 5. Определение эффективности фрагмента бйЧ 7-И методом дот-гибриВыделяют РНК ротавирусов человека, имеющих "длинный" (И субгруппа) и "короткий" (1 субгруппа) типы миграции сегментов, а также РНК ротавируса ЗАИ, как описано в примере 1, Определяют концентрацию двуспектрофотометрическим методою (7 сегмент РНК по мол.м. составляет 1/20 часть массы тотальной РНК ротавириона).5 нг тотальной РНК каждого типа денатурируют при 100 С втечениебмин в 20 мкл буфера ТЕ, быстро охлаждают во льду, наносят на нейлоновый фильтр, првдгибридизуют, гибридизуют смвчвинЮ РЫДНК-зонда и радиоавтографируют, как описано в примере 3. Идентифицируют зоны гибридизации для РНК различных ротавирусов Результаты представлены в табл. 1.Наличие гибридизационного сигнала наблюдается во всех случаях, Для проведения гибридизации также использовалась РНК в количестве от 2 до 0,1 нг.П р и м е р 6, Выявление ротавирусов человека в клиническом материале больных острыми кишечными инфекциями с применением фрагмента бВЧ 7-И методом дотгибридизации,Берут 100 мкл копроэкстракта, добавляют 0,25 объема 25% ДСН, выдерживают 3 мин при 60 С, добавляют 3 объема 100% в/ч перхлората натрия, смесь интенсивно встряхивают и центрифугируют 10 мин при 5 тыс,об/мин. Не менее 20 мкл водной фазы наносят на нейлоновый фильтр, предгибридизуют с Р -меченым фрагментом бйЧ 7-И,32как описано выше.. 2 СААТАТАААЛ 22 АСАТТОАЛТСЛАСЛТЛАЛССЛА 222 САСА 2 ОТЛТСТОТСАЛЛСЛССТ700ТОТТССТОАЛТТЛЛСАТОССЛСТАСЛЛСАСЛ 222 ССТСТЛЛТЛЛСЛСЛТССТАЛАООТСЛфСТЛТЛОАСТТСТТЛЛЛТЛТТСЛТСЛСТТССТЛЛССЛТССЛОЛТЛСЛОТОТТТССТАСЛТЛ000ТАЛСЛЬТЛЛТССТЛЛСЛСТССТЛЛТЛТТЛСТСЛСТТС ЬЛТТТ(ТТЛ(4 ЛССЛЛЛЬСЛТТЛТ900ТТСССАААЛТТО 62 АСССАТТСАСАТСТТСЛАТОАААСЛЬСОТАЛТАСЛАТТСАТАТА 26 Анализируют 60 проб стула больных кишечными инфекциями, ранее обследованных на ротавирусы методами электронной микроскопии и злектрофореза в ПААГ,Результаты представлены в табл, 2, Из табл. 2 видно, что применение метод а молекулярной гибридизации с использованием в качестве зонда фрагмента с 1 ВЧ 7-И позволило выявить ротавирусы во всех пробах, положительных по методу электронной микроскопии, и в трех пробах, отрицательных по этому методу. Таким образом, в результате генноинженерных разработок создан штамм Е.соИ Ь ВКМ Св, несущий рекомбинантную плазмиду - продуцент ба - И фрагмента ДНК-зонда для выявления ротавирусов человека с различными типами РНК методом ДН К-РН К гибридизации.Синтезированный фрагмент бйЧ 7 - И выявляет РНК ротавирусов различных субгрупп за счет того, что является копией гена, кодирующего неструктурный белок и консервативного у всех имеющихся штаммов ротавируса. Чувствительность фрагмента бВЧ 7-И составляет для РН К ротавирусов человека 0,1-0,5 нг, что выше, чем в случае фрагмента, синтезированного на матрице генома ротавируса БАИ, эа счет того, что фрагмент бйЧ 7-И является копией гена ротавируса человека,Использование фрагмента (ВЧ 7-И длявыявления ротавирусов человека в клиниче-:ском материале позволило повысить процент выявленных положительных на .ротавирусы проб по сравнению с методомэлектронной микроскопии, что может быть1 О связано также с тем, что фрагмент бйЧ 7-Исинтезирован на матрице генома штаммаротавируса человека, доминирующего натерритории РСФСР, и имеет первичнуюструктуру, наиболее распространенную на15 данной теРРитории,Созданная плаэмида РЙЧ 7 - И позволяетнарабатывать фрагмент бйЧ 7-И, Уровеньсинтеза зонда в составе плазмиды в сконструированном штамме Е.соИ й ВКМ Ся составляет при плотности культуры5 х 10 клеток./мл 1,5 мг/л. Ф ор мул а и зоб рете н и я 1, Рекомбинантная плазмидная ДНКРВЧ 7 - И, содержащая фрагмент бйЧ 7-И для выявления ротавирусов человека, содержа- .щая: Рэб - . Рэ 11-фрагмент ДНК бЮ/7-И размером 1,113 т,п.н., гомологичный 7-му сегменту РНК ротавируса человека, со следующей нуклеотидной последовательно, стью.14 1744111 2 ЛАСЛААС 2 СС ТС ТТТС АЛЛ АСАХ САААСААСАСААИЛЛС С С ЛТ 22 ЛААС СА 72 С ТСАЛС10002 СЛС АСАЛААЛ 2 ССЛлЖЛЛСХАХСЛСМ.С 22 ССЛЛТГОиТТССС 1 ТХС О СХ ХС ЛЛЛЛЛ 2еСМЖА й СЛС СЛЛСС ЛЛСЛЮХЛСЛ 1 ЛСС СС Т 2 ЛТС ТСЛС СЛЛЛЛЛЛЛАЛЛЛЛЛС С С С С С С С- Рзс 1-РзЕ 1 - фрагмент размером 2,671 т.п,н. векторной плазмиды рФб 9;- уникальные сайты рестрикции для эндонуклеаз: Есо 1, йда 1, Хва 1, ВащН 1, Ба 1 С 1,Асс 1, Нз,пс, Н 1 пд 111;два сайта узнавания для эндонуклеазы рестрикции Рзс 1;- три сайта узнавания для эндонуклеазы рестрикции Нае 11;- ого репликации плазмиды рцс:;- селективные маркеры Ар ,Пасхозяин - ЕзсЬегсЫа со 1 852. Штамм бактерий ЕзспегсЫа соИ ВКМСв-продуцент Фрагмента бйЧ 7 - П для выявления ротавирусов человека,Таблица 1 абл. =й ь ТЛ, Ль ьЛТТЛСь ТТбь.ЛТ .,ь ь,бй-ь ьйССь,ь Т-, СЛЗЛТ.;- - .ь-.СТОТС ьь бе лГ,н,:.ТЗТЗСЗЛАТТЛЛОЛОЗСЛЗАСЛУ СЛОЛТТОС СтУ ьТС ь ЛСЛТЗОЛАЛООТСЛФСТЛТАСЛОТТЗТТЛЛАТЛТТСЛТСЛОТТЗСТЛАССЛТОСйбйТЛЗЛОТОТТТЗСТЛСЛТЛ
СмотретьЗаявка
4774640, 26.12.1989
НИЖЕГОРОДСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ЭПИДЕМИОЛОГИИ И МИКРОБИОЛОГИИ, ИНСТИТУТ БИОХИМИИ И ФИЗИОЛОГИИ МИКРООРГАНИЗМОВ АН СССР
НОВИКОВА НАДЕЖДА АЛЕКСЕЕВНА, КУЛАКОВ ЛЕОНИД АЛЕКСЕЕВИЧ, КСЕНЗЕНКО ВЛАДИМИР НИКОЛАЕВИЧ, НОСКОВА НИНА ВАЛЕНТИНОВНА, ЕПИФАНОВА НАТАЛЬЯ ВЛАДИМИРОВНА
МПК / Метки
МПК: C12N 15/33, C12N 15/70
Метки: rv7-ii, бактерий, выявления, днк, еsснеriснiа, плазмидная, продуцент, рекомбинантная, ротавирусов, содержащая, фрагмент, фрагмента, человека, штамм
Опубликовано: 30.06.1992
Код ссылки
<a href="https://patents.su/9-1744111-rekombinantnaya-plazmidnaya-dnk-rv7-ii-soderzhashhaya-fragment-rv7-ii-dlya-vyyavleniya-rotavirusov-cheloveka-i-shtamm-bakterijj-essnerisnia-coli-producent-fragmenta-rv7-ii-dlya-vyy.html" target="_blank" rel="follow" title="База патентов СССР">Рекомбинантная плазмидная днк rv7-ii, содержащая фрагмент rv7-ii для выявления ротавирусов человека, и штамм бактерий еsснеriснiа coli продуцент фрагмента rv7-ii для выявления ротавирусов человека</a>