Перхлораты 1-(2, 4 )или (3, 4 )-диметоксибензил) -2-метил-3-(4 -хлорфенил)-4(3н)-хиназолинония, проявляющие анальгетическую, противосудорожную и противомикробную активность
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 1110140
Авторы: Залесов, Кожевников, Морозова, Плаксина, Чернобровин
Текст
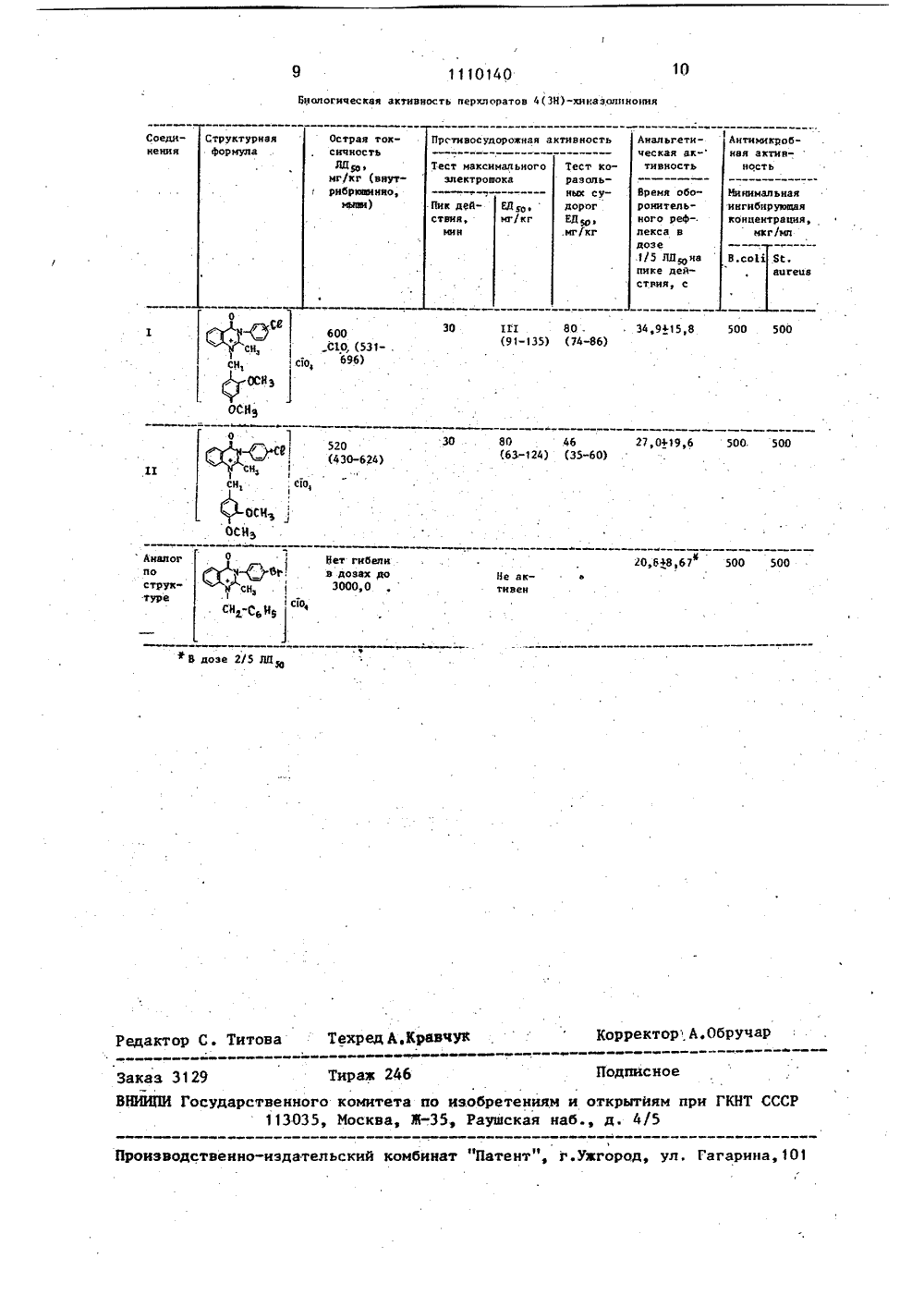
СООЭ СОВЕТСКИХщюлд еипепРЕСПУБЛИК ае и А 61.К 31/505 51)5 С 07 Э 239 УДАРСТВЕННЫЙЭОБРЕТЕНИЯМГННТ СССР КОМИТЕТ 0 ТИРМТИ ОПИСАНИЕ ИЗОБРЕТЕНК АВТОРСКОМУ СВИДЕТЕЛЬСТВУ(71) Пермский государсцевтический институте Н - 2 ,4 -(ОСН оявляющие анальге дорожную и против сть. 3,4 -(ОСН э), ескую, противокробную активДанное изобретение отно .новым биологически активным нениям общей формулы 1 турными аналогами нений являются-2-метил-арип общей формулы тся к оедиБпижайшипредлагаемыхперхлораты-Сн, 3-С анальг е ги еК - Ноявляющимикробн ую активно тивностЦелью дзобретения являются новыепроизводные лерхлоратов 1-Г(2,4 )или (3,4 ) -,диметоксибензж -2-метил-арил(ЗН) -хиназолинония, обла 5дающие более высокой анальгетическойактивностью и наряду с этим противомикробной и противосудорожной актив.ностью.Поставленная цель достигается соединениями общей формулы 1, обладающими анальгетической, противосудорожной и противомикробной активностью,которые получают внутримолекулярнойциклизацией 4-хлорфениламида И-г цетил-Б. - (2 ,4) -или (3,4) -диметоксибензилантраниловой кислоты при 30-минутном нагревании в метиловом спиртев присутствии 48-57%-ной хлорнойкислоты, 20Целевые продукты представляют,собой желтого цвета кристаллическиевещества, трудно растворимые в спирте, толуоле, хлороформе, хорошо - вдиметилсульфоксиде. Строение полученных соединений подтверждается спект.,роскопическими данными, В ИК-спектрах соединений прописываются следую.щие характеристические полосы: 17151735 см (-С=О группа у ароматичес+кого цикла), 1300-1310 см (-С=И)интенсивная полоса в области 1110 смобусловлена валентными колебаниямиперхлоратаниона.П р и,м е р 1. 4-Хлорфениламид.Н-(2,4)-дииетоксибензилиденантраниловой кислоты.К раствору 2.,47 г (0,01 моль)4-хл орфениламнда антраниловой кисло -ты в 10 мл этанола при перемешивании 40в 2 приема приливают 1,66 г (0,01 моль)2,4-диметоксибензальдегида в 7 млэтанола, поддерживая температуруреакционной смеси 36 ОС, оставляют прикомнатной температуре на 30 мин затем выделившийся осадок отсасывают,промывают на фильтре 10 ил охлажденного этанола, сушат. Длинные иглы, окрашенные в желтый цвет, с т.пл. 192194 С. Выход 98,2%.Найдено,%: С 67,02; Н 4,91;. ЙК-спектр, см (вазелиновое масло): 1678, 1615, 1552, 1500, 1470, 1330, 1287, 1220. П р и м е р 2. 4-ХлорфениламндМ-(3,4 )-диметоксибензилиденантраниловой кислоты.К раствору 2,47 г (0,01 моль)4-хлорфениламида антраниловой кислоты в 10 мл этанола при перемешиваниив 2 приема приливают раствор 1,66 г(0,01 моль) 3,4-диметоксибензальдегида в 7 мл этанола, поддерживая температуру реакционной смеси 38 С, оставляют при комнатной температуре на30 мин, выпавший осадок отфильтровывают, промывают на фильтре 10 млохлажденного этанола, сушат. Бесцветные кристаллы с т,пл . 132-134 фС.Выход 74,5%.Найдено,%: С 67,03; Н 4,99;Н 7,02.С, НС 11,0Вычислено,7: С 66,92; Н 4,85;Ю 7,09,ИК-спектр, см (вазелинове масло):1675, 1638, 1605, 1522, 1470, 1322,.1280, 1165.1П р и м е р 3. 4-ХлорфениламидМ"(2,4)-диметоксибензилантраниловойкислоты.1,95 г (0,005 моль) 4-хлорфениламида Б-(2,4) -диметоксибензилиденантраниловой кислоты и 0,2 г(0,0055 моль) боргидрида натрияхорошо перемешйвают до полученияоднородной массы в сухом виде, затемдобавляют 25 мл этанола, охлажденноого до 0 С. Реакционную смесь перемешивают при комнатной температуре2 ч, затем, нагревают на водяной бане15 мин, фильтруют. Фильтрат подкисляют 10%-ным раствором уксусной кислоты до слабокислой реакции .по лакмусу,Выпавшийосадок отфильтровывают, перекристаллизовывают из этанола. Бесцветные иглы с т,пл . 118-120 С . Выоход 68,6%.(0,0055 моль) боргидрида натрия хорошо перемешивают до получения однородной массы в сухом виде, затем добавляют 25 мп этанола, охлажденного доо, 50 С. Реакционную смесь перемешиваютпри комнатной температуре 2 ч, затемнагревают на водяной бане 15 мин,фильтруют, фильтрат подкисляют 10 Жным раствором уксусной кислоты дослабокислой реакции по лакмусу. Выпавший осадок отфильтровывают пере)кристаллизовывают из этанопа. Бесцветные иглы с т.пл. 170-173 С. Выход53, 77 е еНайдено,7.: С 66,71; Н 5,20,Н 7,18.72 2 С Й ЭеВычислено,7.: С 66,58; Н 5,33;0706;20-1ИК-спектр, см (вазелиновоемасло);3263, 1632, 1580, 1520, 14 71, 1423,1270, 1165.П р и. м е р 54-ХлорфениламидБ-ацетил-М-(2)4 )-диметоксибензил-. 25антранилавой кислоты.3,96 г (0,01 моль) 4-Хлорфениламида Б-(2 )4)-диметоксибенэилантраниловой кислоты в 10 мп уксусного ангидрида нагревают на водяной бане 3045 мин, после охлаждения приливают50 мп .воды и нейтрализуют безводнымкарбонатом натрия до щелочной реакции среды по лакмусу. Выпавший оса"док отфильтровывают, промывают на35фильтре 150 мп воды, сушат, перекристаллизовывают из этаиола. Бесцветныекристаллы с т,лл. 180-.182 С. Выход57,67.НайденоХ: С 65,7; Н 5,35", , 401 е 1 6,41,СИ,С 1 Н,О.Вычислено,7: С 65,68; Н 5,28;В 6,38.ИК-спектр, см (вазелиновое масло): 45.П р и м е р 6. 4-Хлорфениламид- О-ацетил-(34 ) - ,циметоксиб ензила н тра нил овой кисл оты 503,96 г (0,01 моль) 4-хлорфениламида Н-(3") 4 ф )-диметоксибензилантраниловой кислоты в 8, мп уксусного ангидрида нагревают на водяной бане45 мин, после охлаждения приливают50 мп воды и нейтрализуют безводнымкарбонатом до шелочной реакции средыпо лакмусу. Выпавший осадок отфильтровывают, промывают на фильтре 150 мп 406воды сушат, перекристаллизовываютнз этанояа. Бесцветные призмы ст,пл. 143-145 С. Выход 61) 5%.Найдено,7.: С 65,66; Н 5,25М 6,37.С 74 Н 7 З С 1 И 204Вычислено,7 С 65,68; Н 5,28;И 6,38.(0,01 моль) 57%-ной хлорной кислотыи выдерживают на водяной бане притемпературе 70-80 С в течение 30 мин.оЗатем отгоняют 15 мп метанола, выде-лившийся осадок отфильтровывают, промывают на фильтре 2 раза по 5 млметанола, Кристаллизуют из.абсолютного метанола. Призмы, окрашенныев желтый. цвет, с т.пл. 236-238 С.Выход 907,Найцено%; С 55,48; Н 4,13;И 5,49.С 4 Н 22 С 12 ее 20 ГВычислено,7: С 55,29;. Н 4,25;И 5,37 е(0,01 моль) 577-ной хлорной кислотыи выдерживают на водяной бане притемпературе 70-80 ОС в течение 30 минЗатем отгоняют 15 мп метанола, выделившийся осадок отфильтровывают,промывают на фильтре 2 раза по 5 мпмеТанола. Кристаллизуют из абсопютного метанола, Призмы, окрашенные в.желтый цвет, с т;пл. 268-270 СВыоход 83е.Найдено,7: С;55,36; Н 4,32;Я 5,21.С 1 Н 22 С 12 020 ТВычислено,7.: С 55,29; Н 4,25;В 5,37.Предлагаемые соединения испытаны на острую токсичность, анальгетическую активность по известной методике, противосудорожную активность - по5 тесту максимального электрошока и. коразоловых судорог, антимикробную активность методом последовательных разведений.Для определения бактериостатичес кой активности исследуемое вещество Растворяли в этиловом спирте в соотношении 1:100 и разводили мясопептонным бульоном (МПБ) до соотношения 1.:500. Бактериостатическую активность 15 изучали по отношению к эталонным штам-. мам золотистого стафилококка (грам.положительные бактерии) и кишечной палочки (грамотрицательные бактерии) . При этом использовали смыв суточнои культуры, выращенной на мясопептонном агаре, стерильным физиологическим раствором хлорида натрия и готовили исходное разведение с концентрацией 500 мпн. микробных тел в 1 мп смыва 25 по бактериальному стандарту, Полученную смесь разводили стерильным МПБ в 100 раз. Это разведение бактериальной культуры с концентрацией 5 он, микробных тел в 1 мп и было 30 рабочим раствором. 0,1 мл рабочего раствора вносили в 2 мл МПБ, содержащего соответствующее разведение исследуемого вещества. Таким образом,бактериальная нагрузка на 1 мл жид- кости составляет 250000 микробных .тел, Результаты .опытов учитывали после 18-20-часовой выдержки контрольных , и опытных пробирок в термостате при 36-37 фС. Регистрировали наличие роста бактериальных культур или отсутствие егд за счет бактериостатического действия препарата За действующую дозу принимали минимальную ингибирующую концентрацию (КЖ) препарата (в мкг/мп), которая задерживает рост, бактериальных культур.Результаты исследований представ-. ,пены в таблице, из которой следует: Оба предлагаемых соединения малотоксичны, однако уступают аналогу поструктуре.Предлагаемые соединения обладаютанальгетическимн свойствами, превышающими таковые аналоги по структурев 1,7 (для соединения 1) и в 1,3 (длясоединения 11). При этом соединенияиспытывали.в 2 раза меньшей дозе(1,5 от Що), чем аналог по структуре (2/5 от ЛД , ). У предлагаемых сое"динений пик анальгетического действия приходится на первые 30-60 мин,в то время как у аналога по структуре максимальный эффект наблюдаетсятолько через 3 чпосле введения препарата.Соединения 1 и 11 в отличие отаналога по структуре проявляют выраженную противосудорожную активность,при этом условная фармакологическаяширота (УФШ - ЛД 5 О/ЕД ) для соединений 1 и 11 по ТМЭ равна 5,4 и6,5; по коразоловому тесту - 7,5 и11,2 соответственно,Соединения 1 и 11, как и аналог поструктуре, в равной степени обладаютантимикробной активностью в отношении грамположительных и грамотрицательных бактерий.Таким образом, впервые синтезированные 1- (2,4 )-диметоксибензил 2-метил-(4 -хлорфенил)"4(ЗН)-хиназолинония и 1:-(3,4 )-диметоксибензил-метил-(4 -хлорфенил) -4(ЗН)хиназолинония, несмотря на некотороеувеличение токсичности по сравнениюс аналогом по структуре (перхлораты 1-бензил-метил-арил(ЗН)-хйназопинония) обладают более высокой анальгетической активностью,.йроявляющейся во вдвое меньшей дозе,чем у аналога,ро структуре, такимже антимикробйым действием, Изменения в химической структуре привепи кпоявлению нового вида активности -противосудорожной, которая у аналогапо структуре отсугствует.1110140 Биологическая активность перхлоратов 4(ЗН)-хиназолпнония Структурная формула Анальгетнческая акСоединения Острая токсичность 7 Ш,е мг/кг (внутрибрххщнномыпм) Антимикробная активПрстивосудорокная активность Тест максимального тивность ность злектровока Ии пинал ьная ннгибирумщая концентрация,мкг/мл Пик действиямин ВДзо мг/кг В.с с.игепв 0 111 80 349158 500 50 (91-135) (74-86) 600 С 10,69, с 1 о1гОС)(ОС)(3 20,818,67 500 500 Ананопоструктуре ет гибели дозах до Ве ак тнвен х В дозе 2/5 С. Титова Техред А,Крав орректор А.Об еда 46 Подписное а по изобретениям и открытиям при ГКНТ СССР Жз Раушская наб.д. 4/5 Заказ 31 Тир Государственного комитет 113035, Москва, Производственно-издательский комбинат "Патент", г.уагород, ул. Гагарина, 10"3,"Сь 19 Тест коразольных судорогедзомг/кг Время оборонительного рефлекса вдозе
СмотретьЗаявка
3554870, 17.02.1983
ПЕРМСКИЙ ГОСУДАРСТВЕННЫЙ ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ
ЧЕРНОБРОВИН Н. И, КОЖЕВНИКОВ Ю. В, МОРОЗОВА Г. Е, ЗАЛЕСОВ В. С, ПЛАКСИНА А. Н
МПК / Метки
МПК: A61K 31/517, A61P 29/00, C07D 239/91
Метки: 1-(2, 2-метил-3-(4, активность, анальгетическую, диметоксибензил, или, перхлораты, противомикробную, противосудорожную, проявляющие, хлорфенил)-4(3н)-хиназолинония
Опубликовано: 30.07.1991
Код ссылки
<a href="https://patents.su/5-1110140-perkhloraty-1-2-4-ili-3-4-dimetoksibenzil-2-metil-3-4-khlorfenil-43n-khinazolinoniya-proyavlyayushhie-analgeticheskuyu-protivosudorozhnuyu-i-protivomikrobnuyu-aktivnost.html" target="_blank" rel="follow" title="База патентов СССР">Перхлораты 1-(2, 4 )или (3, 4 )-диметоксибензил) -2-метил-3-(4 -хлорфенил)-4(3н)-хиназолинония, проявляющие анальгетическую, противосудорожную и противомикробную активность</a>
Предыдущий патент: Способ получения пентаэритрил-тетракис -(3, 5-дитрет бутил-4-оксифенил)-пропионата
Следующий патент: Сплав на основе никеля
Случайный патент: Устройство для сборки звеньев гусениц