Способ получения дифторметиловых эфиров спиртов или фенолов
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
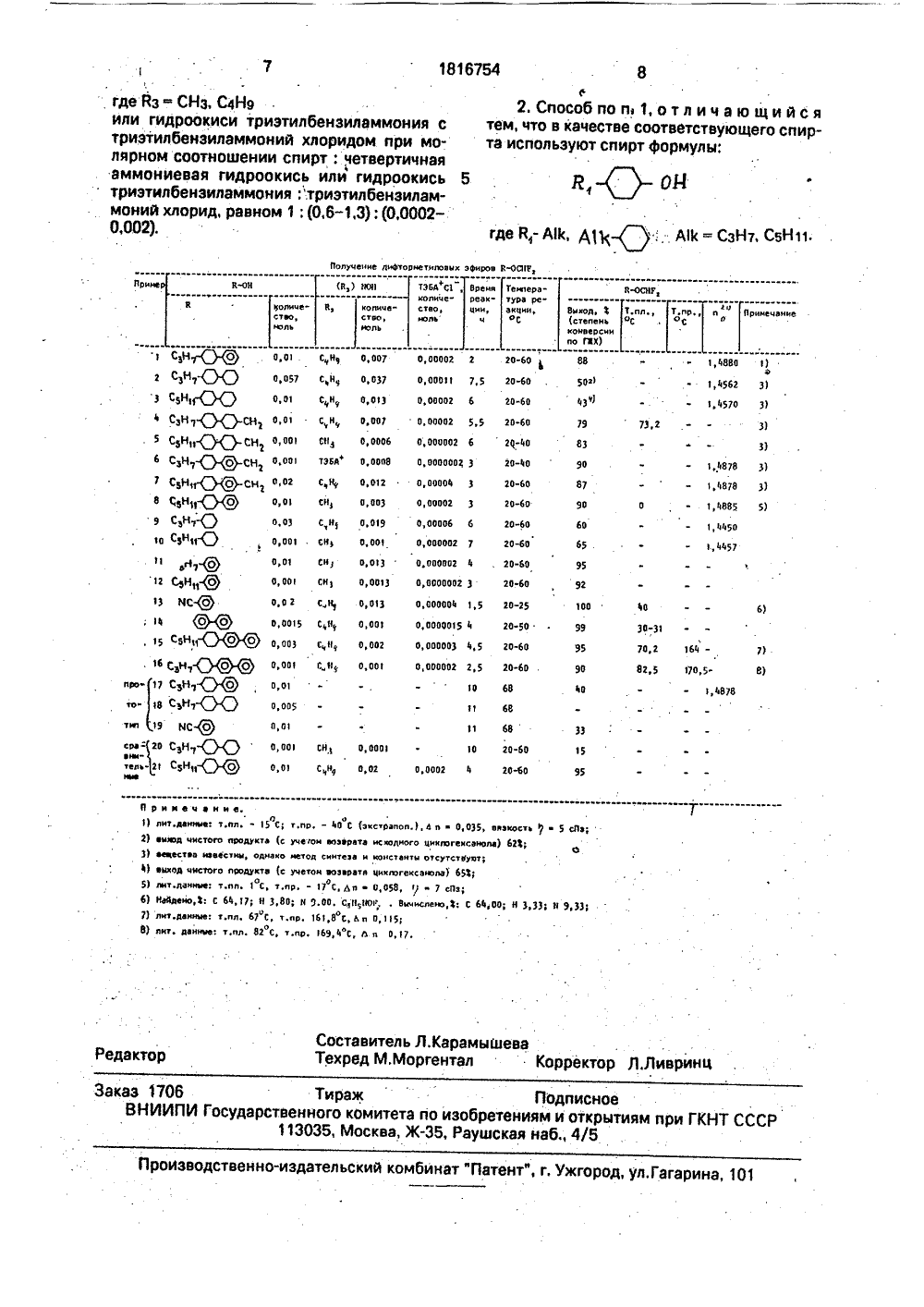
СООЭ СОВЕТСКИХСОЦИАЛИСТИЧЕСКИХРЕСПУБЛИК С 43/12, 41/14 ЕТЕНИ У водстеенное Гейвандов, А.Карамашеи С.И.Торгова Яос, 80, 3002,а, 25, 1966, р. ИФТОРМЕТИИЛИ ФЕНОе компоненпоэиций для . Сущность: лучения дифнолов общей т- компонент жидкокристалмяе и- лов спониженной вязкостью ной диэлектрической анизот Цель изобретения - повы целевого продукта, упрощен расширение ассортимента ко дукта. Эта цель достигается спос ния дифторметиловых эфиров фенолов общей формулыгде й 1=А бом получеспиртов ил и"ЧО А 11 с гдеА- ОСНР 2,где АВ= СзН 7, С 5 Н которые проявляют. жидкокристаллические свойства и находя применение в качестве О О ГОСУДАРСТВЕННОЕ ПАТЕНТВЕДОМСТВО СССР(54) СПОСОБ ПОЛУЧЕНИЯ ДЛОВЫХ ЭФИРОВ СПИРТОВЛОВ(57) Использование: В качествтов жидкокристаллических комэлектрооптических устройствусовершенстванный способ поторметиловых эфиров или фе Изобретение относится к усовершевованному способу получения дифтормловых эфиров общей формулы; 1816754 А 1 формулы й - ОСНГ 2, где й - низший алкил, циклогексил, Ай - СвН 1 е - СвН 1 о - СНг, АВСвН 1 о - СЬН 4 СЙ 2, й 1- СвН 1 о. где й - Ай. А 1 к -СвН 1 о, Й-Свйе, где; Й-СИ,АВ, АВ-СвН 1 о, АВ - СвНе, АВ - СвН 1 о - Свй 1 о, где АВ - СзН 7, С 5 Н 11, Реиент 1: хлордифторметан. Реагент 2: соответствующий спирт. Условия реакции: двухфазная система. температура 20- боф С, катализатор: смесь четввртичной аивгоиизвой гидроокиси фЩзъЩлъ 3 (ЯзОН, где Йз - Сйз, СФЬ, или гидроокись триэтилбензилэжмбйив с тризтюлбензиламмоии Й клоридом при молариом соотношении спирт: четвертичная аммониевав гидро- окись или гидрвжиаь триэтилбеизиламжоник триэтилбаизиламмонийхлорид, равном 1, (0,6 1,3), (О,ООО 2-0,0 ОЩ е оргэиическомраствомле. Выход целевого ародуктв до100 , Получены новые аирц цмклогексанола, 1 табл.где В 1- А, А 1 ( )Я О гдев 2-си,да,АЦс. ), А 11 с, Аа:( ЯС)где АВ = СзН 7, С 5 Н 11взаимодействием соответствующего спирта с хлордифторметаном в среде - органический растворитель 50 -ный водный раствор йаОН, используя гексан в качестве органического растворителя, в двухфазной системе при 20-60 С в присутствии межфазного катализатора - смеси четвертичной амониевой гидроокиси формулы П: (Йз)4 МОН, где Йз- СНз, С 4 Н 9 или гидроокиси триэтилбензиламмония с триэтилбензиламмоний хлоридом при малярном соотношении спирт; четвертичная а,ммониевая гидроокись или гидроокись триэтилбензоламмония; триэтилбензиламмоний хлорид, равном 1; (0,6 - 1,3): (0,0002 - 0,002).Отличительная особенность состоит в том, что в качестве органического растворителя игпользуют гексан и процесс ведут в двухфазной системе при 20-60 С в присутствии межфазного катализатора - смеси четвертичной аммониевой гидроокиси формулы И: (Йз)4 МОН, где Йз = СНз, С 4 Н 9 или гидроокиси триэтилбензиламмония с триэтилбензиламмоний хлоридом при малярном соотношении спирт: четвертичная аммониевая гидроокись или гидроокись триэтилбензиламмония: триэтилбензиламмоний хлорид равном 1: (0,6 - 1,3); (0,0002- 0,002).По предложенному способу получают и новые дифторметиловые эфиры в случае использования в качестве соответствующего спирта соединение формулы 1 Ид оЯгде Й 1=АВ,АИ-( ,АП( = СЗН 7, С 5 Н 11Изобретение иллюстрируется примерами 1 - 21 (табл, 1), ГЖХ анализ продуктов реакции осуществляют на приборе Цветс пламенно-ионизационным детектором, колонки длиной 1 - 2 м, неподвижная Фаза -5 Ж ХЕна СЬгоеатоп-М-Запрег и 5 ЗРна 1 пепоп-Зцрег, температура анализа 100 - 250" С, газ - носитель - азат. Строение вновь синтезированных соединений подтверждалось ЯМР спектрами (примеры 3, 5, 7).Температуры фазовых переходов жидкокристаллических продуктов определяют на приборе МеФег РРс поляризационным микроскопом. ИК-спектры измеряют на спектрофотометре "ЗЫтабщЙ" в тонком слое итаблетки КВг,Спектры ЯМР Н, 1 зС, "Р записаны на5 спектрометре "Впйег УЧМ".П р и м е р 1. Получение дифторметилового эфира 4 - (транс-пропилциклогексил)фенола.Через энергично перемешиваемую10 смесь 2,18 г(0,01 моль) 4- (транс-пропилциклогексил) фенола в 60 мл гексана, 30 мл50;4-ного водного раствора йаОН (0,4моль), 5,6 мл (0,007 моль) гидроокиси тетрабутиламмония (30;-ный водный раствор) икаталитического количества триэтилбенэиламмоний хлорида ТЗБАХ ( 0,2 мол. б )пропускают фреонсо скоростью, обеспечивающей максимальное поглощение, сначала - 1 ч при комнатной температуре, затем20 - 1 ч при температуре кипения. Продуктреакции анализируют методом ГЖХ.При полноте превращения 90 фреакционную массу охлаждают, разбавляют 50мл воды, экстрагируют гексаном 2 х 60 мл,25 гексановый раствор промывают водой 2 х 60мл, концентрируют и фильтруют через слой902, промывая гексаном, После отгонкирастворителя и перегонки получают 1,41 гчистого продукта 55 с ), т. кип. 132-133 С30 2-3 мм рт. ст., по 1,4885. Диэлектрическая2анизотропия Ле+ 5.9 (в изотропной жидкости).П р и м е р 2. Получение дифторметило-вого эфира транс- (транс- пропилцикло 35 гексил) циклогексанола,Через энергию перемешиваемую смесь12,74 г (0,057 моль) транс- (транс-пропилциклогексил) циклогексанола в 350 млгексана, 170 мл 50-ного водного раствора40 ИаОН ( 2 моль), 82 мл (0,037 моль) гидроокиси тетрабутиламмония (30 сводныйраствор) и каталитического количества ТЭБАХ ( -0,2 мол, с ) пропускают фреон сначала 0,5 ч при комнатной температуре,45 затем в течение 7 ч при температуре кипения. При увеличении времени пропусканияфреона полнота превращения исходногоспирта не меняется,Реакционную смесь охлаждают, выли 50 вают в 400 мл воды, отделяют гексановыйраствор, из которого при охлаждении выделяют фильтрованием 6,3 г исходного спиртаГексановый раствор продукта промывают,сушат над Ка 2 З 04, концентрируют и пропу 55 скают через слой 902, промывая гексаном,После отгонки растворителя выделяют 4,86г чистого продукта (62с учетом возвращенного исходного циклогексанола), по 21,4562. Вещество неустойчиво. При вакуумперегонке(нагревание) и при хранении(подгде Вт=с, Ам, АКА К-(:действием влаги воздуха) распадается с образованием НГ и формиата 4-пропилциклогексил циклогексанола.П р и м е р 3. Дифторметиловый эфиртранс-(транс-амилциклогексил) циклагексанола получен аналогично примеру 2 идемонстрирует аналогичные свойства, пп1,4570; полнота превращения исходногоциклогексанола - 48 %, выход чистого продукта - 65 0( с учетом возвращенного исходного спирта),ИК спектр, Р (пленка): 2920, 2850, 1440,1380, 1260, 1125, 1070, 1010. Н ЯМ Р (СОС 1 з; д )- 6,23 (т, 1 Н, Лн - г = 76 Нг, СН Г 2); 3,97 (м, 1 Н;СНО);2,2 - 0.7(м,ЗОН)." Г ЯМР;-80,1(д,2 Г, 151 Г 19- н 1= 75.9 Нг).Оптическая анизотропия Лп 0.002, диэлектрическая анизотропия Ля +2,6(в смесиЕ 1 1 - 3086), + 4,0 - в изотропной фазе,Вещество неустойчиво, при контакте с 20влагой воздуха и кислотными агентами гидролизуется с образованием формиата; т. пл.42 С (из ацетона);ИК-спектр ах (вазелиновое масло);см: 1730, 1190, С ЯМР (СОС 1 з, д): 160,74 25(м,1 Н, Н - О); 2,1 - 0,7(м,26 Н).П р йм е р 5. Дифторметиловый эфиртранс- (транс-амилциклогексил) циклогексилметанола получен аналогично примеру 2 (см. таблицу), т. пл. 73-74 С. 35Н ЯМР (СОС 1 з, д ) 6,15(т,Н 3 = 76.1 Нг, СНР 2); 3,65 (1, 2 Н 1 = 6,26 Нг; СН 20);2,0 - 0 7 (м, 27 Н),С ЯМР (СОСЬ, д ); 116.4(т, 11 зс-юг)(2.3 (20 С), оптическая анизотропия Лп0,048 (20 С, 589 нм), т. пр 48 экстр,П р и м е р 7. Дифторметиловый эфир 4(транс-амил циклогексил) фенилметанолаполучен аналогично примеру 1 (табл. 1) свыходом 87, жидкость, по 1,4878. Диэлектрическая анизотропия Ле + 8.0 (200);оптическая анизотропия Ьп 0.054 (200,589 нм); Т. пр. экстр, расчет из смеси с 21 1- 1132(10 ) = 11 С,Условия получения заявляемых дифторметиловых эфиров, выход, константы- представлены также в примерах 4, 6, 8 - 16 (см.таблицу), примеры 17-19 - получение дифторметиловых эфиров в условиях прототипа,В примерах 20, 21 иллюстрируется нецелесообразность применения соотношения реагентов, выходящих за пределы заявляемых; уменьшение межфазного катализатора приводит к уменьшению выхода продукта, увеличение - не приводит к изменению выхода, но удорожает процесс, Пограничный температурный интервал процесса ограничен температурой кипения гексана.Таким образом, предлагаемый способ получения дифторметиловых эфиров спиртов и фенолов позволяет:повысить выход соответствующих производных фенолов с 40 % (по прототипу) до 90 - 100 , в том числе получать малоустойчивые в щелочной среде производные - ицианофенола, которые легко подвергаются гидролизу по циано-группе, и в условиях прототипа (пример 19) получаются с незначительным выходом (ЗЗ );упростить технологию, в том числе уменьшить температуру и продолжительность фреонирования, что делает процесс более экологически чистым;расширить возможности способа - синтезировать дифторметиловые эфиры циклогексанолов, которые оанее не были получены,Формулы изобретения 1, Способ получения дифторметиловых эфиров спиртов или фенолов общей Формулы:В-ОСНГ 2,где К - А 1 щ)-, )-СН,АК ( .СН;,где й =Аад,. р Яг 2 l где АВ = СзНт, С 5 Н 11, взаимодействием соответствующего спирта с хлордифторметаном в среде - органический растворитель - 50 -ный водный раствор йаОН, о т л и ч аю щ и й с я тем, что, с целью повышения ьыхода целевого продукта, упрощения процесса, расширения ассортимента конечного продукта, в качестве органического растворителя используют- гексан и процесс ведут в двухфазной системе при Температуре 20- 60 С в присутствии межфазного катализатора - смеси четвертичной аммониевой гидроокиси формулы82. Способ по пз 1, отл ич а ю щи йся тем, что в качестве соответствующего спирта используют спирт формулы: 1816754 где йз" СНз, С 4 Н 9или гидроокиси триэтилбензиламмония с триэтилбензиламмоний хлоридом при молярном соотношении спирт: четвертичная аммониевая гидроокись или гидроокись триэтилбензиламмония триэтилбензиламмоний хлорид, равном 1: (0,6-1,3); (0,0002- 0,002). Я, ОЙ гдв Н,. АИс, А 11 Ч У, - Азс - Сэнт, СИН с с. Получение дифторнетиловык зоиров Е ОсТз Приме ТЭБА Сколиче"стао,юль Врени реакции,ч Н ОСНУз Т,пл Т,пр, оС Температура реакции,оС В-ОН зоп Примечание о Вывод, В,00 001 СН 20-60 0,00 Примечание. 1) лиг.данныез т.пл. 5 С; т.пр, - 40 С (зкстрвпол,), а и0,035, внзкта (с учетом возврата исколного циклогексанола) 6однако метод синтеза и константы отсутстеуетдукта (с учетон возврата циклзгексанола) 65211 С, т,пр. - 1 У С, Ьп0,058, г/ д У сПз;о о; Н 3,801 Н 9.00. С;НтЮсг, , ВычнслеюсФс С 64,00;67 С, т.пр. 161,8 С, А и 0,115182 С, т,пр, 169,4 С, д п О, 17. снз 1 каст 221 2) аыюд чис3) еасавстеа4) еыкод чнс ого иродуизвестны,оп лит.данные: т.п Наддено,Вс С 64 331,3 7) лит,данные: т,пл.8) лиг. данныес т.пл Редактор Заказ 1706 Тираж Подписное ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР 113035, Москва, Ж, Раушская наб., 4/5 роизводственно-издательский комбинат "Патент", г, Ужгород, ул.Гагарина, 101есэн У.Я2 СЭНТ-ОО) 3 с,н-О(О Сэ)7 О(О-сн 2 сон 1 ДчО- сн, 6 сэн 7.( ,-снСВН 11-(О-СН 2 8 С,н-( Яо)СБНт О 10 СВН 1 Оаг(7 О СЭ Сон. 13 В(с. , 4 Що) 5 СЭН 1 Дь(О 16 СЭНТ( Я) про 17 СВН 7( Щ то СЭН 7-(о о)т ТВ )ОСЕ Составитель Л.КарамышеваТехред М,Моргентал Корректор Л,Ливринц
СмотретьЗаявка
4884165, 21.11.1990
МОСКОВСКОЕ НАУЧНО-ПРОИЗВОДСТВЕННОЕ ОБЪЕДИНЕНИЕ "НИОПИК"
АГАФОНОВА ИРИНА ФЕДОРОВНА, ГЕЙВАНДОВ РУБЕН ХРИСТОФОРОВИЧ, ДАХНОВ ПЕТР ПАВЛОВИЧ, ИГНАТЕНКО АНАТОЛИЙ ВИКТОРОВИЧ, КАРАМЫШЕВА ЛЮДМИЛА АЛЕКСЕЕВНА, ПЕТРОВ ВЛАДИМИР ФЕДОРОВИЧ, ТЕРЕХОВА ВЕРА ФИЛИППОВНА, ТОРГОВА СОФЬЯ ИСААКОВНА
МПК / Метки
МПК: C07C 41/14, C07C 43/12
Метки: дифторметиловых, спиртов, фенолов, эфиров
Опубликовано: 23.05.1993
Код ссылки
<a href="https://patents.su/4-1816754-sposob-polucheniya-diftormetilovykh-ehfirov-spirtov-ili-fenolov.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения дифторметиловых эфиров спиртов или фенолов</a>
Предыдущий патент: Способ получения транс-4-(транс-4-н-алкилциклогексил)-1 алкоксициклогексанов
Следующий патент: Способ получения монохлоруксусной кислоты
Случайный патент: Микромоментомер