Способ получения n-нитрозо-n-(бета-хлорэтил) карбамоилпептидов или их солей
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
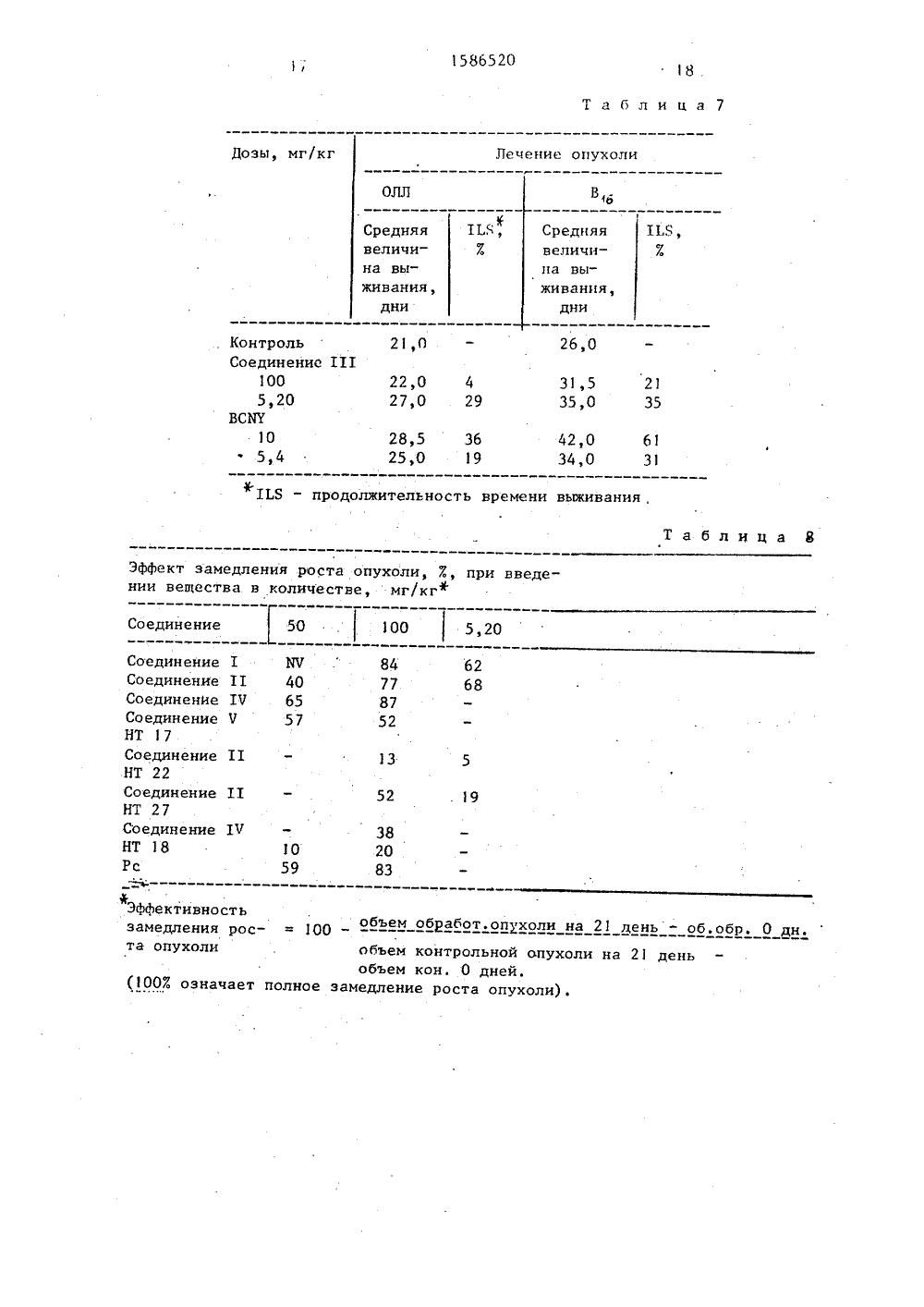
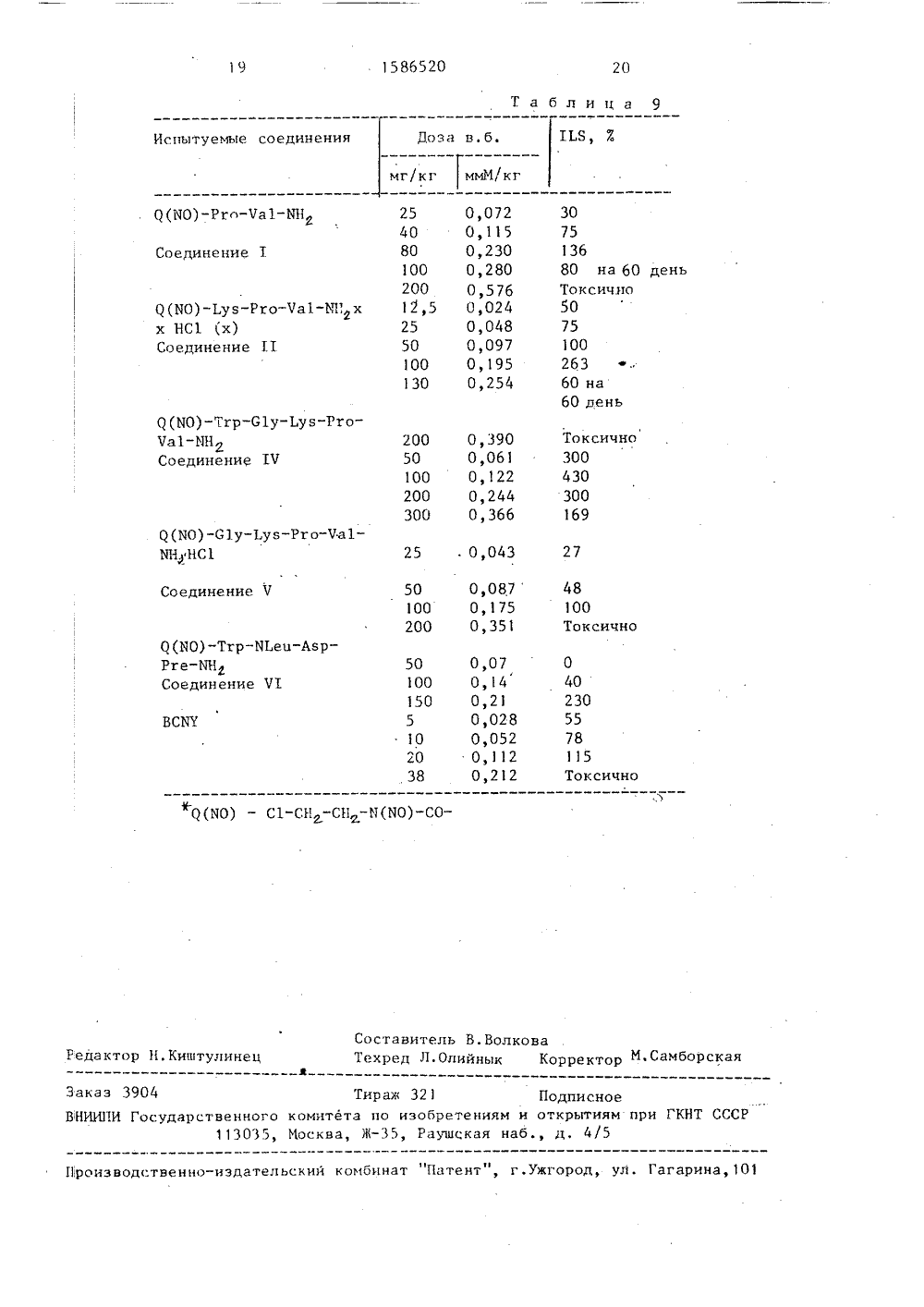
, 1586520 РЕТЕНИЯ К ПАТЕНТУ меке зихрадсй Лапиш(57) Изобретение о дам в частности к осится к дипепт олучению произГОСУДАРСТВЕННЫЙ НОМИТЕТПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМПРИ ГКНТ СССР ОПИСАНИ 1(71) Хиноин Дьйдьсер еш ТерДьяра. РТ (Н 11)(54) СПОСОБ ПОЛУЧЕНИЯ И-НИТРОЗО-Бв (БЭТА-ХЛОРЭТИЛ)-КАРБАМОИЛПЕПТИЛРВИЛИ ИХ СОЛЕЙ Изобретение относится к способу .получения И-нитрозо-И.-(бэта-хлорэтил)- карбамоилпептидов или их солей - новых биологически активных соединений, которые могут найти применение в медицине.Цель изобретения - способ получения новых производных М-нитрозо-Б- -(бэта-хлорэтил)карбамоилпептидов, обладающих более высокой противоопухо левой активностью. 51)5 С 07 К 5/06, 5/08, С 07 К 5/10 //А 61 К 37/02 водных М-нитрозо-И-(бэта-хлорэтил) . карбамоилпептидов ф-лы 1С 1 СНгСНгИ(ИО)СО%Д 1, й, где и = 1,2;К в -Рго-Уа 1 УНг, -Ьуя-Рго-Ча 1 ИНг, -С 1 у-Ьуя-Рго-Ча 1 ИНг, -Тгр-С 1 у-Ьуя-Рго-Ча 1 ИН, -Тгр-Ьец-Аяр-РЬеИНг,или их солей, которые обладают противоопухолевой активностью Цель - разработка способа получения более активных соединений указанного класса. Получение ведут реакцией пептидов ф-лы: ХНЫ-К, где Х - Н или ВОС, К - имеет укаэанные значения с активированным сложным эфиром ф-лы С 1-СН -СН -И(ИО)- г г -СО-Я, где Я-п-нитрофенил,галогенфенил, оксисукцинимид или фталимидооксигруппа, причем при получении соединений ф-лы 1,где п = 1, используют эквимолярные количества исходных, если п = 2, исходные продукты берут в молярном соотношении 1:2 с последующим снятием в случае необходимости защитных групп и выделением целевого продукта в свободном виде или в ниде соли. 9 табл. Хроматографию проводят в тонком слое кизельгеля С (фирмы Мерк) в сл дующих системах растворителей: А - хлороформ:метанол 9:1; Б - н-бутанол:ледяная уксусная кислота:вода 4:1:1; В в хлорофо: метанол 8:2, Г - этилацетат:пиридин:ледяная уксусная кислота:вода 60:20:б:11 1 Д - этилацетат:пиридин:муравьиная кислота:вода 60:20:6-5,5; Е - метанол;этилацетат 1:3; Ж - этилацетат:1586520 20 Таблица 9 1 ЬБ, % Доза в.б. Испытуемые соединения мг/кг ммМ/кг 0 (ЧО) -Рго-Ча 1-11 НСоединение 1 0(Ю)-1.ув-Рго-Ча 1-%1 хх НС 1 (х)Соединение ТТ Ц(Ю)-Тгр-С 1 уув-РтоЧа 1-МНСоединение 1 Ч Токсично 300 430 300 169 200 0,390 50 0,061 100 0,122 200 0,244 300 0,366 0(Ю)-С 1 у - Еуя - Рто-Ча 1 -НН, НС 1 27 25 . 0,043 Соединение Ч 48100Токсично 50 0,087100 0,175200 0,351 ч(Ю)-Ттр-НБеп-АврРте-ИНСоединение ЧТ 50 0,07 100 0,14 150 0,21 5 0,028 10 0,052 20 0,112 38 0,212 ВСАТ М.0(Ю) - С 1-СН,-СН,-И(Ю) -СОСоставитель В.ВолковаТехред Л.Олийнык Корректор М,Самборская Редактор Н.Киштулинец Заказ 3904 Тираж 321 ПодписноеВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР 113035, Москва, Ж, Раушская наб., д. 4/5 Производственно-издательский комбинат Патент", г.ужгород, ул, Гагарина,101 25 40 80 100 200 11,5 25 50 100 130 0,072 0,115 0,230 0,280 0,576 0,024 0,048 0,097 0,195 0,254 307513680 на 60 деньТоксично507510026360 на60 день 0402305578115Токсично:пиридин:ледяная уксусная кислота: :вода 240:20:6:11.П р и м е р 1. И-Нитрозо-И-Щ- -эхлорэтил)-карбамоил-пролилвалинамид (1).1,37 г (5 ммоль),пролил-валинамидацетата суспендируют в 15 мл безводНого диметилформамида и добавляют Нри перемешивании и охлаждении сне"ом 1,4 мл (10 ммоль) триэтиламина1,25 г (5 ммоль) сложного И-нитроо-М-( Д -хлорэтил)-карбаминовая кисота-Б-окси-сукцинимидного эфира. еакционную смесь перемешивают 15 мин при 0 С, затем разбавляют, ледяной воой, выпавший в осадок продукт от-;: ильтровывают, промывают холодной одой на фильтре. Продукт сушат в экикаторе над РаО . Выход 0,91 г (53%), т.пл. 130"С (разложение),КЙ0,8 (В), Я = 88 (И-нитрозогруппа, 400 нм).Вычислено, : С 44,85; Н 6,331 С 1 10,19; Н 20,13, С1 ИО С 1 (347, 8) . Найдено, : С 4,83; Н 6,35; С 1 9,86; И 19,76.,П р и м е р 2. а) Альфа-Н-нитроо-И-(бэта-хлорэтил)-карбамоил-эпсион-трет.бутилоксикарбонил-лизил-проил-валинами.614 мг (1 ммоль) эпсилон-трет.бу- токсикарбонил-лизил-пролилвалин-амид-тозилата растворят в 10 мл безводного диметилформамида, после чего в ,приготовленный раствор добавляют 0,14 мл (1 ммоль) триэтиламина, 274 мг (1 ммоль) И-нитрозо-бэта-хлор-этилкарбамоил-и-нитрофенола и 136 мл (1 ммоль) 1-оксибензотриазола. Через 2 ч диметилформамид отгоняют в вакууме, остаток растворяют в 30 мл этилацетата и промывают водой. Этилацетатный слой отделяют, высушивают, упаривают. Остаток обрабатывают безводным диэтиловым эфиром, эфирный слой отделяют декантацией, масло высушивают.Полученную при этом твердую пеиучистят в колонке, заполненной силикагелем, Фракции собирают, Г:створитель отгоняют в вакууме. Остаток растирают в порошок в присутствии безводного петролейного эфира, фильтруют.Получают 250 мл (43 ) соединения, КГ 0,90 (А)р КГ 0,80 (Б) Я90(Б-нитрозогруппа, 397 нм). Вычислено,: С 1 6,15; И 17,02.С 4 Не 1 И гО 7 С 1 (5 76, 1 О) .Найдено,7: С 1 6,00; Б 16,61,5б) Альфа-И-нитрозо-Б-(бэта-хлорэтил)-карбамоил -лизил-пролил-валинамидгидрохлорид (11).200 мг альфа-Ю -нитрозо-И-(бэта-хлбрэтип)-харбамаип-элеилаи- грет.бутоксикарбонил-лизил-пролил-валинамида смешивают с 6 мл 0,17 н. Раствора муравьиной кислоты в соляной кислоте и раствору дают постоять в течение 5 мин с последующим его выпариванием. Остаток растворяют в воде иэкстрагируют этилацетатом. Водныйслой отделяют и лиофилизируют. Получают 140 мг соединения, КЕ 0,10 (Б).Вычислено, : С 44,49; Н 6,83;С 1 13,84; М 19,13.С пч Н р И,О С 1,2 (512,44) .Найдено,7.: С 44,51; Н 6,80;С 1 13,72; М 18,81П р и м е р 3. Альфа-эпсилон-бис-Б-нитрозо-И-(бэта-хлорэтил)карбамоил 1-лиэил-пролил-валинамид (111).460 мг (1 ммоль) лизил-пролил-валинамиддиацетата растворяют в6 мл,диметилформамида, затем в полученный раствор добавляют 0,28 мл(2 ммоль) 1-оксибензотриазола, через352 ч диметилформамид отгоняют в вакууме, остаток Растворяют в 30 мл этилацетата, промывают водой. Этилацетатный слой отделяют, сушат, упаривают,Остаток обрабатывают безводным диэти 40 ловым эфиром эфир отделяют декантацией, масло сушат. Полученную твердую пену чистят в колонке, заполненной силикагелем. Фракции собирают,растворитель отгоняют в вакууме. Остаток растирают в порошок в присутствии безводного петролейного эфира,фильтруют. Получают 312 мг (51 ) продукта, Кй 0,80 ( Я), Кй 0,88,185 (Б-нитрозогруппа, 397 нм).Вычислено,%: С 43,17; Н 6,05;50 С 1 11,59; И 20,61.Сд НзуМО 7 С 1 г (6 1 1, 51 ) .Найдено, : С 43,21; Н 6,02;С 1 11,18; Б 20,07 эП р и м е р 4. а) р - И-Нитрозо-Б-(3-хлорэтил)-карбамоил-Е-третичный бутилоксикарбонил-триптофил-глицил - лизил-пролилвалинамид,1 г К смешанному раствсру из 1,2 г( 1,74 ммоль) третичн.бутилокспкарбонил-триптофенилглицил-лизил-пролилвалинамида и 10 мл безводного диметилформамида добавляют при 0 С 0,24 мл1,74 моль ) триэтиламина и 400 мг(1,6 ммоль) И-нитрозо-И-(-хлорэтил)-карбамоил-Н-оксисукцинимида. Через0,5 ч реакционную смесь упаривают, остаток растворяют в этилацетате, раствор промывают водой. Органическийслой отделяют, сушат над безводнымсульфатом натрия, упаривают. Выход,2 г (857), КГ = 025 (А).Вычислено, : И 17,09 С 1 4,33.СНз 11 юОС 1 (81937).Найдейо,7: М 16,72; С 1 4,01,б) б-М-.Нитрозо-й-( -хлорэтил)-карбамоил 1-триптофил-глицил-лизил-пролил-валил-амидоацетат (17).819 мг (1 ммоль) ф,-И-нитрозо-(Р-хлорэтил)-карбамоил-третичн,бутилоксикарбонил-триптофил-глицил-лизил-пролил-валинамнда растворяютв 10 мл 0,12 н. муравьиной кислоты с хлористоводородной кислотойотстаивают раствор 5 мин затем раствор упаривают в вакууме, Остатокрастворяют в воде, экстрагируют этилацетатом, Водную фазу отделяют, лиофилизуют, лиофилизат чисят хроматографией на колонке, заполненной силикагелем, элюируют смесь этилацетата, пиридина, ледяной уксусной кислоты и воды 60:20:6:11. Элюат упаривают. Остаток растворяют в воде, лиофилизируют, получают 480 мг (637)соли заглавия. КЕ = 0,25 (1);90 (50 нм) .Вычислено,Х: С 52,4 О; Н 6,59;О 18,47; И 17,97, С 1 4155.Сэ 4 Нр Нр ОсС 1 (779 27) .Найдено,Ж: С 52,00; Н 6,29;0 18,01 М 17,00; С 1 446. П р и м е р 5. а) Альфа-Н-нитрозо-Ю-(бета-хлорэтил)-карбамоил-эпсилон-трет.бутилоксикарбонил-глициллизил-пролил-валинамид,1,30 г (2 6 ммоль) эпсилон-трет.бутилоксикарбонил-глицил-лизил-пролил-валинамида растворяют в 13 млабсолютированного диметилформамида,Гв раствор добавляют 650 мг (2,6 ммоль)И-нитрозо-бэта-хлорэтилкарбамоил-Б"-оксисукцинимида и 0,36 мл (2,6 ммоль)триэтиламина. После перемешивания вЪтечение 15 мин реакционную смесь вы 86520паривают в вакууме. Остаток растворяют в этилацетате и промывают водой,Этилацетатный слой отделяют, сушати выпаривают. 11 олучают 1,29 г (807)5продукта. Кй 0,82 (В), Я = 91(И-нитрозная группа, 397 нм)Вычисле,но,7.: С 1 5,60; Н 17,69,С 6 Н 45 Ъ 06 С 1Найдено,7: С 1 5,48; Н 17,31.б) Альфа-М-нитрозо-И-(бэта-хлорэтил)-карбамоил-глицил-лизил-пролил-валинамидгидрохлорид (7).633 мг (1 ммоль) альфа-Б-нитрозо-И-(бэта-хлорэтил)-карбамоил-эпсилон-трет.бутилоксикарбонил-глицил-лизил-пролил-валинамида выдерживают вспокойном состоянии в течение 5 минв 10 мл 0,14 н. раствора муравьиной20 кислоты в соляной кислоте, а затемраствор выпариваютОстаток растворяют в воде и экстрагируют этилацетатом. Водную фазулиофилизуют. Получают 540 мг (952)25 продукта, КГ = 0,65 (Р),= 84(1,5 ммоль) триптофил-норлейцил-альфа-аспарагил-фенилаланиламид-40 гидрохлорида, 0,21 мл 1,5 ммоль)триэтиламина, 420 мг (1,5 ммоль)И-нитрозо-бета-хлорэтилкарбамоил - -и-нитрофенола и 200 мг (1,5 ммоль)1-оксибензтриазола. Получают 800 мг45 соединения, выход 753, КК = 0,8 (Б).Вычислено,Е: С 55,52; Н 5,75;С 1 4,97; И 15,71; Ю 4,20.СН 4 И ОС 1 (713,20).Найдено, : С 55,50 Н 5,77,50 С 1 4,58; М 15,32; МО 3,92.Испытание А. Фармакологическаяактивность предлагаемых соединенийдемонстрируется результатами испытаний с использованием в качестве ис 55пытуемых соединений 0 Я-бисМ-нитЭ арозо-И- (-хлорэтил) -карбамокл -лизил-пролил-валинамида (на который далеев тексте ссылаются, как на соединение 11) и О( -М-нитрозо-М-(Р-хлор 1586520атил)-карбамоил-лизил-пролил-валинамид гидрохлорида (на которое далее втексте ссьлаются, как на соединение111).В табл,1 показано влияние соедине 5ний 11 и 111 на внутрибрюшинно имплантированную мьппам Ьлейкемию .Соединения 11 и 111 оказались болееактивными, чем 1,3-бис-(Я-хлорэтил)- 1 О-1-нитрозомочевина (далее обозначеную как ВС 11 У) и 2-13-(2-хорэтил)-3 итроуреицо 1-2-деокси-глюкопираноза (далее обозначенную как хлорозотиин), используемые в качестве сравниельных веществ (см.табл.1).Опухолевый прививочный материал0" асцитных клеток, внутрибрюшинно;животное-хозяин - самки мьппей видаРГ; лечение - 3 дня; токсичность "1 а пятый день 4/6 остаются в живых;оценка - МБТ-средний период.вьживания;МБТ обработанной группыМБТ контрольной группых 100; критерий - Т/С .25, значитель 25ная противоопухлевая активность.В табл.2 приведены фармакологические свойства соединения 111,Фармакологические свойства соединения 111.Токсическая доза 13300 мг/кг внутрибрюшинно. Веществоприменяли на мьппах, зараженных Ь см.табл.2-7).В табл,З приведень результаты исСледования связи между эффектом и 35имической структурой соединений,налогичньх соединению формулы (11),а мышах, зараженных лейкемией Ь.ЪРезультаты влияния соединений форЙуль (11) на выживание мьппей, заракенньх лейкемией Ьприведены втабл.4.В табл.5 приведены результатывлияния соединений формулы (11) в комбинации с фармацевтическими агентами 45на мышей, зараженных лейкомией Ь.Приведенные вьппе данные показывают, что новые пептидные производныеФормул 11 и 111 значительно более активны и менее токсичны, чем ВСНК.и 50хлорозотицин, используеме в качест-ве контрольных агентов,Испытание В. Исследовано влияниесоединения 11 на твердую опухоль.А) Б 180 опухоль (подкожно).Дозировка 100 или 5 х 20 мг/кг внутрибрюшинно (лечение начиналось на следующий день после трансплантации)оказалось неэффективной. В) Легочная меланома Льюиса и ме - ланома В - опухоли, дающие на мышах метастазы (.,ш.)Результаты приведены в табл.б.Испытание С.Фармакология.Влияние пептидо-нитрозомочевиновых производных на рост экспериментальных твердых опухолей и опухолевых ксенографтов человека.Объекты:а) экспериментальная твердая опу-,холь мыши Б 180, легочная опухольЛьюиса и меланома мыши В 1 ,в) человеческие опухолевые ксенотрансплантаты; беспигментная меланола НТ 18, колоректальная аденокарцинома НТ 17, колоректальная аденокарцинома НТ 22 (муциноз кожи),карцинома поджелудочной железы НТ 27.Опыты на экспериментальных твердых опухолях; Б,Опухоль разрезают на маленькиекусочки и кусочки пересаживают подкожно под кожу, спины мышей СЬЕРР, Лечение начинают на следующий день после транСплантации. Размер опухолейизмеряют при помощи кронциркуля и ихобъем рассчитывают от их диаметра.Соединение БЧЗО вводят внутрибрюшинно при дозах 100 или 5 х 20 мг/кг(одна доза на пять дней). Влияния нарост опухоли не обнаружено.Опухоль легкого по Льюису (ОЛЛ).Эту опухоль пересаживают в видесуспензии клеток в бедренную мьппцу инбредной мыши С 57 В 1 с количествомклеток 10 . Растущая опухоль дает ребгулярные метастазы легкого. Лечениеначинают на следующий день после трансплантации, Наблюдают выживаемостьобработанных и контрольных животных.Меланома В 6.Опухоль пересаживают под кожу спины инбредной мыши С 57 В в виде кусочков опухоли. Растущая опухоль дает метастазы в легком. Лечение и оценкупроводят аналогичным способом, какописано в случае опухоли легкого поЛьюису.В соответствии с результатами соединение БЧ 370 умеренно удлиняет продолжительность жизни животных включаяслучаи ОЛЛ и В 6 меланомы, Порядок эффективности замедления роста опухоли в основном равен эффекту ВСИУ,применяемому как контрольное соединение1586520 Т а блица 1 МЯТ эфФективность7, Т/С МЯТ, дни Число жилых мышейк 5-му дню Средняяпотеряв весе на5 день, гКонтроль Обе мыши больны. Таблица 2 ЬЛ, Е Число выживших животных через 40 дней,Е Дозировка,мг/кгВн.брюш. 80Вн.брюш. 150Вн.брюш.Токсично Зх 10Зх 501 х 1331 х 200 50 П р и м е ч а н и е: Токсическая доза 133-200 мг/кгвнутрибрюшинноВещество применяли на мышах, зараженных.Ь в 12,Таблица 3 Доза, Выживание мг/кг животных,Е Соединение Ч Я(ИО)Тгр 61 уЬузРтоЧаМН. 17 028 10 46 50 100 Токсично Ч Я(10)СуЬузРгоЧа% НС 1 15 20 45 10 100 35 150 230 Испытуемое соединение Доза Р,мг/кг 47,0 47,0 10,5Дни Лечение, доза мг/кг 50 87 44 33 45 80 250 00 1 х 12,51 х 501 х 331 х 251 х 251 х 100Зх 0Зх 504 х 10 1112331,5,9 1,5,9 1,2,5,6 40 ФВнутрибрюшинно,применение в отмеченный день после трансплантации;выживание обработанных мышей - Ф тоже обоаботанных1 Ы -ее- хвремя выживания необработанных мышей х 100Выживание на 60-й день после трансплантации. Таблица 5 1 ЬЯ,р 1 Соединениеи/п Доз а, мг/кг Выживание, 7. дниЕ 125 1 50 500 1 87 5 1 25 20 1 110 1 112 113 ВСИУ4 ВСАТ5 Лечение соответствует 2+3 6 Лечение соответствует 1+4 7 118 Циклофосфамид 9 Дибромдульцит 10 ВСАТ11 Лечение соответствует 7+8 12 Лечение соответствует 7+9 13 Лечение соответствует 7+10 14 1115 ВСНК16 Лечение. соответствует 14+15 325 3254.444077 1 х 25 2 1 х 50 2 1 х 50 2 1 х 10 2 77 4470 1 х 50 1 х 20 3 33 3 70 606 1586520 Т а блица 6 Лечение опухоли ПЯ,7 Средняя длительность выживания,дни Дозы при внутрибрюшинном введении, мг/кг Льюиса 21,0 22,0 27,0 Контроль1005 х 20ВСМУ205 х 4 429 28,5 25,0 В меланома26,0 31,5 35,0 36 19 Контроль1005 х 20ВСАТ205 х 4 21,535 Контроль1005 х 20 0,0 0,0 П р и м е ч а н и е, Время лечения: при достиженииобъема опухоли примерно 8 мм,Метод лечения: внутрибрюшинно;ТД = удвоение объема опухоли;ТДке- ТД коСД = задержка роста = Ке - обработанные; Ко - контроль,42,0 6134,0 31Опухолевые ксенографты человекаНТ 18 (амеланотическая меланома) Контроль - среднее значение ТД 22,5100 50,0 СД =,Ы,О 5 х 20 56,25 1,5НТ 22 (слизистая карцинома толстойкишки)Контроль 7100 24,0 0,29 5 х 20 21,5 0,26НТ 17 (аденоматозная карциноматолстой кишки)16,514,755,01586520 Таблица 7 Лечение опухоли Дозы, мг/кг В,. 11,(, Средняя % величиСредняя величипа вына выживания,дни21,0 - 26,0 КонтрольСоединение П 11005,20ВСНК105,4 21 35 22,0 4 31,5 27,0 29 35,0 28,5 36 42,0 25,0 19 34,0 61 31 Таблица 8 Эффект замедления роста опухоли, Е, при введении вещества в количестве, мг/кг+ Соединение 50 . 100 5,20 1 НЧ 11 40 1 Ч 65 Ч 57 84 77 87 52 62 68 52 1 Ч10 59 38 20 83 ФЭффективностьобъем обработ.опухоли на 21 день - об.обр. 0 дн.та опухоли объем контрольной опухоли на 21 деньобъем кон0 дней.(1007. означает полное замедление роста опухоли). СоединениеСоединениеСоединениеСоединениеНТ 17СоединениеНТ 22СоединениеНТ 27СоединениеНТ 18Рс 1 Ы - продолжительность времени выживания
СмотретьЗаявка
3697502, 31.01.1984
Хиноин Дьёдьсер еш Термекек Дьяра. РТ
ХЕЛГА ШЮЛИ, КАЛЬМАН МЕДЗИХРАДСКИ, ХЕДВИГ МЕДЗИХРАДСКИ, КАРОЙ ЛАПИШ, ЛАСЛО КОППЕР, АНДРАШ ЙЕНЕЙ
МПК / Метки
МПК: C07K 5/078, C07K 5/09, C07K 5/117
Метки: n-нитрозо-n-(бета-хлорэтил, карбамоилпептидов, солей
Опубликовано: 15.08.1990
Код ссылки
<a href="https://patents.su/10-1586520-sposob-polucheniya-n-nitrozo-n-beta-khlorehtil-karbamoilpeptidov-ili-ikh-solejj.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения n-нитрозо-n-(бета-хлорэтил) карбамоилпептидов или их солей</a>
Предыдущий патент: Способ получения пропиленгликолевого эфира замещенной 1, 4 дигидропиридил-5-фосфоновой кислоты или его фармацевтически приемлемой соли, или сольвата
Следующий патент: Способ получения производных гликопептидов
Случайный патент: 163428