Способ определения -амилазы
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
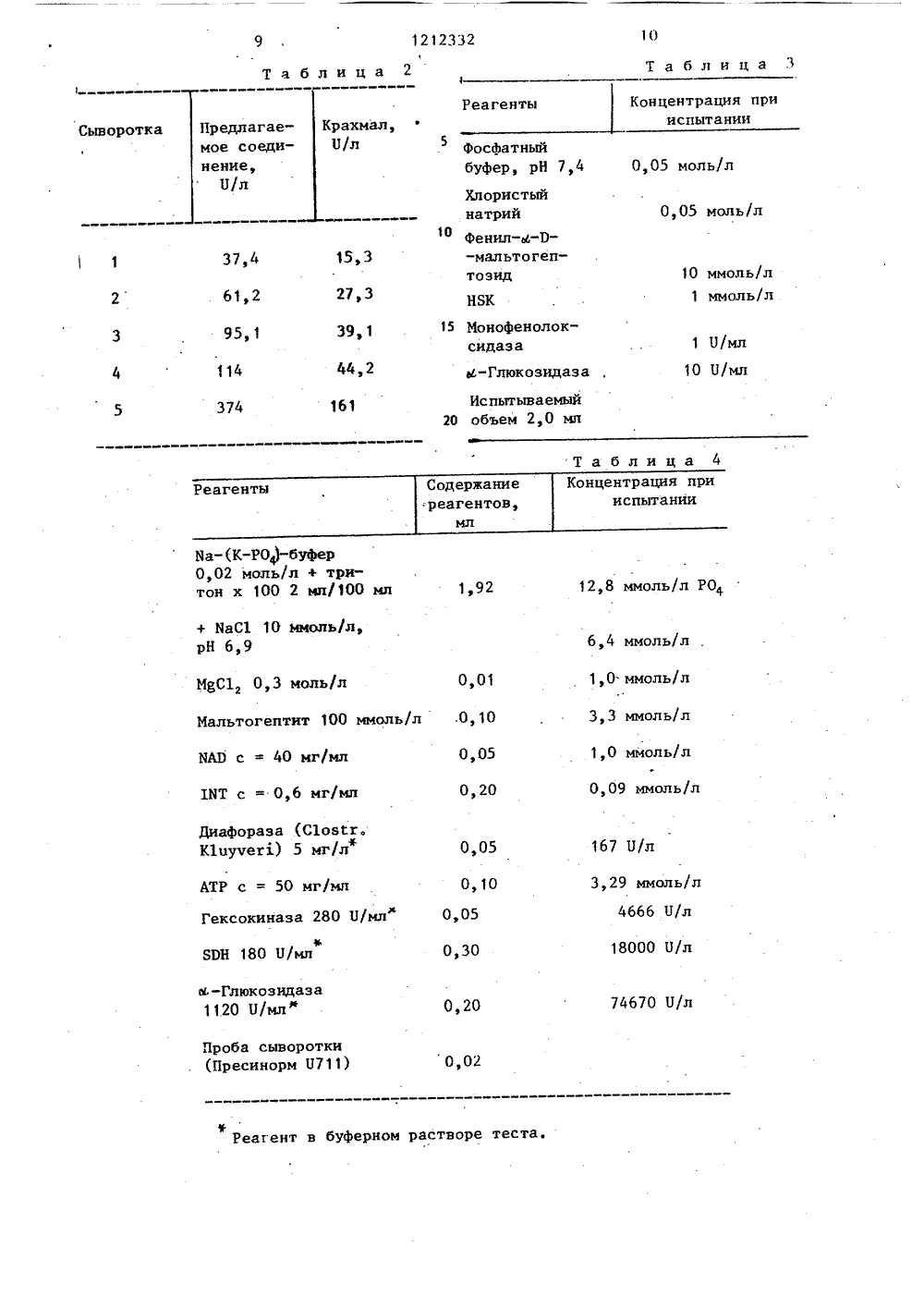
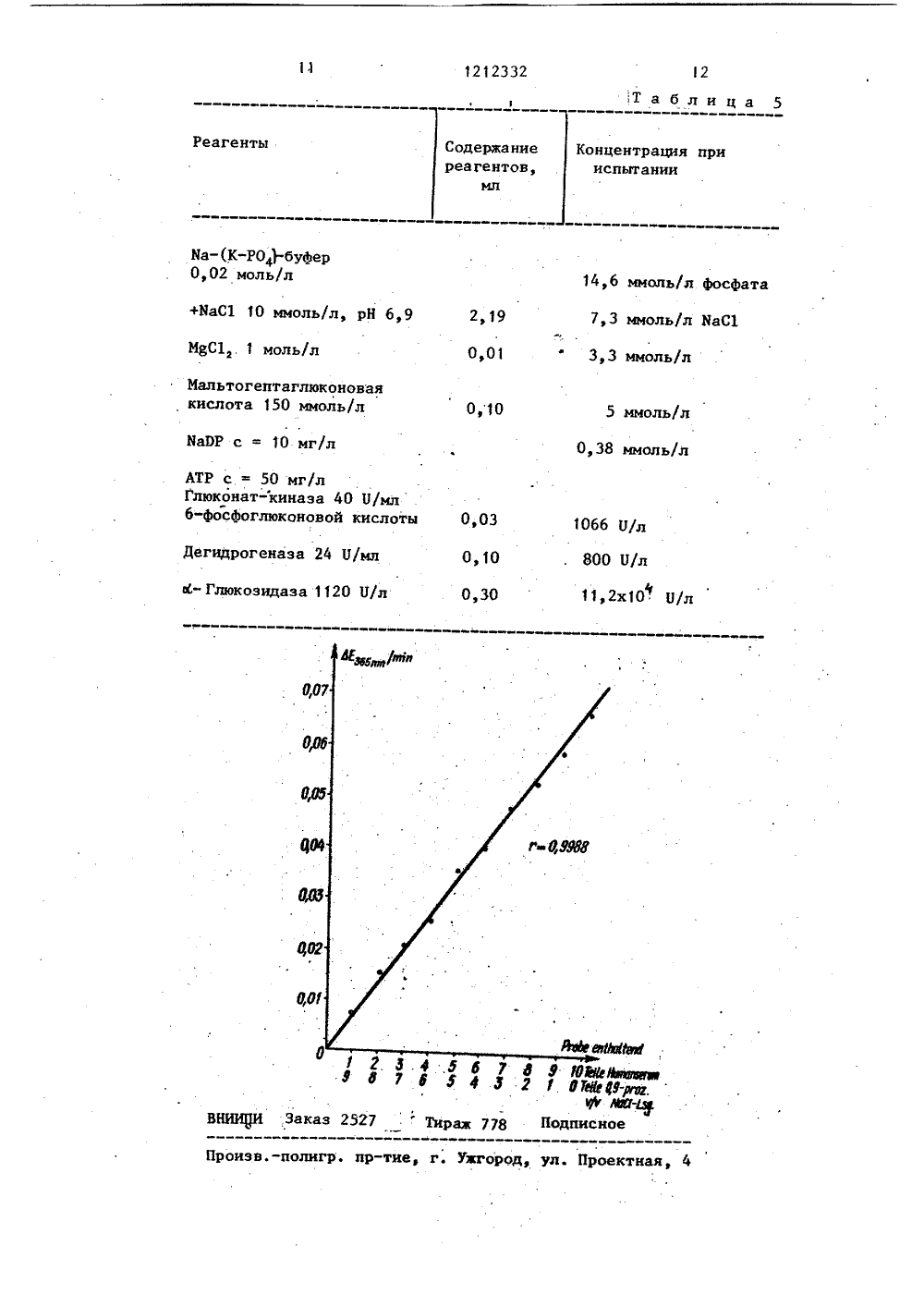
СОЮЗ СОВЕТСНИХСОЦИАЛИСТИЧЕСКИХРЕСПУБЛИК 4 И К ПАТЕН сте- Е 4 ИЯ с,-АМИ акции с измере- продуктем, сти опата исрмулы (1) глюкозид ная, моно я, Фенилглюкозид- итрофенилглюкозидтная или глюконогруппа,1, о т л и ч а во используют 0,1- ения общей формуная, сорби кислотная особ по и я тем, чт ь/л соед 2,щий250 мм о ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНР 1:1 Т ИСАНИЕ ИЗО(7 1) Берингер Маннхайм ГмбХ (ЭЕ)(53) 577. 15 (088.8) (56) Севка М В.гасЬ К., В С 11 п. С 1 и, Асга, 1969, 26,Патент США В 3879263, кл. 195-103.5, опубл, 1975, (54)(57) 1. СПОСОБ ОПРКДЕЛК ЛАЗЫ путем энзиматической р субстратом при рН 5,6-8,0 и ния количества образующихся тов, о т л и ч а ю щ и й с что, с целью повыщения точн ределения, в качестве субст пользуют соединение общей фСН 0 и И 33/48 С 12 1/4 3. Способ по п. 1, о т л и ч а кщ и й с я тем, что при измеренииколичества продуктов реакции на нихвоздействуют ю -глюкозидазой.4. Способ по п. 1, о т л и ч а ющ и й с я тем, что используют соединение.общей формулы (1), где К -глюкозид, и при измерении количества прс уктов реакции на них воздейвуют мальтозофосфорилазой, затемфосфоглюкомутазой с последующимвоздействием глюкозо-фосфат-дегидрогеназой в присутствии никотинамидадениндииуклеотида (НАД).5, Способ по п. 1, о т л и ч а ющ и й с я тем, что используют содинение общей формулы (1), где К -фенилглюкозидная группа, и измерениеколичества продуктов реакции ведутпри добавлении 3-фенил-сульфонилбензтиазолонгидрозона и монофенолоксидазы.6. Способ по п, 1, о т л и ч а ющ и й с я тем, что используют соединение общей формулы (1), где К -сорбитная группа, и измерение количества продуктов реакции ведут придобавлении сорбитдегидрогеназы и НАДс последующим, в случае необходимости, введением соли тетразола и диафоразы,7, Способ по п. 1, о т л и ч а ющ и й с я тем, что используют соединение общей формулы (1), где К -группа глюконовой кислоты, и измерение количества продуктов реакции ведут при добавлении глюконаткиназы,дегидрогеназы 6-фосфоглюконовой кислоты и никотинамидадениндинуклеотидфосфата,1212332 Изобретение относится к микробиологии, а именно к методам определения с 6 -амилазы.Цель изобретения - повьппение точности определения. 5На чертеже показаны графики, полученные по результатам ряда разбавле ний человеческой сыворотки физиологическим раствором поваренной соли.10 СН 20 Н 20 ла альтогептоза + НО,положении, например в виде 2,4-,или 3,5-заместителей.При отщеплении заместителей, содержащих нитрогруппы освобождающнейся нитрофенолы или дииитрофенолы сами являются окрашенными соединениямии их можно определить оптически. Если отщепляется сам фенол, то егоможно определить по известным методам, например путем взаимодействияс нуклеофильным.агентом, таким как3-метил-аульфонил-бензтиазолон-гид-.разон-(2) (НЗК) в присутствии монофенолоксндазы. При этой реакции по лучают красный краситель, которыйможно определить оптически.При отщеплении сорбита, например,путем окисления с помощью сорбит.дегидрогеназы во фруктоэу НАВ восста навливается в ЯАВН. Образование последнего можно определить при помощиУФ-спектрофотометра или путем взаимодействия с солью тетразола, наприых остаткахбыть в люб Способ осуществляют следующим образом.Определяют К -амилазу путем проведения энзиматической реакции ю 6 - амилазного субстрата при рН 5,6-8,0 и измеряют количество продуктов реакции, при этом в качестве субстрата используют соединение общей формулы. При выполнении способа используют производные мальтогептозы, т.е. соединения общей формулы , в которой К не является глюкозидной группой, При воздействии обоих энзимов 6 амилазы и Ы -глюкозидазы заместитель, т.е. фенильная группа, мононитрофенильная группа, или динитрофенильная группа, или концевой сорбитный, или глюконовый остаток, отщепляются и могут легко определяться. Фенильные ., группы могут стоять в ес -или-положении, Если фенильные группы в о -положении, то их отщепление происходит под действием-амилазы и б -глюкозидаэы, Отщепленные, замещенные или неэамещенные фенолы определяют по известным цветным реакциям (для- положения наряду с к -глюкоэидазой дополнительно применяется 3 -глюкозидаза) .При динитрофенильнобе нитрогруппы могут ом где К - глюкозидная, фенилглюкозидная, мононитрофенилглюкозидная, сорбитная или глюконокислотная группа.В качестве субстрата ю -амилаэы можно применять мальтогептозу и определенные ее производные, образующие при воздействии Ф -амилазы производный продукт расщепления, который может быть особо определен.Способ пригоден при определении продуктов расщепления с помощью Ж - глюкозидазы или мальтозофосфорилазы.При определении с Ы -глюкозидазой и соединением общей формулы (1) с К равно глюкозиду продукты расщепле ния мальтогептозы, мальтотетрозы и мальтотриозы расщепляются далее в глюкозу и последнюю определяют известным образом. Для измерения образовавшейся глюкозы в присутствии ив глюкозидазы предпочтительным является гексокинозный способ. Выполнениепредлагаемого способа представлено следующими уравнениями;мальтотриоза + мальтотетроза,-Глюкоза-р глюкоза-Р, С 6 РЭНГлюкоза-б-Р + НЫ --глюконат-б-Р т яЮН + Н; Глюконат б-Р + НАР в в -ърибулоза-б-Р + МАНН + Н6 РСЭН Ф з 12мер ТИТ(2-(пара-иодфенил)-3-(паранитрофенил-тетразолхлоридом), в присутствии диафоразы или другого передатчика электронов, образующийся окрашенный формазан определяют оптическив видимой области спектра,Аналогичным образом можно определить выделенную глюконовую кислоту,например, с глюконаткиназой, дегидрогеназой 6-фосфорглюконовой кислотыи БАЭР, а также с солью тетразолаи передатчиком электронов.Для осуществления способа необходимо поддерживать рН среды 5-9,предпочтительно работать при рН 7-7,5(лучшие результаты и сокращаетсявремя реакции). В случае применениянитрофенильных соединений рН составляет 6-8,5,к В качестве буферов применяют такие соединения, которые активны в области главнойактивности применяемого энзима. Предпочитаются фосфат, НЕРЕЯ (Н-гидроксиэтил)-пиперазин- -Х-этансульфоновая кислота) и глицилглицин, предпочтительны концентрации 10-200 ммоль/л.сь-Глюкозидазу применяют в количествах от О, 1 до 5000 Имл. Преимущество способа состоит в возможности применять сравнительно большие копио -амилазаМальтогептоза + Н 20 чества этого энзима так что 0 -амилазное расщепление является стадией,определяющей скорость.Соединение формулы (1) берут вколичествах от О, 1 до 250 ммоль/л,предпочтительно 0,5-100 ммоль/л,Насыщение субстрата Ы -амилазымальтогептозой происходит при концентрации от 8 до 10 ммольз Поэтомуцелесообразнее применять минимальнуюконцентрацию мальтогептозы (8 ммоль).Кроме того, целесообразно добавлять активирующее вещество для 0 -амилазы,-предпочтительнее хлористыйнатрий или хлористый калий.Определение продуктов расщепления производят путем взаимодействияих с мальтозофосфорилазой, вследствие чего образуется глюкоза-фос фат, который затем определяют известным способом, предпочтительнее превращать глюкоза-фосфат в глюкоза-фосфат с ЫАЭ в присутствии глюкоза-фосфатдегидрогеназы с образовани" ем глюконат-фосфата и ИАЭН, причемобразование последней контролируютфотометрически. Сигнал измерения может быть усилен путем дальнейшегоокисления с ЯАЭ в присутствии рибулоэо-фосфата и еще одной молекулы.Выполнение способа поясняетсяследующими уравнениями:Преимущество этого варианта выполнения способа состоит в том, чтомальтозофосфорилаза специфичнее,чем к -глюкозидаза и поэтому не вредит эндогенной глюкозе.Способ с использованием еБ -глюкозидазы осуществляют аналогичным образом.Изобретение поясняется следующими примерами.П р и м е р 1. Мальтогенный метод (Ы-глюкозидазная система).Смесь реагентов, содержащую кглюкозидазу, С 6 РЭН, НК, КАЭ, АТР,мальтогептозу, Мдф, МаС 1 и фосфатный буфер, растворяют в 2,0 мл дистиллированной воды, Устойчивость реагента при комнатной температуре составляет около 1 ч,при температуре ниже 8 С 6 ч.45Полученный раствор имеет следующие концентрации реагентов,.Фосфатныйбуфер 50 ммоль/л, рН 7,0МаС 1 . 50.ммоль/лМ 82 .2 ммоль/лМальтогептоза 10 ммоль/лАТР . 1,2 ммоль/л 55ХАЭ2 ммоль/лНК Ъ 2 ц/лС 6 РЭН Ъ 2 П/лФ-ГлюкозидазаМО О/лПолученный раствор инкубируют при 30 С, смешивают с пробой и определяют в фотометре разницу экстинкции при 334 нм Ня. После 10-минутной форинкубации экстинкцию определяют в течение 10 мин. Для ,2,0 мл реагента и О, 10 мл пробы получают следующую формулу для вычисленияе 2 1 х 10006,18 х 0,1 х 0,2 Раствор при 25 С смешивают с 0,02 мл пробы сыворотки и заливают в кювету слоем толщиной 1 см, затем. определяют экстинкцню при 365, 340 нли 334 нм в фотометре. Экстинкцию отсчитывают через 10 мин и затем через промежутки в одну минуту отсчет повторяют пять раз.Из вычисленных разниц экстинкции в минуту ( ЬЕ/мин) выводят среднюю величину, вычитают величину индукции реагента,и скорректированную величину используют в расчетах.Расчет производят следующим образом.О/л 25 С = 4244 х ЬЕ 365 нм/мин= 2290 х ьЕ 340 нм/мин = 2235 х х ьЕ 334 нм/мин.На графике показаны результаты ряда разбавлений человеческой сыворотки физиологическим раствором поваренной соли, полученные по данному методу. Если реагент делят на две загруз-:ки, из которых одна содержит мальтогептазу, другая: - смесь остальныхреагентов, то стойкость таких растворов может увеличиваться, Для смесиОреагентов при температурах до 8 Сона составляет 30 ч, при комнатнойтемпературе 8 ч, Стойкость мальтогептозы составляет 6 и 1 неделю соответственно,П р и м е р 2. Определение мальтозофосфорилазной системой,Готовят два реагента; первый, состоящий из амилазного субстрата, второй - из мальтозофосфорилазной системы. Первый реагент содержит мальтогептозный субстрат, второй - растворимый крахмал. Концентрации реагентов после растворения в воде следующие (см. табл. 1).= дЕ/мин х 1699 Нл,При применении пяти различных человеческих сывороток с укаэаннымиреагентами получают следующие величины (см. табл. 2).П р и м е р 3. Определение (- амилазы с фенил-к-мальтогептозидом вкачестве субстрата,Фенил-м-мальтогептоэид расщепляетО ся ж -амилаэой на феннл-ю-мальтотриид- или тетраид, которые а -глюкозидазой превращаются в фенол и глюкозу.Освободившийся фенол монофенолоксидазой с нуклеофильным реагентом15 3-метил-сульфонил-бентриазолон-гидразон-(2), окисляясь, превращается в красный, краситель, скоростьобразования которого пропорциональна активности амилазы в пробе и мо 20 жет определяться фотометрически.Испытания.а) Фенил-Ы-мальтогептозид+НО - р-амилаза- м феиил-и-.р-три(тетра)-глюко 25пиранозид + мальтотетра-(три)-оза,б) Фенил-К-Р-три-(тетра)-глюкопираноз + 3(4)Н О (-глюкозидазанол + 3(4) глюкоза.в) Фенол + НЗК + 0 монофенолок 30сидаэа-- ь краситель + 2 Н О.Условия измерения: 25 .С, длинаводны 492 нм,кювета 1 см.Состав реагента приведен в табл.3.Вместо фосфатного буфера используют глицин, глицилглицин, гепес,трис-, тра-,и другие буферы.П р и м е р 4. Определение К -амилазы с пара-нитрофенил-мальтогептозидом.Испытания.фпара-Нитрофенил-к-мальтогептоэид --(глюкоза) + пара-иг итрабеФ-глюкозидаэа45 нил-(;глюкоза. (глюкоза + пара-нитрофенол).После расщепления мальтогептозидапродукты расщепления разлагают наглюкозу и пара-нитрофенол. Пара-нитрофенолят-анион в щелочном раствореокрашен в желтый цвет и может бытьопределен оптически.Испытания.ОСмесь реагентове 50 ммоль/л фосфатного буфера, рН 7,4; 50 ммоль/л1212332 Количество: 1 мл смеси реагентов + + 50 П/л пробы, температура 30 С, длина волны 405 нм. Начало реакции сыворотки после достижения температуры измерения (10 мин предварительной инкубации сыворотки).П р и м е р 5. Определение 66- амилазы с мальтогептитом.Испытания.Ы -амилаза Мальтогептит + Н,О мальтотриит + мальтотетроза. Мальтотри-, :ит + Н Р А-глюкозндаэа2= Сорбитдегидрогеназа.Испытуемая . система представленав табл. 4.Начало реакции добавки пробы при492 нм и 25 С. Таблица 1 Количество, используемое при осуществленииспособа Реагенты известного предлагаемого 20 мм рН 6 20 мм Фосфатный б тогепто 5 мг/лСледы 3 П/мл Мальтозофосфорилазмикроорганизмов сфоглюкомутазроорганизмов) 1 О/мп 06 РЭН О.еисошезепс)6 РСРН (Ьеисошезепс) зйос зло О/мл Растворимый крахмал Глюкоза,6-дифосфат П р и м е р 6. Определение , -амилазы с мальтогептаглюконовой кислотойИспытания.Мальтогептоглюконовая кислота +ю-амилаза+ рибулодегидрогеназаза-.Р + ЫАЭРН + СО, + Н .Испытуемая система дана в табл. 5. 20Проба сыворотки: измерение проводят при 340 или 365 нм и 25 С, объем3,00 мл.10 1212332 Таблица Та блица 2 Концентрация и испытании рахмал,Б/л Сыворо осфатныйуфер, рН 7,0,05 моль/л Хлористыинатрий 0,05 моль 7,4
СмотретьЗаявка
2662348, 04.09.1978
Бёрингер Маннхайм ГмбХ
ЭЛЛИ РАУШЕР, УЛЬРИХ НОЙМАНН, АУГУСТ ВИЛЬХЕЛЬМ ВАЛЕФЕЛЬД, АЛЕКСАНДЕР ХАГЕН, ВОЛЬФГАНГ ГРУБЕР, ЙОАХИМ ЦИГЕНХОРН, ОЙГЕН ШАИХ, УЛЬФЕРТ ДЕНЕКЕ, ГЕРХАРД МИХАЛ, ГЮНТЕР ВАЙМАНН
МПК / Метки
МПК: C12Q 1/40, G01N 33/48
Метки: амилазы
Опубликовано: 15.02.1986
Код ссылки
<a href="https://patents.su/7-1212332-sposob-opredeleniya-amilazy.html" target="_blank" rel="follow" title="База патентов СССР">Способ определения -амилазы</a>
Предыдущий патент: Способ получения перегретого пара и устройство для его осуществления
Следующий патент: Подземная многополюсная герметичная газонаполненная высоковольтная линия
Случайный патент: Сплав изготовления композиционных материалов