N-незащищенный 5 -о-диметрокситритилдезоксинуклеозид-3 н-фосфонат в качестве мономера в синтезе олигонуклеотидов н фосфонатным методом
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
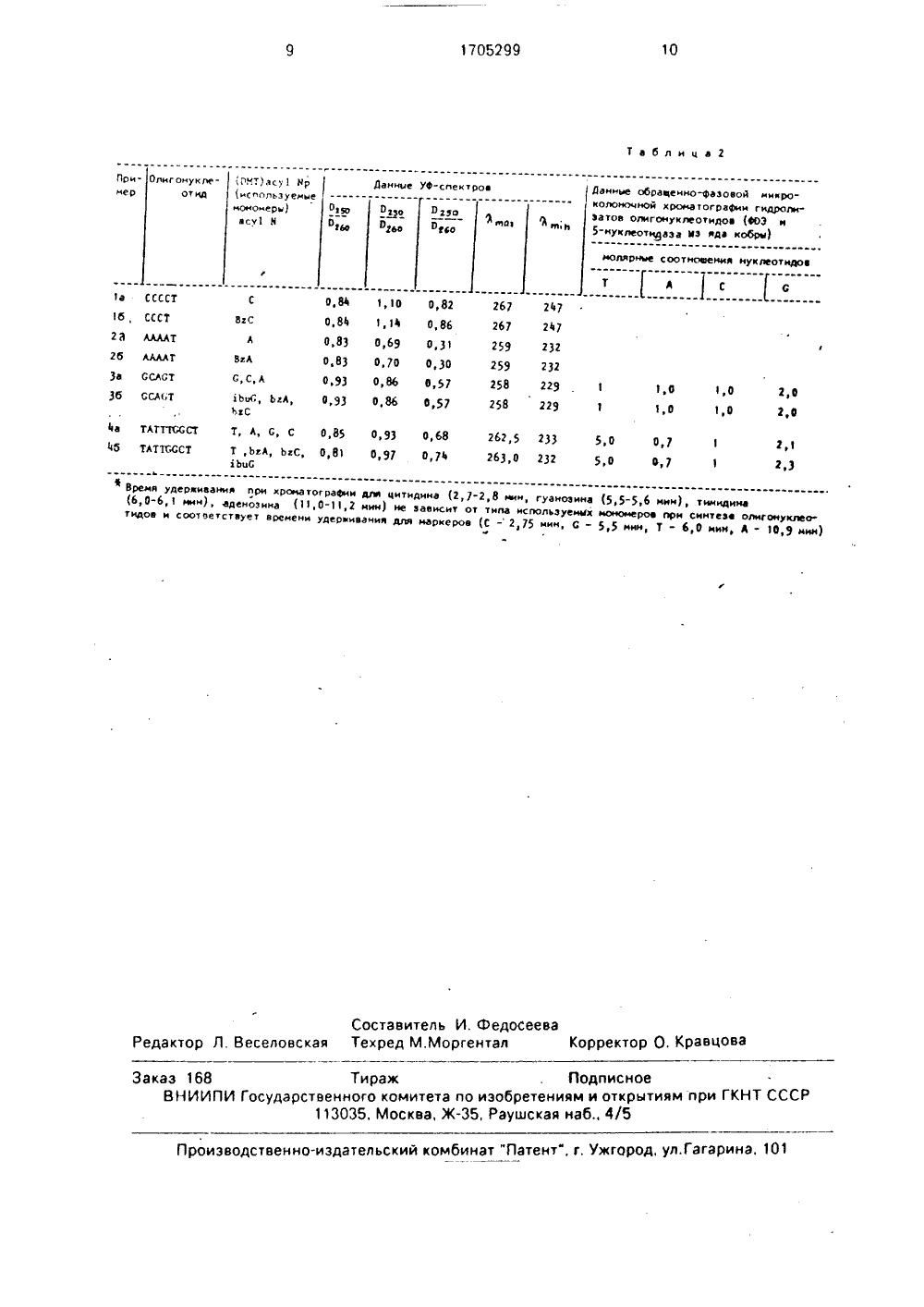
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСКИРЕСПУБЛИК цз С 07 Н 19/10 БРЕТЕНИЯ ИСАН ВТОРСКОМУ СВИДЕТЕЛЬСТВ ИНТЕЗЕ ОЛИГОНУКЛЕОТИДОВ Н-ФООНАТНЫМ МЕТОДОМ7) Изобретение относится к химии нуклеодов, в частности к ч-незащищенному 511диметокситритилдезоксинуклеоэид осфонату ф-лысн,о(71) Новосибирский институт биоорганической химии СО АН СССР(56) Ггое 1 ег В,С., Маиеосс М.О. - Те 1 г. .еиегз, 1986, ч. 27, вв 4, р. 469-472.ГгоеЫег В,С., Н 9 Р.О., Маиеасс М.О- й 0 с. Асбз Вез., 1986, ч 14, в 13, р. 5399-5407,баге 99 Р, Ве 9 Ьегд Т., ЗадачпзИ Э51 говЬег 9 В. - Те 1 г. .еиегз, 1986, ч, 27, М 34,р. 4055-4058.Сагедя Р.,. Ве 9 Ьег 9 Т., 81 ачпзй А 51 гов Ьег 9 В.; СЬев. Ясг 1 рта,1986, ч. 26, р,59-62.Биоорган, химия, т. 14, вв 4, с. 484-489.Т 6.8., Оаттпеу В.Е., 3 опез В,А;. Авег, С 1 ев. Яос 1982, ч, 104, о, 1316-1319, (54) й-НЕЗАЩИЩЕННЫЙ 5 -0- СИТРИТИЛДЕЗОКСИНУКЛЕО ФОСФОНАТ В КАЧЕСТВЕ МО о с-осн гдекоторсинте В - аденоэин, гуа ый используют в к зе олигонуклеотид методом. Цель - выявлен х полезными,с обработкой енных нуклеоэи дом с последую вием с салицилхл выделением обращенн тографией. 2 табл.ноэиначеств цитидин, омера в онат ным ний, об- Получевующих кситри- одейстие соедине войствами. соответст дов димето щим взаим орфосфи лада ющиние ведутнезащищлилхлори ДИМЕТОКЗИД-ННОМЕРА В ма- а Иэобретени рганической х имическим со итритильным еоэидов обще-0-диметокситритилН-фосфонаты (1-5) ф т ч-ацилированныеФзоксинуклеоэидмулыр-с-осн, д в" О С-ОСНвв О -О оО Р-Ненозин, гуанозин, цитидин, могут быть использованы как исномеры для синтеза олигонуклеоосфонатным методом.стае мономеров для Н-фосфоната синтеза олигодеэоксинуклеоэигде В" - ч - бенэоилцитидин, И - иэоДанные соединми описываемых каназначению. Получеотидов включает сле иладенозин, й - б4 бутирилгуаноэин. ения являются ана к по структуре, та ние из них олигон дующие стадии: енэ где В - а которые ходные м тидов Н-фВ кач ного мета лога- и по ОСУДАРСТВЕ ННЫЙ КОМИТЕТО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМРИ ГКНТ СССР 1705299 А(О МТ 114 р,П - полимерный носи 1 ель;15 гОРгчС - пивалоилхлорид, (СНз)зССи х С 6Г 4 - Г 4 - ацил деэоксинуклеозид,Средний выход на каждой стадии присоединения одного звена95,Недостатком известных мономеров является то, что при их использовании длясинтеза олигонуклеотидов целевые продукты получают после жесткой обработки аммиаком (в течение 16 ч при 50 С),необходимой для удаления обычно испольэуемых й-защитных ацильных групп, Этоприводит к значительному увеличению длительности процесса и может быть нежелательно при синтезе олигонуклеотидов счувствительными к жесткой аммиачной обработке модифицированными межнуклеотидными группами.Цель изобретения - получение новыхмономеров, использование которых длясинтеза олигонуклеотидов существенно ускоряет и упрощает процесс получения последних при сохранении выхода целевых продуктов,Поставленная цель достигается применением новых химических соединений - 5.0- диметокситритилдезоксинуклеоэид-Н1фосфонатов формулы 1, которые получаютобработкой соответствующих незащищенных нуклеозидов диметокситритилхлоридом с последующим взаимодействием ссалицилхлорфосфитом и выделением обращен но-фа эовой хроматографией.Полученные соединения были испытаны в качестве мономерое для полученияолигонуклеотидов Н-фосфонатным методомв ручном варианте. Испытания проводили в 501сравнении с известными мономерами - 5-О-.диметокситритил-й-ацилдеэоксинуклео.эид-Н-фосфонатами формулы ,Результаты испытания подтверждаютвоэможность синтеза олигонуклеотидов из 55целевых мономеров, при этом сохраняетсявыход целевых продуктов (средний выходна стадию957 ь), исключается иэ процессадли 1 ельнвя по времени стадия жесткой аммиачной обработки, Кроме того, упрощаетсд процесс получе ия исходных мономеров,поскольку исю аегся стадия ацилироеания ззоци ли, лх рупп нуклеозидов,П р и и е г , Синтез 5 -0-диметокситритивци 1 идин-Н.фосфоната.а Синтез 5 -д диметокситритилцитидина, (ОМТ)С,1 ммоль ц 1 и.,1 на (228 мг) растворяют в10 мл абс, п 1 ри. а, добавляют 1,5 ммоль(680 мг) диметоситритилхлорида (ОМТС),Через 4 ч добавляют дополнительное количество ОМТС и Ме)п (1 и 0,75 ммоль соответственно). За одом реакции следят спомощью тонкослойной хроматографии(ТСХ) в системе хлороформ-этанол (8,5:1,5).Через 15 ч реакционную смесь после добавления 1 мл этанола упаривают до масла,раствсряют в 10 мл хлороформа р экстрагируют насыщенным раствором 4 аНСОз(2 х 10мл), Хлороформныи слой высушивают надбезводным 4 аз 504. упариеают и хроматографируют на силикагеле (колонка 200 мл,градиент этанола (О) в хлороформе,со.держащем 0,2 триэтиламина). Фракцию,содержащую продукт - (ОМТ)С, упариваюти осаждают из хлороформа в гексан. Выход292 мг (535 мкмоль); 47,5 Я,Продукт гомогенен по данным ТСХ имикроколоночк,ой обращенно-фазовой хроматографии.Уф(С 2 НОН)Л х = 234. 275 нм; А л223, 259 нм;ПМР (СОЗЯОСОз): д = 7,6 (б, 35,6 = 8 Н, 1,Н б). 7,4-7,1 (п 1, 9, Аг); 6,9-6,7 (в, 4, Аг); 6,11 (1,3 =7 НЕ. 1, Н 1);5.05(с, .5,6 8 Н 7, 1, Н 5),4,22(450 мкмоль) Через 10-15 мин полноту реакции проверяют с помощью ТСХ (системахлороформ-этанол 8,5;1,5) и анализируютобращенно-фазовой хроматографией. Продукт выделяют обращенно-фазоеой хроматографией на колонке с ЯавогЬ Свградиенте ацетонитрила в воде (5-807 ь).Фракцию, содержащую продукт - (ОМТ)Ср,упариеают, высушивают упариванием с абс,ацетонитрилом и осаждают в гексан.Выход 126 мг (181 мкмоль), 82 6.Продукт гомогенен по данным ТСХ,МКХ и Р-ЯМР.УФ(СгНОН): Лгунах = 245 и 275 нм;Л тп = 224 и 259 нм.зР-ЯМР (пиридин): д = 1,69 м,д.р-и - 5609 Нг.П р и м е р 2, Синтез 5 -0-диметоксит 1ритиладенозин.3 -Н-фосфоната,а. Синтез 5 -0-диметокситритиладенозина, (ОМТ) А, 1 ОМетодика синтеза (ОМТ)А полностьюаналогична таковой для (ОМТ)С,К 1 ммоль аденозина (251 мг) в 1 О мл абс,пиридина добавляют 2 ммоль (670 мг) ОМТСи 1,5 ммоль (125 мкл) Меа. Через 4 ч дополкительно добавляют 1 ммоль (335 мг) ОМТСи 0,75 ммоль (60 мкл) Ме 1 а.Выход (ОМТ)А 337 мг (605 ммоль),60,5.Продукт гомогенен по данным ТСХ и 20микроколоночной обращенно-фаэовой хроматографии.Уф (СгНБОН): Лх "236 и 262 нм;Лтп -225 и 253 нм.П М Р (С ОСз): д = 8.22 (з, 1, Нв); 7.95 (в,1, Нг); 7,4-7,0 (а, 9, Аг); 6,82-6,66 (а, 4 Н, Аг),6,41(т,. 7 Нг, 1, Н); 6,17(Ьгв, 2, МНг); 4.66(ОМТ)ср,К 220 мкмоль (130 мг) (ОМТ)А в 0,5 млабс. диоксана добавляют 200 мкл метилморфолина и 0,44 мл 1 М раствора ЯаРС в вбсдиоксане (440 мкмоль).Продукт гомогенен по данным ТСХ,МКХ и зР-ЯМР.Выход (ОМТ)Ар 128 мг (178 мкмоль). 4081.УФ(СгНБОН): Л вах 236,5 и 260 нм;Л ть - 225 и 253 нм;Р-ЯМР,. (пиридин): д =2,40 м.д Лр.н = 609 Нг,П р и м е р 3. Синтез 5 -0-диметоксит 45ритилгуанозин-Н-фосфоната,а, Синтез 5 -0-диметокситритилгуано 1зина (ОМТ)С.1 ммоль гуанозина (267 мл) суспендируют в 30 мл абс. пиридина и добавляют 3ммоль Меа (250 мкл) и 3 ммоль ОМТС (1 г).Через 3 ч дополнительно добавляют 2ммоль ОМТС (670 мл) и 2 ммоль Мегп (165мкл), Через 15 мин реакционная смесь становится прозрачной и реакция практическизаканчивается: анализ с помощью ТСХ всистеме хлороформ-этанол (8,5:1,5) показывает практически полное отсутствие исходного нуклеоэида. Дальнейшую обработку реакционнойсмеси проводят, как описано выше для(ОМТ)А и (ОМТ)С,Выход (ОМТ)б 308 мг (545 мкмоль),54.5 ф,Продукт гомогенен по данным микроколоночной обращенно-фазовой хроматографии и ТСХ.Уф(СгНвОН): Лрпх нм. плечи на260 и 275 нм; Л вь - 222 нм,ПМР (СОСз): д = 7,85 (в, 1, Нв); 7,4-7.0- 613 Н; примесь: д = 5,69 м.д.П р и м е р 4. Синтез олигонуклеотидовс использованием структурных аналогов -й-ацилированных Н-фосфонатных синМнов (П).Для синтеза использовали синтоны(ОМТ)Тр, (ОМТ)ЬгАр. (ОМТ)ЬС, (ОМТ)Ьобр,где Т - тимидин; С - гуаноэин; Ьг - бензоил;С - цитидин, А - аденозин,Ьо-изобутирил.Синтез проводят на колонке со стеклянным фильтром в ручном варианте. Используют 5-10 мг полимера СРСсприсоединенным за 3 -ОН группу (ОМТ)Т вколичестве 40-60 мкмоль г.Цикл присоединения одного нуклеотидного звена проводят согласно табл, 1,После проведения нужного числа циклов удаляют ДМТ-группу с 5 -концевогозвена (1 СГЗСООН в хлористом метилене,40 с), окисляют межнуклеотидные Н-фосфонатные группы до фосфатных (0,2 М Лг всмеси пиридин-вода, 98:2, 20 мин), удаляютнуклеотидный материал с полимера и удаля1705299 Таблица 1 ют защитные ч-ацильные группы (конц. аммиак. 1 бч, 50" С),Олигонуклеотиды выделяют ионообменной и обращенно-фазовой хроматографией. С испольаоеанием мономеров формулысинтезируют следующие олигонуклеотиды; ААААТ, ССССТ, ОСАОТ, ТАТТТ 66 СТ.Выходы на стадии, оцененные по поглощению ОМТ -катиона,957 ь.Выход пентануклеотидэ ОСАСТ, определенный из профиля ионообменной хроматографии как отношение оптического поглощения продукта к общему поглощениюю нуклеотидного мате риала, 34 ф.Полученные олигонуклеотиды анализируют по УФ-спектрам, а также после ферментативного гидролиза с помощью микроколоночной обращенно-фазовой хроматографии.Результаты приведены в табл. 2.П р и м е р 5. Синтез олигонуклеотидов с использованием целевых Й-незащищенных Н-фосфонатных синтонов .Для синтеза используют синтоны: (ОМТ)С 0, (ОМТ)Ар, (ОМТ)бр, а также обычно используемый (ОМТ)Тр, Синтез проводят аналогично описанному в примере 4 за исключением того. что в качестве растворителя для реагентов и для промывки используют пиридин. Кроме того, для растворения мономера(ОМТ)Ср в пиридине необходимо добавлять 1-2этилдиизопропиламина.Цикл присоединения одного авена проводят согласно табл. 2 с добавлением стадии промывки полимера ацетонитрилом до и после деблокирования.После окончания синтеза проводят обработку, как описано в примере 4 (удаление 5 -ОМТ-группы, окисление). Удаление нчклвотидного материала с полимера проводят обработкой концентрированным аммиаком при комнатной температуре в теф Растворители абсолютированны чение 1 ч Олигонуклеотиды выделяют ионообменной и обращенно-фазовой хроматографией. С использованием целевых мономеров формулыСинтезируют следую. 5 щие олигонуклеотиды; ААААТ, ССССТ, 6 САСТ, ТАТТТООСТ,+Выходы на стадии, оцененные по ОМТ- катиону,95.Выход пентануклеотида ССАОТ. опре деленный,как описано в примере 4, 29.Полученные олигонуклеотиды анализируют, как указано в примере 4. Данные приведены а табл, 2. Как видно из табл. 2. олигонуклеотиды, 15 синтезированные из структурных аналогов ч-ацилированных Н-фосфонатных синтонови из целевых й-незащищенных мономеров , практически не отличаются по УФ-спектральным характеристикам. а так же по данным обращенно-фазовой хроматографии ферментативного гидролиэата этих олигонуклеотидов. Полученные резуль- таты свидетельствуют о том, что при использовании предложенных мономеров в 25 Н-фосфонатном методе экэоциклические аминогруппы не модифицируются и олигонуклеотиды, полученные иэ этих мономеров, идентичны полученным из обычно используемых Н-фосфонатных синтонов. 30 Формула изобретенияй-Незащищенный 5 -0-диметокситритилдеэоксинуклеозид-Н-фосфойат общей формулыСНО 35 Ф СНБО-С-ОСНр ф 0 уООР-О 40 где В - аденозин, гуанозин или цитидин, в качестве мономера в синтезе олигонуклеотидов Н-фосфонатным методом.10 1705299 таблмца 2 Ланмые обраценно-Вазовой микроколоночнод хроматографии гнщюлмзатов олмгомуклеотидов (фОЭ и5-нуклеотндаза гз яда кобры)(используемыемономеры)асу 1 Н Данные Уф-сектров ПрнОлмгонуклеот ид мер Отвз О За ы Эо Оеэо О г 2 о яятн молярные соотновемня нуклеотндов ВгС ВгА1,0 1,0 2,0 С,С,А 2,0 1 1,О 1,0 ЬцС, ЬгА,ЬгС 0,85 093 О, 68 081 0,97 0,74 262,5 233 263,0 232 2,50 0,7 5,0 0,7 Т, А, С, С 23 Т ,ЬгА, ЬгС,ТЬцС в Время удеркивання лри хроматографии для цитидима (2,7-2,8 ем гуанозина (5,5-5,6 ммм), тимндина(6,0-6, мнн), аденознма (1 0-11,2 мин) не зависит от типа используемых мономеров лрм синтезе олигонуклеотидов и соответствует врененн удермивания для маркеров (С - 2,75 мин, С - 5,5 ннн, Т - 6,0 нин, д - 10,9 мин) Составитель И, ФедосееваРедактор Л. Веселовская Техред М,Моргентал Ко ектор О. Кравцоварр Р Тираж ПодписноеЗаказ 168б етениям и открытиям при ГКНТ СССРВНИИПИ Государственного комитета по изобретениям и отк ы113035. Москва,Ж, Раушская наб., 4/5 т "Патент", г, Ужгород, ул.Гагарина,,1 1 Производственно-издательский комбинат 1 а ССССТ16, СССТ2 а ААААТ26 ААААТЗа ССАСТЗб ССА 1 Т4 а ТАТТТСССТ4 г тА 11 ссст 084 110 082 О,84 1,4 О,86 0,83 0,69 0,31 0,83 0,70 0,30 0,93 0,86 0,57 0,93 0,86 0,57 267 247 267 247 259 232 259 232 258 229 258 229
СмотретьЗаявка
4784124, 18.01.1990
НОВОСИБИРСКИЙ ИНСТИТУТ БИООРГАНИЧЕСКОЙ ХИМИИ СО АН СССР
ЛЕВИНА АСЯ САУЛОВНА, ТАБАТАДЗЕ ДАВИД РЕЗОЕВИЧ, КОМАРОВА НИНА ИВАНОВНА
МПК / Метки
МПК: C07H 19/10
Метки: n-незащищенный, качестве, методом, мономера, н-фосфонат, о-диметрокситритилдезоксинуклеозид-3, олигонуклеотидов, синтезе, фосфонатным
Опубликовано: 15.01.1992
Код ссылки
<a href="https://patents.su/5-1705299-n-nezashhishhennyjj-5-o-dimetroksitritildezoksinukleozid-3-n-fosfonat-v-kachestve-monomera-v-sinteze-oligonukleotidov-n-fosfonatnym-metodom.html" target="_blank" rel="follow" title="База патентов СССР">N-незащищенный 5 -о-диметрокситритилдезоксинуклеозид-3 н-фосфонат в качестве мономера в синтезе олигонуклеотидов н фосфонатным методом</a>
Предыдущий патент: Способ получения термостойкого реагента для глинистых растворов на основе лигносульфонатов
Следующий патент: Способ выделения дезоксирибонуклеиновой кислоты из органов животных
Случайный патент: Картонная складная коробка для изделий сложной конфигурации