Способ определения кислой фосфотазы из печени животных
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
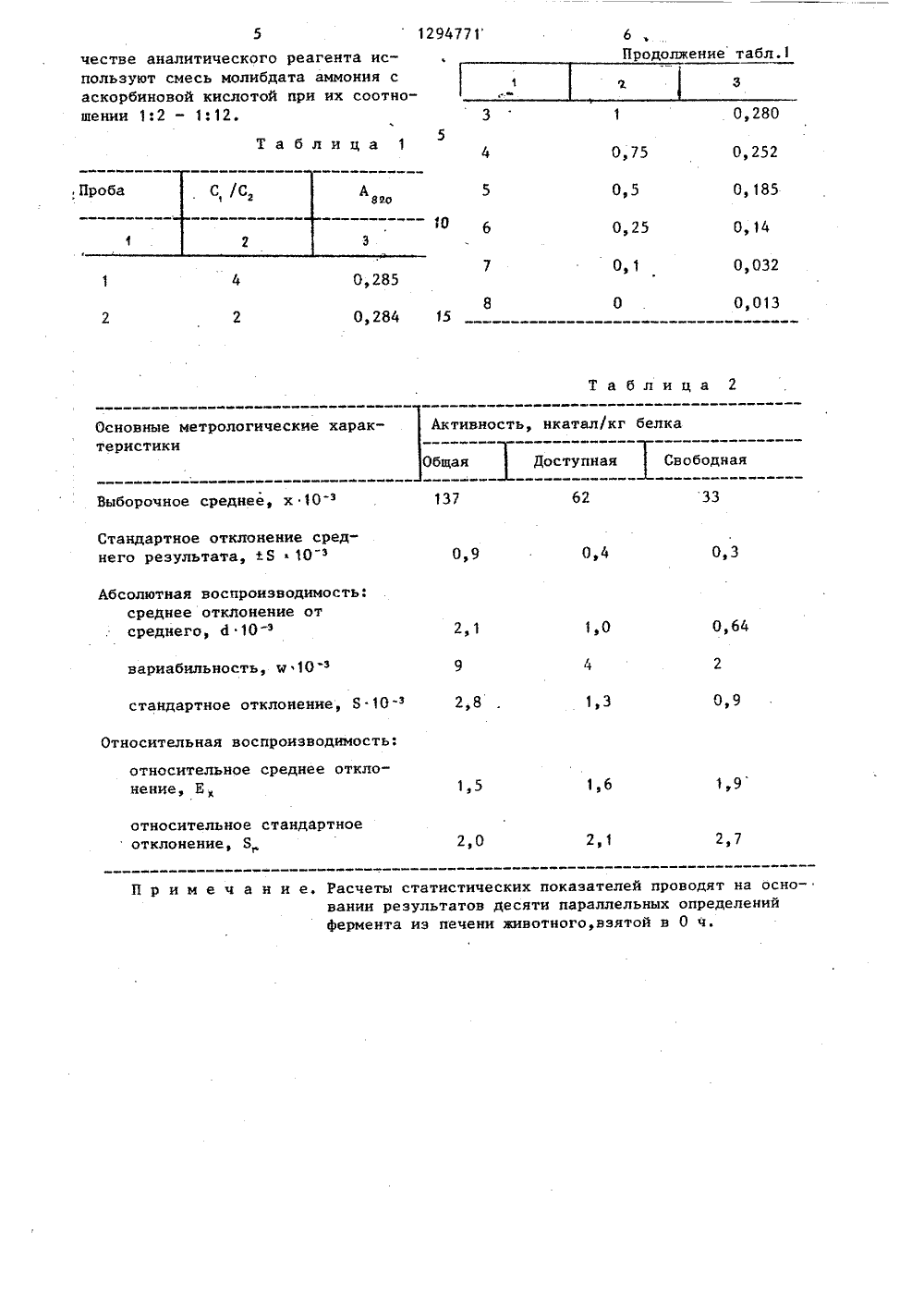
(088,8)Методические исд. Д. Динчов,24-125. М 54) СПОСОБ ОПРЕДЕЛЕНИАЗЫ ИЗ ПЕЧЕНИ ЖИВОТНЫХ ФОСФА СУДАРСТЯЕННЫЙ НОМИТЕТ СССРО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ Т 0 РСМУ СИДЛСТ(57) Изобретение относится к биохи мин и касается исследований в энзи мологии, Целью изобретения являетс повышение чувствительности и точности способа. Готовят гомогенат из печени животных и выделяют из гомогената обогащенную фракцию лизосом, которую используют в качестве источника фермента. Фермент инкубируют с забуференным Р-глицерофосфатом натрияИнкубацию проб прекращают добавлением НС 10 . В супернатанте определяют, Р, . Проба содержит аскорбиновуюкислоту и молибдат аммония в соотношении 2: 1-12: 1. Величину оптической плотности измеряют при 820 нмна спектрофотометре. Удельную активность кислой фосфаъазы выражаютколичеством нанокаталов, отнесеннымк 1 кг белка. 3 табл,1 12947Изобретение относится к биохимиии касается исследований в энэнмологии,Целью изобретения является повышение чувствительности и точностйспособа.Способ осуществляется следующимобразом.Ферментный препарат (0,1-7,2 мгбелка) инкубируют в присутствии субстрата (2,7-24,4 мкмоль на 1,71,5 мл конечного объема) в О, 1 Мацетатном буфере рН 5, приготовленном на 0,7 М растворе сахарозы.Инкубацию проб при 37 С прекращаютчерез 30 мин добавлением 0,5 мл 0,2 М.НС 10 . В 0,9 мл супернатанта, полученного при центрифугировании пробпри 5000 об/мин, определяют РПробы содержат 100 мг аскорбиновой кислоты и 25 мг молибдата аммония4 Н О, приготовленного на 1 н.серной кислоте, на 3 мл конечногообъема. Инкубирование при 45 С заканчивают через 20 мин, охлаждают иизмеряют величину оптической плотности пробы против контроля на реактивыи растворители при 820 нм на спектроФотометре. Абсолютное количество фосфата в пробе определяют по калибровочному графику и считают его эквивалентным количеству гидролизованногосубстрата. За единицу ферментативнойактивности принимают 1 катал.удельную активность кислой фосфатаэы выражают количеством нанокаталов, отнесенным к 1 кг белка. Белок определяют методом Лоури.П р и м е р. В работе используютинтактных самцов кроликов породы Шиншилла массой 2,5-3,5 кг, Печень беруту наркотизированных гексеналом животных., перфузируют на льду ледяным физраствором, промокают бумажными Фильтрами, тщательно очищают от соединительной ткани и взвешивают. Гомогенатготовят из расчета 1:9 (вес ткани наобъем среды для гомогенизирования).Гомогенизацию проводят в стеклянномгомогенизаторе Поттера-Зльвейема с 50тефлоновым пестиком (зазор 0,21 мм)в течение 30 с при 1200 об/мин. В качестве источника фермента используютобогащенную фракцию лизосом, полученную дифференциальным центриФугированием с использованием градиентасахарозы. Осадок ресуспендируют всреде для гомогенизирования и, до 71 2бавляя в среду для инкубации тритон -100 до конечной концентрации 0,1- 0,2, определяют общую активность Фермента. Доступную форму активного этого фермента определяют аналогичным образом, но беэ добавления в среду инкубации детергента. В суперна" анте этой фракции измеряют величину активности свободной (неседементнруемой) формы этой гидролазы. Доля активности свободной формы Фермента относительно общей, вшраженная в процентах, была мерой (показателем) целостности лизосомных мембран (ПЦЛМ), а разница между доступной и свободной Формами энзима, выраженная аналогичным образом, служит показателем степени их проницаемости - лабилизацин (ПЛЛМ).Активность кислой фосфотаэы (КФ 3.1,3.2) определяют по приросту впробе Р; при инкубации О, 1-0, 2 мг белка с-глицерофосфатом натрия (27,7 и 24,4 мкмоль на конечный объем в 1,7 мл для общей и 1,5 мл для доступной и свободной форм активности фермента) в 0,1 И ацетатном буфере рН 5, приготовленном на 0,7 М растворе сахарозы. Инкубацию проб при 37 С пре 1 кращают через 30 мин добавлением 0,5 мл 0,2 М НС 10. Контрольная проба содержит те же компоненты, кроме ферментного препарата, который добавляют сразу после хлорной кислоты. В 0,9 мл супернатанта, полученного при центрифугировании проб при 500 об/мин, определяют РПроба содержит 100 мг аскорбиновой кислоты н 25 молибдэта аммония4 Н О приготовленного на 1 М серной кислоте на 3 мл конечного объема.б Инкубирование проводят при 45 С н заканчивают через 20 мин, охлаждая пробы и измеряя величину ее оптической плотности против холостой пробы, Абсолютное содержание Р в пробе находят по калибровочному граФику и считают его эквивалентным количеству гидролиэованного субстрата. Величину оптической плотности окрашенных растворов измеряют на спектрофотометре, За единицу активности Фермента принимают 1 катал Удельную активность кислой Фосфатазы выражают количеством нанокаталов, отнесенным к 1 мг белка. Все препаратнвные процедуры сб тканью печени осуществляют при 0-4 С на холоде. Белок определяют методомОценка достоверности результатов 40 определения активности кислой фосфатазы из печени кролика дана в табл.2. 3 1294 Лури, Все численные результаты опытов подвергают статистической обработке.Зависимость величины оптической плотности (А, . стандартного (1 О мк М) раствора неорганического фосфата от 5 соотношения концентраций аскорбиновой кислоты (С,) и молибдата аммония (С,) в аналитическом реагенте представлена в табл.1.0 Из табл. 1 видно, что максимальнаявеличина оптической плотности стандартного раствора фосфата становитсяпри соотношении концентраций растворов аскорбиновой кислоты и молибдатааммония 2. Дальнейшее увеличение этого соотношения не влияет на величинуэкстинции исследуемого раствора ввиду ограниченного растворения аскорбинбвой кислоты в воде (33 г на100 мл), максимальная величина этогокоэффициента может быть 12. Этимизначениями определяется эффективныйдиапазон концентраций аскорбиновойкислоты в аналитическом реагенте,Сравнивают калибровочные зависимости для предлагаемого метода иизвестного тангенсы угла наклона равны 0,029 и 0,019 для указанных способов соответственно. Поскольку этосоответствует коэффициентам инструментальной чувствительности (Б цс ),, то относительная чувствительность фотометрической реакции предлагаемого,метода в 1,5 раза выше известного.Величина кажущегося десятичного.молярного коэффициента экстинции данной фотометрической реакции ( Я= 30 500) также в 1,5 раза выше чемв известном способе (Е = 19 000).Калибровочные зависимости в выбранных диапазонах концентраций носятлинейный характер, что позволяет использовать основной закон светопог-,: 45лощения для вычисления величины относительной чувствительности определения, Предлагаемый способ (Смин == 0 18 мкМ) в 1,5 раза чувствительнее известного (Смин = 0,26 мкМ).Поскольку при большем значении коэф 50фициента инструментальной чувствительности и кажущегося десятичного молярного коэффициента экстинкции погрешность определения меньшеточность определения активности кислой Фосфатазы предлагаемым методомвыше, чем в известном способе,771 4Способ опробируют, определяя активность различных форм фермента изпечени интактных животных,Значение случайных погрешностейданного метода оценивают, рассчитывая основные метрологические характеристики й,ю,Б,Е ,п,Я, являющиесямерой воспроизводимости, из результатов десяти параллельных определений. Значения удельной активностивсех форм фермента близкие к приводимым в,литературе. Стандартное отклонение среднего результата не превышает 1 Е, степень рассеивания отдельных измерений около средней низкая (менее 5 Е), выборка однородна.Проводят измерение активности кислой фосфатазы в течение шестичасового периода ночного времени суток,с 0 ч. В течение выбранного периодавремени активность исследованнойгидролазы претерпевает существенныеизменения. К 3 ч ночи она нескольковозрастает, а к 6 ч утра значительноснижается, общая и доступная формы -в 2 раза, свободная - 1,5 раза.Аналогичным образом изменяется показатель целостности лизосомальных мембран. В изменении активности этихдвух Форм фермента наблюдается наибольшая синхронность, Противоположный характер носит динамика показателя лабиализации лизосомных мембран.Наименьшее значение показателя лабиализации лизосомных мембран приходится на 3 ч ночи. Уровень активности различных Форм кислой фосфатазы и показатели структурно-Функционального состояния лизосом з печени кроликов даны в табл.2.формула изобретения Способ определения кислой фосфатазы из печени животных, включающий смешивание Ферментного препарата печени с субстратом, инкубацию смеси, остановку Ферментативной реакции кислотой,добавление аналитического реагента с последующим спектрофотометрированием, о т л и ч а ю щ и й с я тем, что, с целью повышения чувствительности и точности способа, в ка,285 284 а б л Доступная Свободн Выборочное среднее, х 0,4,О сть, ч10ариабиль 0,9 тклонение, 8-1 стандартно осительна относительнение, Е 1,6 Э 5 ое стандартн относител отклонени 2,О Расчеты статистических показателей проводят на основании результатов десяти параллельных определенийфермента из печени животного, взятой в 0 ч. н и име честве аналитического реагента используют смесь молибдата аммония саскорбиновой кислотой нри их соотношении 112 - 1:12. Основные метрологические характеристики Стандартное отклонение среднего результата, + Б10Абсолютная воспроизводимост среднее отклонение от среднего, й 10 воспроизводимость: ое среднее отклобПродолжение табл.1 Активность, вкатал/кг белбщая(нкатал/мг) 10общая доступная свободная 65+ 9 231,6 26+ 2,9 59 + 6,8 34 + 4,2 0,18+ 0,03 0,08+ 0,02 0,23 + 0,03 П р и м е ч а н и е. Результаты на материале от пятиживотных, взятом в течение 1 сутв указанные часы. Составитель И. ТарееваРедактор Н. Гунько ТехредЛ.Олейник Корректор М. Пожо Тираж 777 ПодписноеВНИИПИ Государственного комитета СССРпо делам изобретений и открытий113035, Москва,.Ж, Раушская наб., д. 4/5 Заказ 552/24 Производственно-полиграфическое предприятие; г. Ужгород, ул. Проектная,4 137 +18 61+8 34+3 Время суток, ч 36 144 +30 67 + 9 72 +10 . 32+ 3
СмотретьЗаявка
3898994, 21.05.1985
УНИВЕРСИТЕТ ДРУЖБЫ НАРОДОВ ИМ. ПАТРИСА ЛУМУМБЫ
СЯТКИН СЕРГЕЙ ПАВЛОВИЧ, ФРОЛОВ ВИКТОР АЛЕКСЕЕВИЧ
МПК / Метки
МПК: G01N 33/48
Метки: животных, кислой, печени, фосфотазы
Опубликовано: 07.03.1987
Код ссылки
<a href="https://patents.su/5-1294771-sposob-opredeleniya-kislojj-fosfotazy-iz-pecheni-zhivotnykh.html" target="_blank" rel="follow" title="База патентов СССР">Способ определения кислой фосфотазы из печени животных</a>
Предыдущий патент: Способ извлечения хлорида калия из сильвинитовых солей
Следующий патент: Деаэрационная колонка
Случайный патент: Способ контроля обрыва демпфирующего диода в цепи с электромагнитной нагрузкой