Способ получения аммонийалкиловых эфиров фосфорной кислоты (его варианты)
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
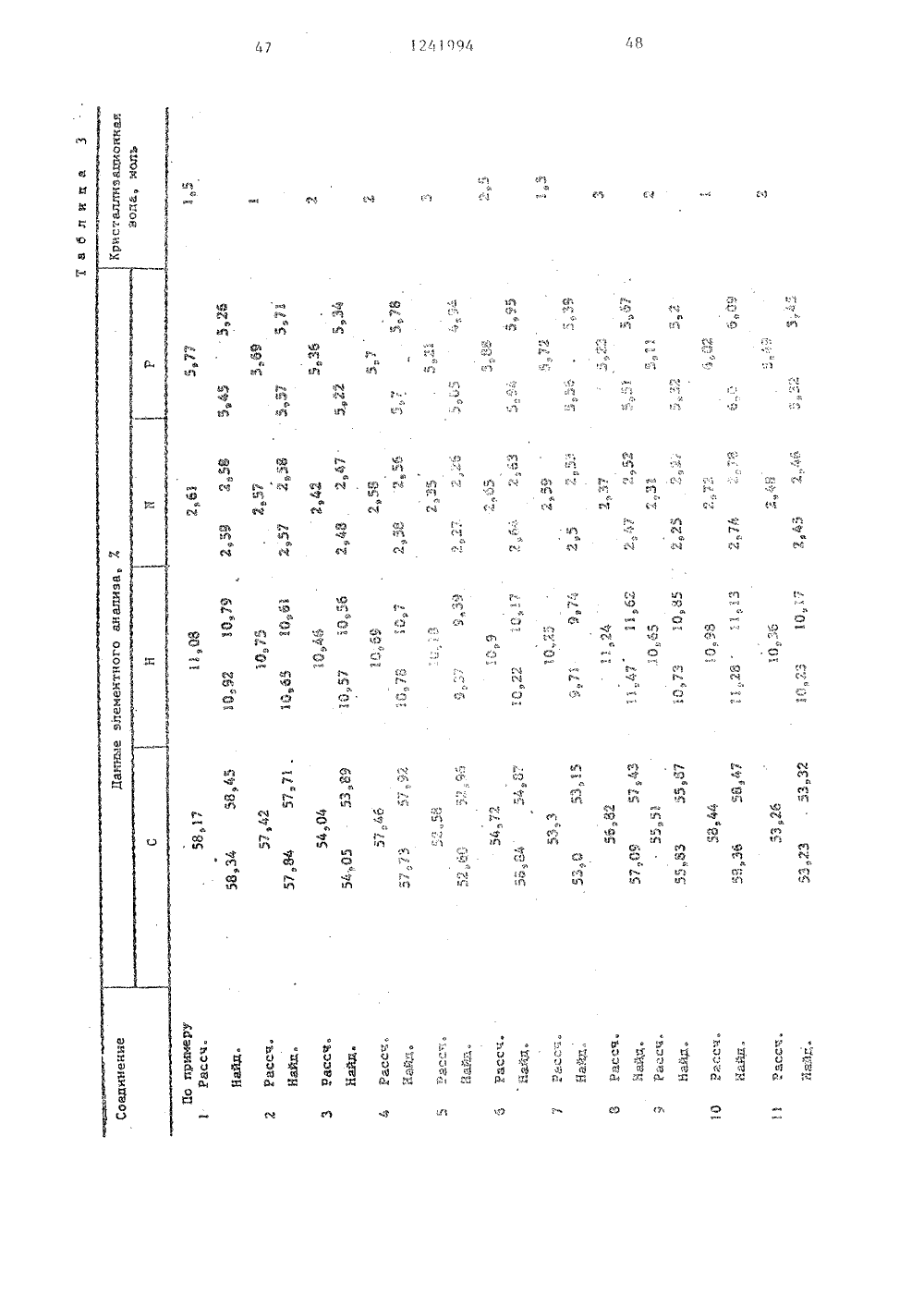
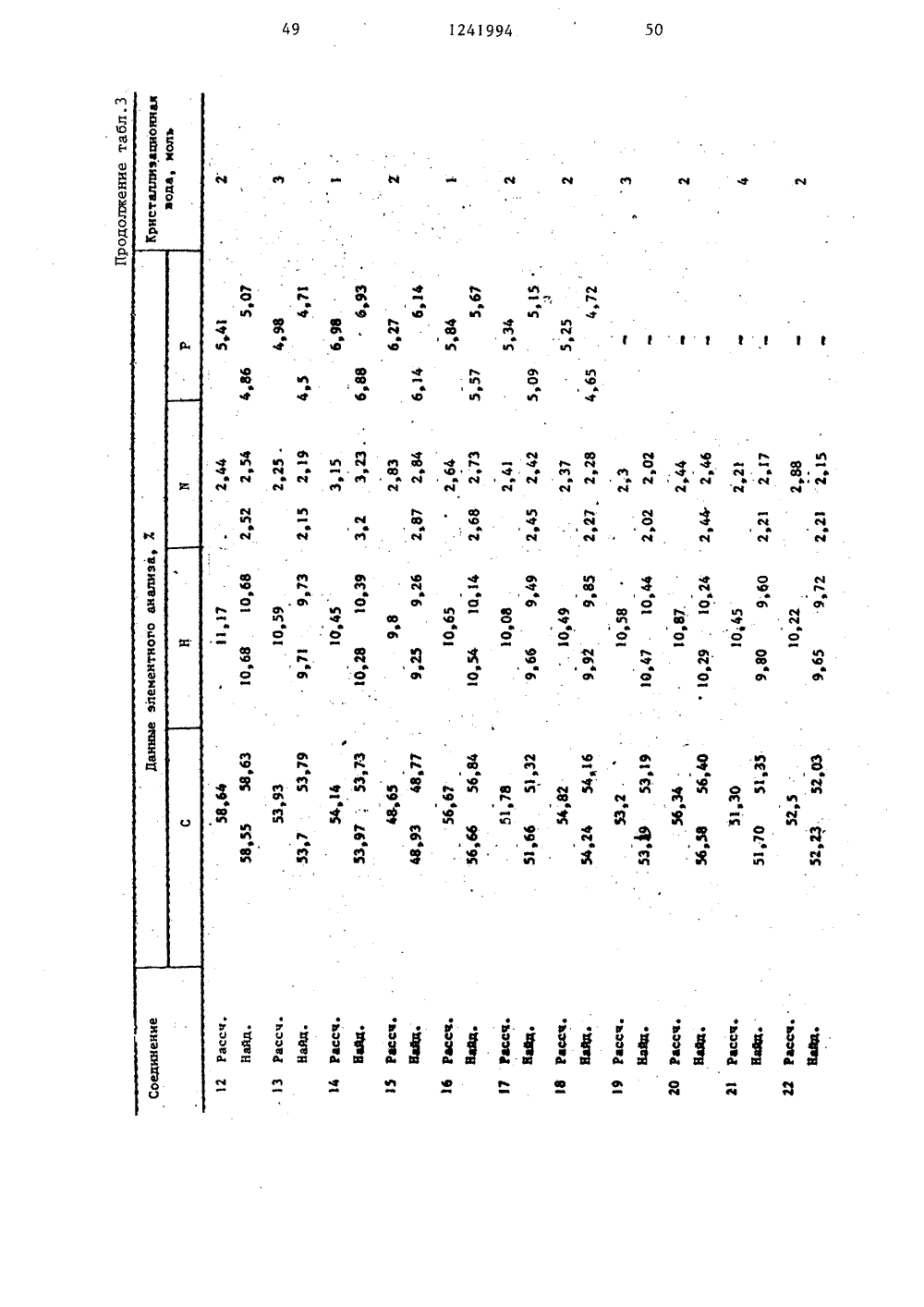
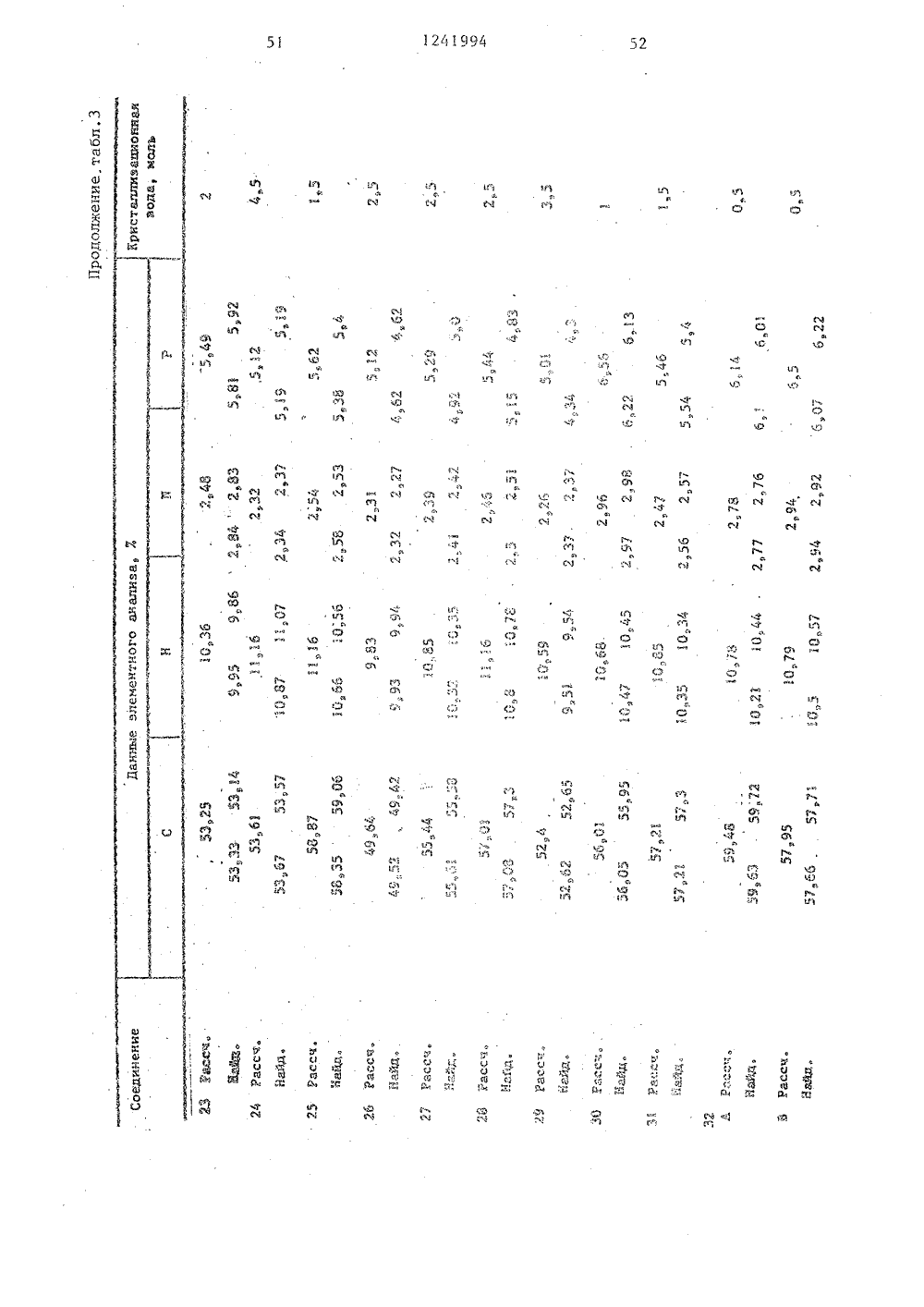
(50 4 С 07 Р 9/09 65, А 61 К 31/66 О ЕНИЯ ББ иБ - вокил ающийся формулы заклобще 1- Б - Н) 19.77 ТЫ ЯЕГОБл Бгения, подвединениемС 1еащ 4Ю з кией- прямой илиный, насьпцнасьпценныйкоторый можзорван атода где Б разветвленнный или неС-С -алк ет быть ра-. ом кислоро - ССь-циклоалмой или разв насьпценньп 3 ил илен пря вленный,. нас ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТ ОПИСАН ИН ПАТЕНТУ(33) РЕЯ 46) 30,06.86. Бюл.24Я 71) Берингер Маннхайм ГмбХ (3 ЭЯ 72) Эльмар Бозиес, Руди Галл,Гюнтер Вайманн, Уве Бикери Вульф, Пальке (БЕ)Я 53) 547.26, 118.07(088.8)Я 56) Заявка ФРГ2009341,кл. С 07 Р 9/1 О, 1978.Заявка ФРГ2009342,кл, С 07 Р 9/10, 1980.Заявка ФРГ2619715,кл. А 61 К 39/00, 1977,Заявка ФРГ2619686,кл, А 61 К 31/685, опубликЯ 54) СПОСОБ ПОЛУЧЕНИЯ АММОВЫХ ЭФИРОВ ФОСФОРНОЙ КИСЛОВАРИАНТЫ)Я 5) 1, Способ получения аммонийловых .эфиров фосфорной кислоты оформулы щенный Сг-Сп-алкилен который может быть однократно или двукратн замещен С -С 4-.алкоксикарбонилом, фенилом С-С-алкоксигруппой, в свою очередь эамеще ной фенилом или С-Салкок си группой прямой или разветвленный Сг-Сл-алкилен; дород или низший ал кислород или сера;0 или 2,в том, что соединен и и имеют указанные ергают взаимодействию общей формулы где Б имеет указанные значения,в присутствии акцептора хлористоговодорода в среде абсолютного инертного органического растворителя -хлорированного углеводорода или толуола при повышении температуры от-5 С до комнатной, образующийся продукт последовательно обрабатываютводным раствором хлористого калияпри повьнпении температуры от 0 до40.С, аммиаком или алифатическим амином в среде указанного органическогорастворителя с добавлением яиетонит 1 б151241994П р и м е р 29. Получение монохолинового эфира 2-метилЗ-октадецилсульфонилпропил-(1)-фосфорной кислоты. 5В результате окисления. соединения,описанного в примере 25, 307-ной перекисью водорода в ледяной уксуснойкислоте получают целевой процукт,(выход 497) с т.пл, 59 С (спекание), 1 О227234 С (разл.).П р и м е р 30, Получение монохолинового эфира 3-тетрадецилмеркаптопропил-(1)-Фосфорной кислоты,Аналогично примеру 1 из 3-тетрадецилмеркаптопропанолаполучают1,9 (587) целевого продукта в видемоногидрата с температурой спекания63 С и т.разл. 231-233 С.Из 945 г 3-тетрадецилмеркаптопропанола (т.пл. 34 38 оС), который вводят во взаимодействие по аналогии сметодикой, описанной в примере 1,получают 1,9 г ( 587) целевого продукта.25П р и м е р 31. Получение монохолинового эфира 2-метил-октадецил"сульфинилпропил-(1)-Фосфорной кислоты.Аналогично примеру 1 из 2-метил- ЗО3-октадецилсульфинилпропанола(т.пл. 56-58 С, т.разл. 235-240 С)получают целевой продукт (выход 127,)От,разл. 234-240 С, содержит 1,5 мольводы.3 ДП р и м е р 32, Получение (3гексадецилмеркаптопропил)-.2-(диэтиламмоний)-этилфосфата,А, Аналогично примеру 6 при замене триметиламина диэтиламином получа" 4 Оют целевой продукт. Выход 157., температура спекания 66 С и т.пл, 104110 С (с образованием прозрачногоорасплава). Соединение кристаллизуется с 1/2 моль воды.1 сВ. При применении 337.-ного раство"ра диметиламина в этиловом спирте получают с выходом 97 (3-гексадецилмер"каптопропил)-2 (диметиламмоний)этилфосфат, который кристаллизуется с1/2 моль воды, температура спекания84 С, а т.пл, 145-150 С (образуетсяпрозрачный расплав). С. При применении 337.-ного раст вора метиламина в этиловом спирте получают с выходом 197.(З-гексадецилмеркаптопропил)-2-(метиламмоний)этилфосфат, температура плавления которо 1 го 91 С, т.пл. 194"С (с образованием прозрачного расплава).:О. При применении концентрированного водного раствора аммиака с выходом 117 получают (3-гексадецилмеркаптопропил)-2-аммонийэтилфосфат,. Температура спекания полученногосоединения 170 С, при 195 ОС начинаетося его плавление, а при 218 С образуется окрашенный в коричневый цветрасплав, Соединение кристаллизуетсяс 1/2 моль воды.П р и м е р 33, Получение монохолинового эфира 3-гексадецилмеркапто-метилпропил-(1)-Фосфорной .кислоты.Аналогично примеру 1 из 2-метил-3-гексадецилмеркаптопропанола получают моногидрат целевого продукта,который спекается при 60 аС, медленноразлагается при 229-235 С.оП р и м е р 34. Получение монохолинового эфира 2,2-диметил 3-гексадецилмеркаптопропил- (1)-фосфорнойкислоты.Аналогично примеру 1 из 2,2 диметил" гексадецилмеркаптопропанола 1получают целевой продУкт с выходом347 который содержит 1,5 моль воды,о оспекается при 70 С, при 228 С начионает плавиться, при 235-238 С разлагается.П р и м е р 35Получение монохолинового эфира цис -, и соответственно транс -3-октадецилмеркаптоциклогексил- (1) -фосфорной кислоты.Аналогично примеру 1 из ис- илитес3-октадецилмеркаптоциклогексанола получают с выходом 127 целевойпродукт (ЦЧС ) с температурой спекания 51 аС и т,пл. 241-244 С (разложение) или целевой продукт ( транс,)ос температурой спекания 45 С и т.пл.239 241 С (разл.). По данным элементного анализа оба продукта содержат 1.,5 моль воды.П р и м е р 36. Получение монохолинового эфира 3-(14-метокситетрадецилмеркапто)-пропил- (1)-фосфорнойкислоты,Аналогично примеру 1 из 3-(14Аналогично примеру 1 из 3-гексадецилмеркаптопропанолапри использовании метилдиэтиламина получают целевой продукт с выходом 13%, Соединениеспекается при 40 С, т.разл. 119 С,содержит 4,5 моль воды,П р и м е р 38, Получение монохолинового эфира 2-изопропил-октадецилмеркаптопропил-(1) -Фосфорной 1 Окислоты,10,1 г диэтилового эфира изопропилмалоновой кислоты восстанавливаютв 150 мл безводного диэтилового эфира 2,7 г литийалюминийгидрида, В результате получают 5,9 г маслообразного вещества, которое по данным хро"матографии в тоцком слое однородно,По аналогии с примером 20 А осуществляют взаимодействие с бензолсульфохлоридом, в результате чего получают монобензолсульфонат 2-изопропилпропил,3-диола (выход 42%) в виде бесцветного маслообразного вещества.По аналогии со способом, описанным в примере 20 В, из образующегося соединения получают 2-изопропил- -октадецилмеркаптопропанол с выходомо 30 87% и т.пл. 29 С. Фосфорилирование и обработку триметиламином проводят по методикам примера 20 С. Целевой продукт получают с выходом 37% в виде кристаллического вещества (1,5 моль воды), температура спекания 85 ОС, т.пл. 230-233 С (разл.),П р и м е р 39. Получение монохолинового эфира 3-гептадецилмеркапм то,2-диметил-пропил-(1)-фосфорной40 кислотыПо аналогии со способом, описанным выше, с выходом 30% получают бензолсульфонат 1-окси 2-метил 3- бутанона в виде маслообразного веще 45 ства, В результате взаимодействия его с гептадецилмеркаптаном.и после очистки с помощью хроматографии на колонке получают с выходом 61% 1-гептадецилмеркапто-метилбутанон в50 виде маслообразного вещества. Восстановление его литийалюминийгдриДом приводит к получению 1,2-диметил 3 гептадецилмеркаптопропанола (выход 85%)с т,пл, 28-30 С и однороден по данным хроматографии в тонком слое. Его фосфорилирование и последующие операции проводят способом, указанным в примере 20 С, в результате чего с выходом 13% получают целевойпродукт, который кристаллизуется с1,5 моль воды, спекается при 55 С.От.пл. 230-233 С (разл,),П р и м е р 40, Получение монохолинового эфира 3-метил-октадецилмеркаптопропил-(1)-фосфорной кислоты.2 г 3-октадецилмеркаптобутанола(т.пл. 35-38 С) фосфорилируют способом, указанным в примере 20 С, послечего осуществляют дальнейшие операции с целью получения холинового эфира (185 г, 59%). После очистки наколонке, заполненной силикагелем,получают кристаллическое вещество,спекающееся при 58 С, окрашивающеесяопри 208 С и разлагающееся при 232 С.Соединение кристаллизуется с 1,5 мольводы.Исходный реагент получают следующим способом.1,3 Бутиленгликоль вводят во взаимодействие с уксусным ангидридомпри комнатной температуре, в результате чего получают 1,3-бутандион-ацетат (выход б 3%),Затем в присутствии пиридина осуществляют его этерификацию бензолсульфохлоридом, после чего продукт реакции на заполненной силикагелем колонке элюируют смесью диэтилового эфираи лигроина (1:1). Получают бесцветное маслообразное вещество (выход24%), которое по методике примера20 В вводят во взаимодействие с октадецилтиолатом натрия, после чегопроводят обработку разбавленным раствором гидроокиси натрия. Получают3-октадецилмеркаптобутанол (выход12% ), т.пл. 35-38 С.П р и м е р 41. Получение монохолинового эфира 3-(9-октилоксинонилмеркапто)-пропил-(1)-фосфорной кислоты,По методике, описанной в примере 20 С, Фосфорилируют 3-(9-октилок синонилмеркапто) -пропанол (т.пл. 29- 32"С) и после указанной в том же примере обработки реакционной смеси получают с выходом 39% целевой продукт, который кристаллизуется с 1,75 моль воды, Температура спекания продуктао50 С, а при дальнейшем нагревании вещество разлагается при 221-224 С.оП р и м е р 42, Получение монохолинового эфира 3-(4-тридецилоксибутилмеркапто)-пропил-(1)-Фосфорнойкислоты,2,3 г натрия растворяют при нагревании в 44 мл 1,4-бутандиола, кприготовленному раствору прибавляют38 мл 1-бромтридекана и реакционнуюсмесь перемешивают в течение 5 ч при150 С, После охлаждения реакционнойсмеси проводят экстрагирование смесью диэтилового эфира и лигроина(1:2), экстракт упаривают и полученный остаток подвергают очистке на за"полненной силикагелем колонке приприменении в качестве элюирующего 1;средства лигроина, который затем заменяют смесью диэтилового эфира илигроина в соотношении 1;1. Полученные Фракции объединяют и упаривают,В результате получают 19,4 г однород" 20ного по данным хроматографии в тонком слое 4 тридецилоксибутанола(т.пл. 26 29 С), выход продукта 71%,10 г полученного соединения растворяют в 100 мл диэтилового эфира, 2.прибавляют 0,6 мл пиридина, к приготовленному раствору прибавляют покаплям 1,4 мл трехбромистого Фосфора,причем охлаждают на бане со льдом.После выдержки реакционной смеси в ЗОтечение ночи при комнатной температуре разбавляют диэтиловым эфиром,раствор встряхивают с охлажденнойльдом водой, эфирный экстракт отделяют, сушат и упаривают. Остаток 35(9,2 г) окрашенного в желтоватыйцвет маслообразного вещества хроматографируют на заполненной силикагелемколонке при использовании в качествеэлюирующего средства смеси диэтилового эфира и лигроина, взятых в соотношении 1;1. Однородные фракции объединяют и упаривают. В результате получают 5,5 г (45%) однородного по данным хроматографии в тонком слое 4-тридецилоксибутилбромида в виде жел"товатого маслообразного вещества.Полученный бромид перемешивают втечение 3 ч при температуре кипенияреакционной смеси с обратным холо 50дильником с 1,9 г метилового эфираД -меркаптопропионовой кислоты в75 мл метилового спирта, в, которомсодержится 378 мг натрия, Затем раст 5 Гвор упаривают и полученный остатокснова подвергают очистке с помощьюхроматографии на колонке Злюирующеесредство - диэтиловый эфир и лигроин в соотношении 1:10. В результате получают 5,7 г (93%) метилового эфираф -(4" тридецилоксибутилмеркапто)-пропионовой кислоты. в виде желтоватого маслообразного вещества.Полученный эфир восстанавливают в 70 мл диэтилового эфира с применением 0,4 г литийалюминийгидрида. Послеперемешивания реакционной смеси втечение 1 ч при температуре кипенияпроводят разложение обычным способом,остатокполученный после упариванияэфира элюируют на заполненной силикагелем колонке смесью диэтиловогоэфира и лигроина в соотношении 1:1.В результате получают 4 г (77%) 3-(4-тридецилоксибутилмеркапто)-пропанола в виде однородного по данным хроматографии в тонком слое продукта, т.пл. которого 32-34 С.Взаимодействие, сопровождающееся образованием целевого продукта, осуществляют по аналогии с методикой, описанной в примере 20 С. Получают 2,1 г (33%) продукта с температурой спекания 55 С и т,разл. 218 С. Про дукт кристаллизуется с 2,5 моль воды.П р и м е р 43. Получение монохолинового эфира 3-пентадецилмеркаптопропил"(1)-Фосфорной кислоты.1-Бромпентадецил вводят во взаимо действие с эфиром Ь -меркаптопропионовой кислоты и полученный сиропообраэньп продукт восстанавливают литийалюминийгидридом до 3-пентадецилмеркаптопропанола. Выход 84%. Т,пл. 36- 39 С.Последующие операции осуществляют по аналогии с примером 20 С. Выход целевого продукта 61%, температура спекания 60"С, т.разл. 237 С. Соединение кристаллизуется с 1,25 моль воды.П р и м е р 44. Получение монохолинового эфира 5-гексадецилмеркаптоамил-(1)-фосфорной кислоты.5-Гексадецилмеркаптопентанол (тпл, 40-43 С), полученный из 1,5- -пентадиола через маслообразный монобензолсульфонат с гексадецилмеркапто катом натрия с выходом 63%, фосфорилируют, осуществляют взаимодействие, сопровождающееся образованием холи нового эфира, выход 41%. Растворимый в воде кристаллический продукт спекаОется при 58 С и разлагается при 228 24994230 С. Продукт кристаллизуется с1,5 моль воцг)г,П р и м е р 45. 11 олучение монохолипового эфира 3-(1 О-н-бутоксиде 5цилоксиэтилмеркатгто)-пропил-(1)-ФосФорнои кислоты,3-0"и-Бутоксидецилоксиэтилмеркапто)-пропанол (т.пл. 23-27 С) Фосфо-.рилируют способом, указанным в примере20 С, после чего осуществляют взаимодействие, сопровождающееся образованием холинового эфира. Получают целевой продукт в виде растворимого вводе кристаллического вещества (выход 1535%) с температурой спекания 36 С ит.разл, 227-229 С,Гигроскопическое кристаллическоевещество находится в Форме дигидрата.Исходный реагент получают следующим способом.Иононатрий,10-децилдиол вводятво взаимодействие с н-бутилбромидом,в результате чего получают в видемаслообразного вещества 10-н-бутоксидеканол (выход 62%). Полученное соединение бромируют трехбромистым Фосфором в присутствии пиридина, Выходмаслообразного вещества 37%. Послевзаимодействия полученного 10-н-бу)гоксидецилбромида с мононатрийэтиленгликолем получают маслообразный 1 О-н-бутоксидецилоксиэтанол с выходом36%, который снова вводят во взаимодействи с трехбромистым Фосфором вприсутствии пиридина, в результатечего получают 10-и-бутоксидецилоксиэтилбромид (выход 52 Ц . В результатевзаимодействия последнего с метиловымэфиром / -меркаптопропионовой кислотыов присутствии метилата натрия получают с выходом 49% маслообразный метиловый эфир /Ъ -(10-н бутоксидецилоксиэтилмеркапто)-пропионовой кислоты,который восстанавливают литийалюминийгидридом, в результате чего получают с выходом 90% 3-(10-бутоксидецилоксиэтилмеркапто)-пропанол (т.пл.23-.27 С).50П р и м е р 46. Получение монохолинового эФира 3-(11 гексилоксиундецилмеркапто)-пропил- (17 -Фосфорнойкислоты.О11- Бром-ундеканол ( т, пл. 45-48 С)вводят во взаимодействие с гексанолятбм натрия и полученный сиропообразный продукт вводят в реакцию с трехбромистым фосфором в присутствии пи ридина, Структура полученного маслообразггого вещества соответствуетструктуре 1-бромундецилоксигексана,что подтверждено масс-спектроскопически, Г 1 олучеггное бромсодержащее соединение вводят во взаимодействие сметиловым эфиром Р -меркаптопропионовой кислоты в растворе метилатанатрия и полученное маслообразноевещество непосредственно после этоговосстанавливают литийалюминийгидридом до 3-(11-гексилоксиундецилмеркап"то) -пропанола (т.пл, 27 29 С). Фосфорилирование и получение холиновогоэфира проводят по аналогии со способом, описанным в примере 20)С, в результате чего получают целевой продукт с выходом 55% в виде моногидраота, который при 98 С спекается, апри 226-229 С разлагается.П р и м е р 47, Получение монохолинового эфира 3-(7-децилоксигептилмеркапто)-пропил- (1)-фосфорнойкислоты.3-(7-Децилоксигептилмеркапто)-пропанол (т.пл. 28-32 С) получают путемвзаимодействия 1,7-гептандиола с-бромдеканом, бромирования полученного соединения до 7-децилоксигептилбромида, его взаимодействия с метиловым эфиром ) -меркаптопропионовойкислоты, приводящего к получению метилового эфира (-(7-децилоксигептил"меркапто)-пропионовой кислоты, и еговосстановления литийалюминийгидридомпо аналогии с описанным в примере20 С. Полученное соединение вводятво взаимодействие, сопровождающеесяполучением целевого холинового эфира(выход 17%). Растворимое в воде крис"таллическое вещество спекается при 53 С, т.пл. 224 С.Аналогично примеру 1 из 3-(3-тетрадецилоксипропилмеркапто)-пропанола (т.пл. 38-41 С), полученного из метилового эфира Р -меркаптопропионовой кислоты и 1-бром-тетрадецилоксипропана в растворе метилата натрия с последующим восстановлением литийалю-. минийгидридом, получают монохолиновый эфир 3-(3-тетрадецилоксипропилмеркапто) пропил-(1)-Фосфорной кислоты, (выход 38%), который спекается при 52 С и имеет т.пл, 230-233 С (разл.) П р и м е р 48. По аналогии с примером 20 взаимодействием 3-гексадецилмеркапто-метоксипропанола-(1)10 П р и м е р 51. По аналогии с примером 48 при использовании 2-метокси-(таяс -октадец-енилмеркапто)-пропанола-(1) (воскообразное ве щество) в качестве исходного реагента получают монохолиновый эфир 2-метокси-(ОЮ -октадец".енилмеркап(воскообразное вещество) с дихлор- -бромэтилфосфатом, последующим омылением, обработкой триметиламином и уксуснокислым серебром получают моно 5 холиновый эфир 3-гексадецилмеркапто- -2-метоксипропил-(1)-Фосфорной кислоты (т.пл. 255-256 фС) с выходом 167. Вещество содержит 1 моль кристаллизационной воды.Примененный в качестве исходного реагента 3-гексадецилмеркапто-метоксипропанол-(1) получают в результате взаимодействия 2-метокси 1,3- -пропандиолмонобензолсульфоната (мас лообразное вещество) с натриевой со " лью гексадецилмеркаптана.П р и м е р 49, По аналогии с примером 48 в результате использования 3-гептадецилмеркапто-метокси- ц пропанола-(1)(воскообразное вещество) в качестве исходного реагента получают монохолиновый эфир З-гептадецилмеркап." то-метоксипропил-(1)-Фосфорной кис" лоты с выходом 117. (т.пл. 255-257 С). 15 Вещество содержит 2 моль кристаллиза" ционной воды.Примененный в качестве исходного реагента 3-гептадецилмеркапто-метоксипропанол-(1) получают в резуль тате взаимодействия 2-метокси "1,3- -пропилдиолмонобензолсульфоната с натриевой солью гептадецилмеркаптана.П р и м е р 50. По аналогии с примером 48 в результате использования 2-этокси-гептадецилмеркаптопропанола-(1) (воскообразное .вещество,от.пл. ниже 50 С) в качестве исходного реагента получают монохолиновый эфир 2-этокси-гептадецилмеркапто пропил- (1)-Фосфорной кислоты т.пл.225-230"С) с выходом 187. Вещество содержит 2 моль кристаллизационной воды.Примененный в качестве исходного реагента 2-этоксигептадецилмер каптопропанол-(1) получают в результате взаимодействия 2-этокси,3-пропилдиолмонобензолсульфоната масло образное вещество) с калиевой солью гептадецилмеркаптана. то)-пропил-(1)-Фосфорной кислоты (воскообразное вещество) с выходом 127. Вещество содержит 3 моль кристаллизационной воды.Примененный в качестве исходного реагента 2-метокси-(тРонс -октадец- -9-енилмеркапто)-пропанол(1) получают в результате взаимодействия 2- -метокси,3-пропандиолмонобензол сульфоната с натриевой солью транс .-октадец-енилмеркаптана.П р и м е р 52. По аналогии с примером 48 при использовании 2-метокси-З-(октадец,12-диенилмеркапто) -пропанола-(1) (воскообразное вещество) в качестве исходного реагента получают монохолиновый эфир 2-метокси"3-(октадец,12-диенилмеркапто) пропил-(1)-фосФорной кислоты (воскообразное вещество) с выходом 117 Вещество содержит 3 моль кристаллиэационной воды.Примененный в качестве исходного реагента 2-метокси(октадец 9,12- " диенилмеркапто) -пропанол-(1) по./ лучают в результате взаимодействия 2-метокси,3-пропилдиолмонобензол-. сульфоната с натриевой солью октадец" -912-диенилмеркаптана.П р и м е р 53. По аналогии с примером 48 при использовании 2-метокси-(1-метилоктадецилмеркапто)- -пропанола-(1) (воскообразное вещество) в качестве исходного реагента получают монохолиновый эфир 2 меток си(1 метилоктадецилмеркапто)-про пил-(1)-Фосфорной кислоты ( т.пл.256-258 С) с выходом 347 Вещество содержит 2 моль кристаллизационной воцы.Примененный в качестве исходного реагента 2-метокси"(1-метилоктадецилмеркапто)-пропанол-(1) получают в результате взаимодействия 2-метокси,3-пропилдиолмонобензолсульфоната с калиевой солью 1-метилоктадецил" меркаптана. П р и м е р 54. По аналогии с примером 48 при использовании в качестве исходного реагента 3-(3 геп тилдецилмеркапто)-2-метоксипропанола -(1) (воскообразное вещество) получают монохолиновый эфир 3-(3 гептилдецилмеркапто)-2-метоксипропил(1) фос Форной кислоты (воскообразное вещест во) с выходом 487. Вещество содержит 1 моль кристаллизационной воды.Примененный в качестве исходногореагента 3-(3-гептилдецилмеркапто)-2-метоксипропанол-(1) получают врезультате взаимодействия 2-метокси,3-пропилдиолмонобензолсульфонатас калиевой солью 3-гептилдецилмеркаптана.П р и м е р 55, По аналогии спримером 48 при использовании в ка 1честве исходного реагента 2-метокси-(3-тетрадецилоксипропилмеркапто)-пропанола-(1) (воскообразное вещество) получают монохолиновый эфир2-метокси-(3-тетрадецилоксипропил-1меркапто)-пропил-(1)-фосфорной кислоты (т,пл, 242-244 С) с выходом 18%.Вещество содержит 2 моль кристаллизационной воды.Примененный в качестве исходногореагента 2-метокси-(3-тетрадецилоксипропилмеркапто)-пропанол-(1) получают в результате взаимодействия 2-метокси,3-пропилдиолмонобензолсульфоната с калиевой солью 3-тетрадецилоксипропилмеркаптана.П р и м е р 56. По аналогии спримером 48 при. использовании в качестве исходного реагента 3-(5-додецилоксипентилмеркапто)-2-метоксипропано 30ла-(1) получают монохолиновый эфир3-(5-додсцилоксиамилмеркапто)-2-метоксипропил-(1)-фосфорной кислоты(т.пл. 245-247 сС) с выходом 25%. Вещество содержит 2 моль кристаллизаци35снной воды,Примененный в качестве исходногореагента 3-(5-додецилоксиамилмеркапто)-2-метсксипропанол-(1) получаютв результате взаимодействия 2 меток 40си,3-пропилдиолмонобензолсульфонатас калиевой солью 5-додецилоксиамил"меркаптана,П р и м е р 57. Пс аналогии спримером 48 при использовании в каче-45стве исходного вещества 2-метокси-(Я=нонилоксиоктилмеркапто)-пропанола-(1) (воскообразное вещество) гсолучают монохолиновый эфир 2-метокси-(8-нонилоксиоктилмеркапто)-пропил 50-(1)=фосфорной кислоты (воскообразноевещество) с выходом 20%,.Вещество содержит 1 моль кристаллизационной воды,Примененный в качестве исходного реагента 2-метокси-(8 нонилоксисктилмеркаптс)-пропанол-(1) получают в результате взаимодействия 2-метокси,3-пропилдиолмонобензолсульфоната с калиевой солью 8-нонилоксиоктилмеркаптана.П р и м е р 58. По аналогии с 5примером 48 при использовании в качестве исходного соединения 2-этил-гексадецилмеркаптопропанола-(1)(воскообразное вещество) получают 0монохолиновый эфир 2-этил-гексадецилмеркаптопропил-(1)-фосфорной кислоты (т.пл. 236-238 ОС) с выходом 41%.Вещество содержит 2 моль кристаллизационной воды.Примененный в качестве исходногореагента 2-этил-гексадецилмеркаптопропанол-(1) получают в результатевзаимодействия 2-этил,3-пропилдиолмонобензолсульфоната с натриевсй солью гексадецилмеркаптана.П р и м е р 59, По аналогии сописанным в примере 48 при использовании в качестве исходного реагента2-пропилгексадецилмеркаптопропанола-(1) (воскообразное вещество)получают монохолиновый эфир 2-пропил-гексадецилмеркаптопрспил-(1)-фосфорной кислоты (т,пл. 239-242 С) свыходом 13%. Вещество содержит 2 молькристаллизационной воды.Примененный в качестве исходногореагента 2-пропил-гексадецилмеркаптопропанол-(1) получают в результатевзаимодействия 2-пропил,3-пропилдиолмонобензолсульфоната (маслообразноевещество) с натриевой солью гексадецилмеркаптана.П р и м е р 60. По аналогии спримером 48 при использовании в качестве исходного реагента 2-н-бутил- -октадецилмеркаптопропанола-(1) (вос"косбразное вещество, т,пл, 36-40 С)получают монохолиновый эфир 2-нбутил-октадецилмеркаптопропил-(1)- -фосфорной кислоты (т.пл. 232-238 С)с выходом 17%, Вещество содержит4 моль кристаллизационной воды.Примененный в качестве исходногореагента 2-н-бутил-октадецилмеркаптопропанол-(1) получают в результатевзаимодействия 2-н-бутил,3-пропил диолмонобензолсульфоната (маслообразное вещество) с натриевой солью сктадецилмеркаптана.1 П р и м е р 61. По аналогии с примером 48 при использовании в качестве исхсднсгс вещества 2-бензилскси- -3-октадецилмеркаптопропанола-(1)(воскообразное вещество; т.пл. 39.- 42 С) получают монохолиновый эфир 2- -бензилокси-октадецилмеркаптопропил-(1) фосфорной кислоты (т,пл, 2.10- 212 С) с выходом 28%. Вещество содер жит 1 моль кристаллизациойной воды.Примененный в качестве исходногореагента 2-бензилокси-октадецилмеркаптопропанол-(1) получают в резуль О тате взаимодействия 2-бензилокси,3- -пропилдиолмонобензолсульфоната,(маслообразное вещество) с натриевой солью октадецилмеркаптана.П р и м е р 62. По аналогии с 15примером 48 при использовании в качестве исходного вещества 2-метоксиметил 3-гексадецилмеркаптопропанола-(1)(воскообразное вещество) получают мо"нохолиновый эфир 2-метоксиметил-гек"20садецилмеркаптопропил-(1)-фосфорнойкислоты (т.пл. 243-245 ОС) с выходом22%. Вещество содержит 3 моль крис".таллизационной воды,Примененный в качестве исходного 25реагента 2 метоксиметил-гексадецил-меркаптопропанол-(1) получают в результате взаимодействия 2-метоксиметил 1,3 пропилдиолмонобензолсульфона"та (маслообразное вещество) с натри Севой солью гексадецилмеркаптана.П р и м е р 63 По аналогии спримером 48 при использовании в ка-"честве исходного вещества 2-этоксиме"тилгексадецилмеркаптопропанола-(1, З 5(воскообразное вещество) получаютмонохолиновый эфир 2-этоксиметил"3-гексадецилмеркаптопропил (1)-Фосфорной кислоты (т.пл. 243-246 дс) свыходом 11%. Вещество содержит О2,5 моль кристаллизационной воды.Примененный в качестве исходного реагента 2-этоксиметил-гексадецилмеркаптопропанол-(1) получают в ре 45 зультате взаимодействия 2 этоксиметил,3-пропилдиолмонобенэолсульфо ната (маслообразное вещество) с натриевой солью гексадецилмеркаптана,П р и м е р 64. По аналогии с примером 48 при использовании в качестве исходного вещества 2,2-бисметоксиметил-октадецилмеркаптопропанола (1) (воскообразное вещество) получают монохолиновый эфир 2,2 бис-метоксиметил 3-октадецилмеркаптопропил-(1)-фосфорной кислоты (т.пл. 237-239 С) с выходом 26%. Вещество содержит 1 моль кристаллизационной воды,Примененный в качестве исходногореагента 2,2-бис-метоксиметил-октадецилмеркаптопропанол(1) получаютв результате взаимодействия 2,2-бис-метоксиметил,3-пропилдиолмонобензолсульфоната (маслообразное вещество) с натриевой солью октадецилмеркаптана,П р и м е р 65. По аналогии спримером 48 при использовании в качестве исходного вещества 3 гептадецилмеркапто-метокси-метилпропанала-(1) (воскообразное вещество) получают монохолиновый эфир 3-гептадецилмеркапто-метокси 2-метилпропил-(1)-Фосфорной кислоты (т.пл. 244251 С) с выходом 19%, Вещество содер"жит 2 моль кристаллизационной воды,Примененный в качестве исходноговещества 3-гептадецилмеркапто-метокси-метилпропанол-(1) получаютв результате взаимодействия метилового эфира 2-метилглицидиловой кислоты с натриевой солью гептадецилмеркаптана, сопровождающегося образованием метилового эфира 3-гептадецил"меркапто-окси-метилпропионовойкислоты (т.пл. 42-45 С), с последуоющим метилированием полученного соединения йодистым метилом с получением метилового эфира 3-гептадецилмеркапто-метокси-метилпропионовойкислоты (маслообразное вещество) ивосстановления литийалюминийгидридом.П р и м е р бб, По аналогии спримером 48 при использовании в качестве исходного реагента 4-гексадецилмеркаптобутанола-(2) (воскообразноевещество) получают моноколиновыйэфир 4-гексадецилмеркаптобутил (2)-Фосфорной кислоты (воскообразноевещество ) с выходом 19%. Вещество со"держит 2,5 моль кристаллизационнойводы.Примененный в качестве исходногоматериала 4-гексадецилмеркаптобутанол"(2) получают в результате восстановления 4-гексадецилмеркаптобутанона"(2) (т.пл. 45-47 С) литийалюминийгидридом,П р и м е р 67. По аналогии спримером 48 при использовании в качестве исходного реагента 4-октадецилмеркаптопентанола-(2),(воскообразноевещество) получают монохолиновый эфир30 1241994 29 П р и м е р 72, По аналогии спримером 48 при использовании в качестве исходного реагента 2-метокси 3-(9-фенилоктадецилмеркапто)-пропанола-(1) (маслообразное вещество)получают монохолиновый эфир 2-метокси(9-Фенилоктадецилмеркапто)-пропил (1)-фосфорной кислоты (воскообразное вещество) с выходом 10 . Вещество содержит 2 моль кристаллизационной воды,Примененный в качестве исходногореагента 2 метокси-(9-фенилоктадецилмеркапто)-пропанол-(1) получаютв результате взаимодействия 2 метокси,3 пропилдиолмонобензолсульйона-та с натриевой солью 9-Фенилоктадецилмеркаптана. 4-октадецилмеркаптоамил-(2)-Фосфоро ной кислоты (т.пл. 239245 С) с выходом .7 , Вещество содержит 3 моль кристаллизационной воды.Примененный в качестве исходного реагента 4-октадецилмеркаптопентанол- -(2) получают в результате взаимодействия 2,4-амилдиолмонобензолсульфона та (маслообразное вещество) с натри евой солью октадецилмеркаптана,П р и м е р 68. По аналогии с примером 48 при использовании в,качестве исходного реагента 3-гексадецил" меркаптоциклопентанола-(1) (воскооб разное вещество, т,пл. 45-50"С) получают монохолиновый эфир 3-гексадецилмеркаптоциклоамил-(1)-фосфорной кислоты (т.пл. 253-256 С) с выходом ЗЗ , Вещество содержит 2 моль крис таллизационной воды.Примененный в качестве исходного реагента 3-гексадецилмеркаптоциклопентанол-(1) получают в результате взаимодействия 1,3-циклоамилдиолмоно бензолсульфоната (маслообразное вещество) с натриевой солью гексадецилмеркаптана.П р и м е р 69. По аналогии с примером 48 при использовании (Б)-2- зо -метилсульфонамидоЗ-октадецилмеркаптопропанола-(1) (т.пл. 85-87 С) в качестве исходного вещества получают монохолиновый эфир (Б)-2-метилсульфонамидо-октадецилмеркаптопропил- -(1)-фосфорной кислоты (т.пл, 212 215 С) с выходом 14 . Вещество содержит 1 моль кристаллизационной воды. Примененный в качестве исходного реагента (Б)-2-метилсульфонамидо-З.октадецилмеркаптопропанол (1) получают взаимодействием (Ь)-Б-октадецилцистеинэтилового эфира с метилсуль" фохлоридом, в результате чего получают (Ь)-И-метилсульфонил-Б-октадецилцистеинэтиловый эфир (т.пл. 63-65 С) с последующим восстановлением литийалюминийгидридом.П р и м е р 70. По аналогии с примером 48 при использовании в качестве исходного соединейия 3-гексадецилмеркапто-метоксиметилпропилтиола-(1) (маслообразное вещество) получают монохолиновый эфир Б-(Згек-садецилмеркапто-метоксиметилпропил)- -тиофосфорной кислоты (т.пл. 230- 235 С с разложением) с выходом 14 ,Вещество содержит 3 моль кристаллизационной воды,Примененный в качестве исходного реагента 3-гексадецилмеркапто 2-метоксиметилпропилтиол-(1) получают взаимодействием 3-гексадецилмеркаптометоксиметилпропанола-(1) с бензолсульфохлоридом, в результате чего получают 3-гексадецилмеркапто-ме токсиметилпропанол-(1)-бензолсульфонат (маслообразное вещество), который вводят в реакцию с тиомочевиной и получают соответствующую соль изо тиурония, которую подвергают последующему гидролизу 1 О н.раствором гидро- окиси калия с подкислением соляной кислотыП р и м е р 71. Поаналогии с примером 48, при использовании в качестве исходного реагента 3-(2-(И- -додецилкарбоксамидо)-этилмеркапто 1- -2-метоксипропанола-(1) (т.пл, 67- 69 С) получают монохолиновый эфир 3- 12-(И-додецилкарбоксамидо)-этилмеркапто 1-2-метоксипропил-(1)-Фосфорной кислоты (воскообразное вещество) с выходом 16 . Вещество содержит 4 моль кристаллизационной воды.Примененный в качестве исходного реагента 3-12-(Н-додецилкарбоксамидо)- -этилмеркапто 1-2-метоксипропанол-(1) получают взаимодействием 2-метокси- -1,3-прдпандиол-монобензолсульфоната с натриевой солью 2-(И-додецилкарбоксамидо)-этилмеркаптана, которую получают взаимодействием этилового эфира 3-меркаптопропионовой кислоты с додециламином.П р и м е р 73, По аналогии с примером 48 при использовании в качестве исходного реагента 3-11-(Н- -н бутилкарбоксамидо)-ундецилмеркапто 1".2-метоксипропанола-(1) (т.пл.,о62-64 С) получают монохо.линовый эФир 3-11 (11-н бутнлкарбокснамндо 1-унда цилмеркапто -2-метоксипропил-(1)-ФосФорной кислоты (воскообразное вещега ство) с выходом 13%. Вещество содержит 3,5 моль кристаллизационной воды,:Примененный в качестве исходного рааганта 3-11-(М-н-бутнлкарбоксатидо)-ундецилмеркапто 1-2-метоксипропа н нол-(1) получают в результате взаимо" действия 2-метокси,3-пропилдиолмо" нобензолсульФоната с натриевой сольк 1 11-(Б-н-бутилкарбоксамидо)-ундецилмеркаптана. 2 ОП р и м е р 74. По аналогии с примером 48 при использовании в качестве исходного реагента 2-метокси -3-октадецилмеркаптопропантиола-(1) (воскообразное вещество) получают 25 монохолиновый эФир Б-(2-метокси- -октадецилмеркаптопропил)-тиоФосФорной кислоты (т.пл. 219-221 С с разложением ) с выходом 7%Вещество содержит 4 моль кристаллизационной воды.Примененньй в качестве исходного реагента 2 метоксиоктадецилмеркал топропилтиол-(1) получают взаимодей. ствием 2-метокси-октадецилмеркапто"о 5 пропанола (1) с бензолсульФохлоридомр приводящим к образованию 2-метокси" -3 октадецилмеркаптопропил-(1)-бензолсульфоната (маслообразное вещест во), взаимодействием последнего с тиомочевиной до получения соответствующей соли изотиурония, последующим гидролизом 10 н.раствором гидроокиси калия и подкислением соляной кислотой.45П р и м е р 75. По аналогии с примером 48 при использовании 4".окта" децилмеркаптоамилтиола-(2) (т,лл, 38 40 С) в качестве исходного вещества получают 0-холиновьп эФир Б-.(4-окта" децилмеркапто-ам) тиоФосФорной кислоты (т,пл. 244 245 С с разложением) сРвыходом 9%. Вещество содержит 3,5 моль кристаллизационной воды,Примененный в качестве исходного реагента 4-октадецилмеркаптопентати ол (2) получают взаимодействием 4-ок тадецилмеркаптопентанола-(2) с бен золсульФохлоридом, приводящим к получению 4".октадецилмеркалтопентанол-(2)-бензолсульФоната (маслообразноевещество), взаимодействием последнегос тиомочевиной до получения соответствующей соли изотиурония с последующим гидролизом 10 н,раствором гидрроокиси калия и подкислением солянойкислотой,П р и м е р 76. Получение монохолинового эФира 2-метил-метоксикарбонил-Згексадецилмеркаптопропил(1)-ФосФорной кислоты.Метиловь(й эФир 2,2-бис-оксиметилмонобензолсульФонатлропионовой кисло"ты (т,пл. 58-62 С) вводят во взаимодействие с гексацецилмеркаптидом натрия в метилэвом спирте, в результатечего получают метиловый эФир 2-оксиметил"-гексадецилмеркаптометилпропионовой кислоты с т.пл. 25-27 С. Фосфо"рилирование, гидролиз и получение холинового эФира проводят по аналогиис описанным в примере 20 С, в результате чего с выходом 31% получают моногидрат целевого продукта, которыйслекается при 65 УС и разлагается при238-240 С.П р и м е р 77. Получение 0-холинового эФира Б-метил 3-гексадецилмеркаптопропил- (1)тиоФосфорнойкислотыИз полученного в примере 33 2-метил-гексацецилмеркаптопропанолаполучают через его бензолсульФонатпрн кипячении с тиомочевиной в этиловом спирте 2-метил 3-гексадецилмеркалтопропантиол, Его ФосФорилирование, гидролиэ и получение холинового эФира проводят по аналогии с примерам 20 С в результате чего получают целевои продукт (выход 17%),который после спекания при 45 С пла"Овится при 262 С с пенообразованием, .Соединение находится в Форме тригидрата.П р и м е р 78, По аналогии с примером 48 при использовании в ка" честве исходного вещества 3-гексаде" цилмеркапто-(2-метоксиэтокси)-про панола-(1) (маслообразное вещество) получают монохолиновый эФир 3-гексадецилмеркапто 2-(2-метоксиэтокси)- -пропил-(1)-ФосФорной кислоты (т.пл.257 258 С с разложением) с выходом 18%. Вещество содержит 1 моль кристалллизационной воды.новое вещество и может быть полученследующим способом.1-Тиоглицерин метилируют йодистымметилом до З-метилмеркапто,2-пропан.диола и непосредственно после этогополученный продукт вводят во взаимодействие с гидридом натрия и 1-бромгексадецилом, в результате чего получают смесь изомерных гексадециловыхэфиров, которые разделяют с помощьюхроматографии на колонке (воскообраз:ные вещества).П р.,и м е р 80. По аналогии спримером 79 взаимодействием 2-бензил-3-гексадецилмеркаптопропанола-(1) сдихлор(2-бромэтил)фосфатом, последующим омылением, реакцией с триметиламином и обработкой уксуснокислымсеребром получают монохолиновый эфир2-бензил-гексадецилмеркаптопропил-(1)-фосфорной кислоты.После переосаждения из смеси хлороформа и ацетона получают целевойпродукт (выход 1.З ) с т.пл, 220-230 С(с разложением),Примененный в качестве исходногореагента 2-бензил-гексадецилмеркаптопропанол-(1) представляет собойновое вещество и может быть полученследующим способом.Диэтиловый эфир бензилмалоновойкислоты восстанавливают литийалюминийгидридом до 2-бензил,3-пропандиола (тпл, 64-65 С) и продукт этерифицируют эквимолярным количествомбензолсульфохлорида в абсолютном пиридине, в результате чего получают2-бензил,3-пропандиолмонобензолсульфонат (маслообразное вещество).Взаимодействие с натриевой сольюгексадекантиола в этиловом спиртеприводит к получению 2-бензил-гексадецилмеркаптопропанола-(1)(воскообразное вещество).П р и м е р 81, По аналогии спримером 79 взаимодействием 3-гексадецилмеркапто-фенилпропанола-(1) сдихлор(2-бромэтил)фосфатом, последующим омылением, реакцией с триметиламином, обработкой уксуснокислым серебром получают монохолиновый эфир3-гексадецилмеркапто-фенилпропил-(1)-Фосфорной кислоты,Примененный в качестве исходногореагента 3-гексадецилмеркапто-(2-метоксиэтокси)-пропанол(1) получают в результате взаимодействия 2-(2-метоксиэтокси)-1,3-пропилдиолмоно-.бензолсульфоната (маслообразное вещество) с калиевой солью гексадецилмеркаптана.П р и м е р 79. Получение монохолинового эфира 2-гексадецилокси-метилмеркаптопропил-(1)-Фосфорнойкислоты.К 0,9 г (2,6 ммоля) 2-гексадецилокси-метилмеркаптопропанола-(1). в 1515 мл абсолютного толуола прибавляютпри (О С 0,95 г триэтиламина и затемпо каплям - раствор 0,95 г (3,6 ммоля) дихлор 2-бромэтил Фосфата в 15 мпабсолютного толуола. Смесь выдерживают в течение 5 ч при 0 С и затемперемешивают в течение ночи при 20 С.Непосредственно после этого реакционгную массу вновь охлаждают до 0 С,прибавляют к ней по каплям 11 мл 250,1 н,водного раствора хлористогокалия, в течение 1 ч проводят энергичное перемешивание при 0"С и в течение 2 ч при 20 С. После этого проводят разделение фаз. Органическую ЗОФазу сушат и упаривают. Полученныймаслообразный остаток растворяют в30 мл смеси абсолютного хлороформаи абсолютного метилового спирта (1:1),В раствор пропускают в течение 10 мннсухой триметиламин и реакционную мас су нагревают в течение 24 ч при температуре кипения с обратным холодильником. Затем растворитель отгоняют,остаток растворяют в 50 мл абсолютно- щго метилового спирта и к растворудобавляют 1 г уксуснокислого серебра,Смесь перемешивают в течение 2 ч прикомнатной температуре, проводят филь .трование, фильтрат упаривают. Маслообразный остаток подвергают очисткена 100 г силикагеля (элюирующее средство - хлористый метилен:метиловыйспирт:вода при соотношении 65:25:4).После отгонки элюирующего средстваи сушки остатка продукт переосаждаютиз смесихлороформа и ацетона. В результате получают 0,24 г (18%) аморфного и хроматографически однородногопродукта,Примененный в качестве исходногореагента 2-гексадецилокси 3-метилмеркаптопропанол-(1) представляет собой После перессаждения из смеси хло роформа и ацетона получают целевой продукт с выходом 27%. Т.пл. продукта 245 С (с разложением).формулы О1 +ВИ ьр о яз н;Н 5О И где В прямой или разветвленный, насьпценный илиненасыщенный С-С О-алкил, который можетбыть разорван атомомкислорода;ВгС-Сг,-циклоалкилен илипрямой или разветвленный,. насьпценный илиненасьпценный Сг-С-алкилен, который можетбыть однократно илидвукратно замещен СС-алкоксикарбонилом,Фенилом или С -С -алкоксигруппой, в своюочередь замещенной Фе"нилом или С,-С-алкок"сигруппой;,В - прямой или разветвлен"ный Сг-С-алкилен;В , Р и Вб - водород или низшииалкилу- кислород или сера,и - 0 или 2;заключающийся в том, что соединениеобщей Формулы В - Б 101 - В г - УН,где В, В , У и и имеют указанные значения, подвергают взаимодействию с соединением общей Формулы рипа при температуре кипения реакцианной смеси и ацетатом серебра в сре де смеси низшего спирта с хлорированным углеводородом при комнатной тем пературе,с последующим выделением це"- левого продукта или окислением его до сульфона.2. Способ получения аммонийалкиловых эфиров фосфорной кислоты общей ОцОя3 где В имеет указанные значения,в присутствии акцептора хлористоговодорода в среде абсолютного инерт-ного органического растворителяхлорированного углеводорода или толуола при повышении температуры от-10"С до комнатной с последующей обработкой полученного продукта аммиаком или алифатическим амином в средеацетонитрила в замкнутой системе при60 С с последующим выделением целеоного продукта или окислением его досульфона,Приоритет по признакам:21.10,80 В - прямой или разветвленный, насыщенный или ненасыщенный С Сго -алкил, который может бытьразорван атомом кислорода;В - С-С -циклоалкилен пря 6мой или разветвленныйнасыщенный С -Сп-алкилен, который может бытьоднократно или двукратно замещен С -С.-алкоксигруппой, в свою очередь замещенной фенилом;Вп - прямой или разветвленный Сг-С-алкилен;Л -В -В - водород или низший алкилУ - кислород;и - 0 или 2,113.05.81 Вг - прямой или разветвленный ненасьпценный Сг-С- -алкилен, который можетбыть однократно илидвукратно замещен фенилом или С, -С-алкоксигруппой, в свою очередьзамещенный С -С-алкок фсигруппой, г 1-З-гексацетцх.пьеркаттопропа 1(ххг-( 1, сДи хлор ( 2 с Р Ом 3 ти ) ф с У Я Г 0 Г ц с (".,г е ггу "ХОЩИМ ОМЬХЛЕНИСМРЕЯКБ 1 ЕЙ С г 1) )3, ХЯминОм, обработкой ухстс 110;сттдьсеРебРом ХгслУчают мгзхохог)ттОцдтх 3(цц2 е яп 1 тл ,ск (тг с хт ххт ге Р ( а "ют ц г р цвПосле гВРеосажцет:гип гг 3 "-(и ","с;,фОРМЯ И ЯЦР ГОНЯ 10)тг;ЦГГ) т(дсго(д, ГГ)СДУКТ (ВЬхор 2)г 7); тл 0.ч.дгт(0 гложеиеы)При,ецен й;1.те с ",;.д( д-,.рЕяХ ЕНТя 2, ,)Хтттд "Ге г(С где"3 д,- топэОп 31 сп 1 1 гретхс.1 Ве сгбсй псВОЕ СОЕДИНЕНИЕ Х ЬХСж Г бд 1 т Пст)",гцследу)о(хм Обг)азг)м,1(ИЗТИ)РВЬХЙ Рфнр Я)ГПН)1;Ят ОгСВСгкислОты Вссстанявлтвают,гпгиця)01- НИЙГидрИПОМ ДО 2"Ят.1",П 1 . д"ттпог,гтт; .гГла (маслообоазное вещес:вс) поз(дЧЕГО ПРОДУКТ ЗТЕРИФИЦИРУЮ Г ЗКВ":.лЯрным 1(Олиттествоь гбеХзолстгтхт 1)ох:1(.:РИЦЯ В ЯГ) СОЛЮ НОХ 1 "ПИНЕ"дГтате чего получают 2-аллип ,3-:; спандиопмонобензолсУЛХфонат (.Хьсс бРазное вепестттзс После взатгг.хсгтсй,вия с натриевой солью гекс; - .цецилтиола В зтхповох спипте цолугатот 2: я,лил-гексадецилмевкаптспвс хацол, 1-3-ок ГадеХхлыерка 1 гопропьцхопа" ,:. 1 дихлор( 2 фбромзтил) фосфя хо 1 ПсеРхттг ЮЩИМ ОМЫЛЕ НИ Ем,. р Е ЯКттИЕИ С тОЬЕ Т .:;) г ЯМИНОИОбработКОЙ уКГЧСНО(цтттыЬГ Е р .Щюм ил;гтх)от тОнг)хоцххдтг)вг;тйтгттдг2 ме х нл -3-ок ;гптедтдигмеркацтопропил-, 1)- -фосФорной кислотыПс(.гн. )ереосаждения из (.ме(ХИ хло р(К 1)орма и Яцетоца получают Хтелевой .-.г)од,х(тВьхд 18,"г) .пт. 2 5-237 С( ,; з,г 10"г,"ггтгг.1 ц) ЬХ(т)Е тт)дп ) КР т 1 г С ТВ Е ИС ХОЦНОГО ,г 11)т(1);)1) -МгПХЕН - ( ОКТЯЦЕ 11 ИЛМЕР" кятхоптоопацол: - ( 1 1 цпегтстявляет собой )свое се;ттт";цьхе и может быть получене д зощим о бр Яз ом,3 Бго)2"-;.е Окси-,)-етилцропахолВВО)15 Г ВО ВЗЯИМОДЕИСтВИЕ С Хатг)Х(Р В Сй Г О Гт ЬО ОК т ЯДР ЦИГТНОЛЯ 3 3 Г ИЛОзсм с г 11)те, П Резу."ьтте ОтщзцлетхиЯ-1,1 С, ) Риба.зляюгг пс каплям раствОР- 3" х г тряХтиХмгерк 1;1 го 11)01 янола3 1 гд МП тй ОЛ(таотС т:ХООИСТОГС МР ГПц, г 1 зря.,ьй р;.ствсо паР.еИхвяот ; г;. тг)хе 2 тг та б,це г,О Л .,;1 ОМ, ПОС)тР1 г- ; дтС тЫ(джП)ЯЮТ В ТРтЕХХИР НотИИ КСтт Ятггот;ЕчцЕрЯТХгРС 3 агЕМ ра" " гц "1 а тттдЯР ) К (Тгт(т П 111 ЯБ)151 ЮТт, 3, ;)т.т(дттХЬХ " ОРднтг 1 ИЕ )Х; "; т(гХРТСгГРЯММЕ т ПОтУЧЕННОдг 1 В ТОНКО С Г;0 Е ц" К" ддчЯ Г ИХ ИПЕттХтНОСГЬ (1 гСтк тРРЗОДЯТ ПО ЯНЯЛОГИИ С ОХ.И- г ; Ц;Ь,. 1 ).ЦХГХ ) Е ти . и;.; е и г 851.1 олучехие (+т- гн,ц; -,-МСОХЛИХОВОтО зфнра 2"Мвтнл"К Сяцп г 31.(Е)1(Ь Б ГсцроПИ)"( 1 )-ОС р . о:хс й кисх 1011 , Онянтяомерь А и В со-1241994 40 остаток сушат и растирают с ацетоном. Получают 0 54 г (выход 17%). Вещество содержит 3 моль кристаллизационнай воды т.пл. 243-245 С (разл.).5П р и м е р 87. (2-Октадецилтио-этил)-(2-триметиламмоний-этил)-ФосФат.К 55 мл безводного метиленхларида последовательно добавляют по каплям 10опри -10 С 9 мл триэтиламина, 3,7 г 2-хлор-оксо,3-2-диоксофосфалана и б г 2-октодецилтиоэтанола, получаемого из 1-бромоктадекана и мононатрийтиоэтилата (т.пл. 49 С).015Смесь перемешивают в течение 2 ч на ледяной бане, затем оставляют ста" ять до повышения ее температуры да комнатной и через 2 ч упаривают в вакууме. Остаток смывают 10 мл ацетонит". 20 рила с растворенным в нем 2 г триметиламина и встряхивают в течение 8 ч при б 0 С. После отгонки растворителяаостаток очищают с помощью колоночной хроматографии, как это описано в при мере 1. Выход 31%. Т.пл, 120 С, спекания 212 214 С (с разложением). Полученные кристаллы содержат 2,5 моль воды.Кроме соединений, указанных в при=.ЗО мерах, предпочтительными (Г) являю". - ся следующие соединения.1. Ионохолиновый эфир 2,3-бис-ок" тадецилмеркаптопрогганол-(1)-Фосфор ной кислоты,2, Гидроокись 2- 13-(гексадецил-. меркапто)-пропоксифасфорилоксигидрак" си-метилэтиламмония.3. Ионахолиновый эфир 3-тетрадецилмеркапто-этоксипропил-(1)".Фос 40 форной кислоты.4, Ионохолиновый эфир 3-гексаде " цилмеркапто-этоксипропил-(1)-Фосфорной кислоты, т.пл, 69 С (спекание) 238-243 С (разложение).5. Манохолиновый эфир 3-(14-метил". меркаптотетрадецилмеркапто)-прапил(1)-фосфорной кислоты.б. Ионоходиновый эфир 3-(17-метил. октадецилмеркапта)-пропил "(1)-.фосфор-,.5 г 1 най кислоты.7. Ионохолиновый эфир 3 (8-.фтарактадецилмеркапто)-пропил-(1)-Фосфорной кислоты. 8, Ионохолиновый эфир 2 окси- -гексадецилмеркаптопропил-(1)-Фосфорной кислоты, при 65 сС - спекание, при 250 255 С - разложение. 9. Монахолиновый эфир 2-акси-октадекансульфинилпропил-(1)-Фосфорнойкислоты.10. Монохолиновый эфир 2-акси"-октадекансульфонилпропил-(1)фосфорной кислоты,11. Ионохолинавый эфир 2-"метокси-18-(4-октилциклогексил)-гептилмеркапго -пропил-(1)-ФосФорной кислотыевоск разложение при 245 С.12 Монохолиновыгг эфир 3-гексадецилмеркапто-метилмеркаптопропил-(1)-Фосфорной кислоты.13, Ионохалиновый эфир 3-гексадецилмеркапто-метансульфинилпропил".(11-фосфорнсй кислоты.14. Ианохслиновый эфир 3"-гесаггецилмеркаптометансульфанилпрапил-(1) -Фосфарггой кислоты.15, Манохалиновый эфир 2-метокси-(2-метоксиоктадецилмеркапто) -прапггл-(1) -Фосфорной кислоты.1 б, Ианохалиновый эфир 2-метоксиР, 5544. Монохолиновый эфир 2-октадецилмеркаптоэтилолфосфорной кислоты,27. Монохолиновый эфир Ис -3-гексадецилмеркаптоциклогексил-( 1)-фосфорной кислоты, т.пл. 65 С (спеканий240-252 С (разложение).28. Монохолиновый эфир 2,3-бис-октилмеркаптопропил (1)-фосфорнойкислоты.29. Монохолиновый эфир 2-метокси 3 (8 (4 октилфеиил) октилмеркалто)ПОЙ кислоты тпл 240 С (разло)КО1 ,-;,Ол,новь", ЭЬит/)тил 3" 1" ексадедилмежяптопрот,"фосфорной кислоты11 оно олиновыи эфир 2-ае,ьозти.;,.), , )Е,ттпт-) ан овр ти (р ,- .т- т: дг1 т)"./" ЕТ ОХ СИ-З ГЗ К С О в ЦИ /ЕЕР и ОПТО) 0 ЭИ- :1 1, -т)О/ /1)Оройт КЕстд/т ты,1241994 46 98. Монохолиновый эфир 2-метил 3(11-валероиланиноундецилмеркапто)пропил (1)-фосфорной кислоты.99. Монохолиновый эфир 2-И-додецилкарбоксиамидометокси-гексадецилмеркаптопропил-(1)-фосфорной кислоты.100. Монохолиновый эфир 2-этилиден-гексадецилмеркаптопропил-(1)--фосфорной кислоты.101, Монохолиновый эфир циклопропан1 гексадецилмеркаптометил" 1-метилфосфорной кислоты.Ниже приведены физические данные, характеризующие предпочтительные соединения, полученные по предлагаемому способу. Соеди нение 203,23 50Определения проведены при соотнесении к ТК как внутреннему стандарту, растворитель Р 20, примененныйприбор ВгцКег НГ Х - 90/РТ.В табл. 3 представлены данныеэлементного анализа соединений, по 65 84 (спекание) 239 241 (вепени 1ванне) 4 69 (спекание), 238 243 (раз". ложение) 44 120 (спекание), 212 214 (разложение) 45 54 (спекание), 237"239 (разложение) 50 59 (спекание), 245-250 (разложение) 51 68 (спекание), 242 (разложение) 54 73 (спекание)245. 248 (разложение) 55 69 (спекание), 250 (разложе" ние) 67 80 (спекание) 264 (разложение)1 68 200 (спекание) 215-220 69 60 (спекание 205 208 (образование пузырей) 5 70 65 (спекание) 240 (разложение)(г) (в) (б) (а)сн, в - сн, - (сн ),- сн лученных по примерам, и предпочтительных соединений.Рщуъ р% 4 Я Я Ю Ю очф сЯ ч ЩВ Ф СР :4Ю Ф ЪЮ еЪ мФ ф 3 Р 1 0; И Р с с 1 й: 1"Ъ ь ф с ЮЬ 4 3 Р ао р аО КО ф У ЯО ; С 3,ф цр Д рр РЛ я г а а РфФ2 у Ц р Кс,З Ц . "ф р Д д р Р 73 р, д 3 Ц 0К Р 4 Оз е 4 Ръ Ю СЧ "Ф й сч Гщс. го сч щС 3 1М 4 С 3Ф о Рь ОЪ як сУ 3124994 54яМЪ . МЪ МЪ МЪ В В В ВФ чю ч В МЪСО СО МЪ ч ч с Щ Ч) В СО МЪл МЪ В СО МЪ мо ОСЬ МЪВО МЪ СО МЪ МЪВСО МЪ л ф МЪ ч В о 10 СО м В о ОфРч х МЪМЬ Р)Во О СО м СР 0О ЪР лВ МЪ МЪ О о В МЪ МЪ1241994 О где В 1Изобретение относится к области.химии фосфорорганических соединений,а именно к способу получения новыхаммонийалкиловых эфиров фосфорной,кислоты общей Формулы О В 1,11В,-Я(О)-В,Г-О-В, И - В-алкил, который можетбыть разорван атомамкислорода;В С -Сь -циклоалкиленили прямой или разветвленный, насыщенный или ненасьпценныйС-С 8-алкилен, который может быть однократно или двукратнозамещен С 1 -С 1, -алкоксикарбонилом, Фениломили С 1 -С 1 алкаксигруппой, в свою очередь замещеннай фениЗОлом или С,-С-алкоксигруппой;Вз прямой или разветвленный алкилен С-С 1В, В и Вь - одинаковые или раз- З 5личные и означают ва."дород или низший алкилу - кислород или сера;и - целое число 0 или 2, 1 Окоторые обладают цитотоксической активностью и могут найти применение вмедицине.Целью изобретения является повьппение цитотоксическай активности и сни 5жение агрегации трамбоцитов.П р и м е р 1. Получение монохолинового эфира 3-октадецилмеркаптопропил"(1)-фосфорной кислоты,6,7 г 3-октадецилмеркаптопропано 5 Ола (т.пл. 53-55 С) растворяют в 70 млабсолютного хлористого метилена, по 1лученный раствор прибавляют па каплям при -5 ОС к раствору 6,7 г дихлор.(2-бромэтил)фосфата и 9,7 мл три . 55этиламина в 70 мл абсолютного хлор 11 стого метилена. Через 1 ч смесьнагревают до комнатной температуры оставляют па пачь, затем к реакционной смеси прцбглляют 80 мл О,1 н. водного раствора хлар 11 стага калия ио перемешивают в течение 2 ч при 40 С. Затем смесь охлаждают, прибавляют к ней 130 мл метиловаго спирта и подкисляют концентрированной соляной кислотой да рН 3. Органическую фазу отделяют, промывают водой, сушат и упаривают. Полученный после упарива ния остаток (8,7 г), котсрьп 1 пред ставляет собой 2-бромэтиловый эфир 3-актадецилмеркаптопропил-(1)-Фосфорной кислоты, растворяют в смеси, со ,цержащей по 45 мл метилового спирта и хлороформа, после чего в раствор вводят триметиламин, Затем реакционную смесь перемешивают в течение 1 ч при температуре кипения и выдерживают в течение ночи при комнатной тем пературе, Непосредственно после этого смесь упаривают, остаток растворяют в хлороформе, проводят фильтрование, после чего прозрачный фильтрат смешивают с ацетоном, В результате получают 6,1 г однородного по данным хроматографии в тонком слое бромида.С целью удаления бромидных ионов остаток обрабатывают в метакольном растворе уксуснокисльп 1 серебром, после чего производят очистку на ко ланке, заполненной силикагелем, при элюправании смесью, состоящей из хлороФорма, метиловога спирта и воды (65:25:4). Ь резупьтате получают 23 г (267.) продукта с т,пл. 238- 240 С (разл.), По паиным элементного анализа продукт содержит 1,5 моль воды.Структура полученного соединения подтверждена данными ЯИР-спектра и элементного анализа, а также в этом и во всех других примерах масс-спектроскопическими исследованиями. Примененный в качестве исходного реагента 3-актадецилмеркантопропанол получают следующим способом (предварительная стадия),0,35 г натрия растворяют в 10 млметилсвога спирта, К приготовленномураствору прибавляют па каплям 1,8 гметиловога эфира 3-меркаптопрапиана-вой кислоты, после чего добавляютраствор 5,2 г актадецилбрамида в20 мл метилавсга спирта. После нагре"вания реакциапнай смеси в течение Зч8ф ю 1 цфФЪ с Эс фс ес Д Ю 4-.) р ) ,)сз Г 4 ОЭ О щч с ф Ю а СО ЮФ .а М 1 Р еа ф 1 Х Ю Ф 9 щъ Ю й Щ Щ Д 1 Г, Ю гч (Р М Щ 6 .) Ф 8 е М 4 4 б к 1ч ",Я Р. у,Ф Фе РР Ре И Р Ю Р О 3 4 ОС 3 Ю счЮ б еа ИЪ Р 3аМЗ РЪ Ю Я) гтФ МчОч Ч сч лм еО л сч1 О Ю ее е, ФЧ СЧ ФЧ л Г12 А 1994 61 цЪмСФЪ СЧ цЪС "3 СфЪ цЪ В Юф цЪ СЪСЧлцЪ ОЭ В цЪм .ФВ 0 М 4 а СЧ цЪ ОЪ В м СЧ СЧОял а СЧ СЧ лВ лВь а ьО ЮЬ СЧ цЪ ОЪ л СЧ цЪ СЧ МЪ ВФ СЧ В СЧм я а л ю ь ОР СЧ аОъ ОфЪ ОВсО ГЪ цЪ цЪО сО сР м 3 Г ц) СР Рищ Ои О 1 Рл сР 1 О СО О ссР и СР ЩсО РРСР РР С 1 РЙ СРсс1иРД 1, 1 Щ сР Р 11 С 1 в сР с в сРй РВ иЪ аа е Ю В О 3 ЮмВе О сч а Ю1241994 70 Испытания цитотоксической активности полученных соединений. 2,0 1,2 1,5 1,4 1,4 9 1,2 10 1,2 16 1,6 17 18 1,4 33 1,4 42 1,4 1;7 20 1,2 1,5 62 1,5 1,5 65 1,5 70 1,2 63 32 В 48 1 ь 4 Ниже приведены данные цитотоксической активности, (эффективность но-вых соединений выражается фактором, представляющим собой отношение действия контрольного соединения к действию испытуемого соединения)фСоединение Фактор55 49 1,3 2,0 1,0 Контрольное 1,6 По примеру 4 Цитоксическре действие новых э полученных соединений на опухолевые клетки мышей определяли скриннингом. В качестве пораженных клеток использовали клетки опухоли, индуцированной,метилхолантреном (Ме 1 Ьа), вводимым мьппам в качестве асцита, а также лимфатические клетки АЬе 1 зеп - 8,1 (АЬЙз); которые сохранили Ы ч 1 го в питательной среде, Для испытаний "5 х 10 /мл этих клеток культиЬировали в модифицированной по методу Рц 1- Ьессо среде Еад 1 е, содержащей, кроме того, 10% деактивированной при высокой температуре эмбриональной телячьей сыворотки, 5 х 10 моль меркаптоэтанола, 50 7 пенициллина и 50 мкг/мл стрептомицина, а также различные концентрации новых полученных соединений, в течение 24 ч в термостате при относительной влажности воздуха 95%, 37 С и содержании СО 10%. Действие соединений определяли путем сравнения роста опухолевых кле ток в среде, содержащей новые. соединения, и контрольной культуры без добавки испытуемых соединений. В качестве контрольного соединения использовали монохолиновый эфир 2-ме- токси-октадецилпропил-(1)-фосфорной кислоты (соединение 41,386),35 Рост Ме 1 Ьа-клеток оценивали по внедрению Н-тимидина в ДНК клеток, а АЬ 18-клеток - по результатам измере-. ний щелочной фосфатазной активности аликвотной части культуры. Для каж О дого испытуемого соединения определяли концентрацию, при которой внедрение тимидина и соответственно, щелочная фосфатазная активность, по сравнению с контрольными,необработанными, опухолевыми клетками снижается на 50%.71 1241994 Сравнительное вещество 0,05 1,2 Полученное по примеру 1 1,4 82 2 2 3 )0,1 6 )2 1,5 83 1,3 20 )3 Преимущественные ВЧ 45 25 )2 В 7 54 Как видно из приведенных данных, полученные, соединения обладают высокой цитотоксической активностью.Определение агрегации тромбоцитов полученными соединениями.Для определения необратимой агрегации тромбоцитов центрифугировали кровь здорового донора (100 г) и отделяли богатую тромбоцитами плазму. Агрегацию тромбоцитов определяли путем измерения мути в агрегометре.1 мл богатой тромбоцитами плазмы пе". ремешивали в течение нескольких минут при 37 сС. После этого добавляли по О,2 мл исследуемых соединений различной концентрации и производили замер образующейся мути (ввиду технических трудностей невозможно про" вести исследования новых соединений35 приконцентрации, превышающей 2 мг/мл).Ниже приведены концентрации предлагаемых соединений и сравнительного совдинения (монохолиновый эфир 2-ме 40 токси 2-октадецилпропил-(1)-фосфорной кислоты), вызывающие необратимую агрегацию тромбоцитов, мг/мл: 33 )2 34 )2 48 1 49 1 50 ) 51,2 55 2 62 2 66 2 78 )1 79 О,Преимущественное В 7 26)2 В 7 45 В 7 51 Составитель М, КрасновскаяРедактор Л, Веселовская Техред И.Попович Корректор Е Сирохман Заказ 3619/60 тираж 343 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Б, Раущская наб д. 4/5при температуре кипения с обратным холодильником проводят охлаждение и полученную суспензию фильтруют. С целью очистки продукт хроматографиру ют на колонке, заполненной силикагелем. Элюирующее средство; смесь хлороформа и лигроина в соотношении 1:1. В результате получают 4,1 г метилоного эфира 3-октадецилмеркаптопропионовой кислоты (т.пл, 39-41 С), Продукт растворяют в диэтилоном эфире и производят его восстановление литийалюминийгидридом до тех пор, пока на полученной н тонком слое хроматограмме более не обнаруживается сложный эфир. После обычной обработки реакционной смеси получают 2,8 г 3-октадецилмеркаптопропанола, т.пл. которого 53- 55 С.Вместо октадецилбромида также может быть использован октадецилмеркап тан, который вводят но взаимодействие с метиловым эфиром 3-бромпропиононой кислоты или присоединяют к метиловому эфиру акриловой кислоты при использовании метилата натрия в качестве катализатора. Б обоих случаях получают метиловый эфир 3-октадецилмеркаптопропионовой кислоты.3 Октадецилмеркаптопропанол может быть получен также в результате присоединения октадецилмеркаптана к агглилоному спирту.П р и м е р 2. Получение монохо" линового эфира 3-октадецилсульфглггилпропил-(1)-фосфорной кислоты,0,25 г 3-октадецилмеркаптопропанола в 5 мл ледяной уксусной кислоты смешивают с 0,07 мл перекиси водорода. После перемешивания смеси в течение 1. ч при комнатной температуре прибавляют разбавленный раствор гидроокиси натрия до слабой щелочной реакции и через 2 ч суспензию фильтру ют. Продукт промывают водой и сушат. Получают 0,34 г вещества с т.пл. 74- 78 С, которое подвергают очистке на заполненной силикагелем колонке при использовании в качестве элюирующего средства смеси хлороформа и метилоно го спирта в соотношении 99:1, что приводит к повышению т.пл. до 81-83 С С полученным 3-(октадецилсульфинил)- -пропанолом осуществляют синтез по аналогии с описанным в примере 1. В результате получают (выход 197) однородное по данным хроматографии в тонком слое кристаллическое вещество5 1 О 15 2 О с т.пл. 244 С (разл.), содержащее 1 моль воды,Идентичный продукт получают в результате селектинного окисления полученного н соответствии с примером 1 соединения перекисью водорода в ледяной уксусной кислоте.П р и м е р 3. Получение монохолинового эфира 3-октадецилсульфонилпропил-(1-фосфорной кислоты.0,25 г соединения, полученного н примере 1, перемешивают при комнатной температуре в 5 мл ледяной уксусной кислоты и 0,1 мл перекиси водорода н течение 8 ч. После добавления воды смесь упаривают и полученный остаток перемешивают с ацетоном. В результате получают 0,23 г (873) кристаллического вещества т.пл. 240- 242 С (разл.), содержащего 2 моль воды.Идентичный продукт получают следующим образом. 0,5 г З-октадецилтиопропанола,полученного по описанной в примере 1предварительной стадии, растворяютн 10 мл ледяной уксусной кислоты ираствор смешивают с 0,13 мл перекисиводорода. После перемешивания реакционной смеси н течение 1 ч при комнатной температуре еще раз прибавляют перекись водорода, после чего реакционную смесь выдерживают и тече35,ние 2 ч ч. Непосредственно после этогоо суспензию фильтруют и полученное(ОЗ г) кристаллическое вещество поднергагот очистке на колонке. Т.пл. 9294 С.С полученным соединением осущест 40вляют синтез по аналогии с предварительной стадией, описанной в примере 1. На полученной в тонком слоехроматограмме по значению Б сульфон4может быть отличен как от сульфоксида, так и от меркаптосоединения, Приосуществлении обоих способов в качестве промежуточного продукта образуется сульфоксид, описанный в примере 2.50П р и м е р 4. Получение монохо"линового эфира 3-(октадец-енилмеркапто)-пропил)-фосфорной кислоты.Аналогично примеру 1 из 3-(октадец-енилмеркапто)-пропанола полу чают целевогл продукт с выходом 97., Т.пл. 238-243 С. Продукт содержит 2 моль воды.П р и м е р 5. Получение монохолинового эфира 3-(октадец-енсульФонил)-пропил-(1)-фосфорной кислоты.1,4 г соединения, полученного всоответствии с примером 4, растворяют в 35 мл ледяной уксусной кислоты.В течение 2 ч к приготовленному раст" вору .прибавляют двумя порциями 0,5 мп перекиси водорода, после чего реакционную смесь, выдерживают в течение 24 ч при комнатной температуре, Затем смесь смешивают с водой, упаривают, остаток растворяют в хлороформе и проводят осаждение продукта ди этиловым эфиром. Продукт получают в виде аморфного гигроскопического вещества, у которого определить температуру плавления не удалось. По данным анализа продукт содержит 3 мольводы.П р и м е р 6, Получение монохолинового эфира 3-гексадецилмеркаптопропил (1)-Фосфорной кислоты.Аналогично примеру 1 из 3-гексадецилмеркаптопропанола получают целевой продукт (выход 11%), представляющее собой однородное но даннымхроматографии в тонком слое кристаллическое вещество, содержащее 302,5 моль воды. Т.пл, 240 С (разл.).оП р и м е р 7. Получение монохо"линового эфира 3-гексадецилсульфонилпронил (1)" Фосфорнои кислотыаВ результате окисления соединения,полученного в примере 6, в ледянойуксусной кислоте 307.-ной перекисьюводорода получают целевой продукт(выход 70%). Определение температурыплавления не проводят, посколькупродукт на воздухе представляет. собой клейкое вещество, содержит1,5 моль воды,П р и м е р 8. Получение монохолинового эфира 3-(З11,15-тетраметилгексадецилиеркапто-пропил-(1)-фосфорной кислоты,Аналогично примеру 1 из 3-(3,7,11,15 тетраметилгексадецилмеркапто)пропанола 1 получают целевой продукт свыходом 15% (продукт аморфный), содержащий 3 моль воды,П р и м е р 9. Получение монохолинового эфира 3-(3,7,11,15-тетраметилгексадецилсульфонил)-пропил-(1)- 5 -фосфорной кислоты.Окисление соединения, полученногов соответствии с примером 8, осущест вляют способом, Описанным в примере 3, в результате чего получают це"-.левой продукт (выход 86%), находящий"ся в аморфном состоянии, содержаший2 моль воды.П р и м е р 1 О, Получение монохолинового эфира 3-гептадецилиеркаптолропил-"Ъосфорпо 11 кислоты,Аналогично примеру 1 из 3-гептадецилмеркаптопропанолаполучаютцелевой продукт (выход 21%). Т.пл.246 С (разл.). Продукт содержит1 моль воды.П р и и е р 11. Получение монохолинового эфира 3-гептаденилсульфонилпропил-"(1)-Фосфорной кислоты,Полученный в соответствии с примером 10 прод кт Окисляют в уксуснойкислоте пеРекисью воДОРОДас ВыхоД Це"левого соединения 767 аа Определениетемпературы плавления оказалось невозиожньм; 1.оскольку продукт представляет собой клейкое вещество.Продукт содержит 2 моль воды,. П р и м е р 12. Получение монохолинового эфира 3-эйкозилмеркаптопронил-(1)-фосфорной кислоты.Аналогично примеру 1 из 3-эйкозилмеркаптопропанолаполучают целевойпродукт с выхоцом 167, Т.пл. 235238 С (разл.). Продукт содержит2 моль воды,П р и и е р 13, Получение монохолинового эфира 3-эйкозилсульфонилпропил-(1)-фосфорной кислоты.Полученный в соответствии с примером 12 продукт окисляют при ком"натной температуре перекисью водорода в ледяной уксусной кислоте. Выходпродукта 767, Т,пл. 210-229 С (разл,Продукт содержит 3 моль воды.П р и и е р 14. Получение монохолинового эфира 3-додецилмеркаптопропил-(1,-фосфорной кислоты,Аналогично примеру 1 из 3-додецилмеркаптонропачолаполучают целевой пРоДУкт С выходом 16% Тапл, 229 са 231 С (разл,). Продукт содержит 1 моль воды,П р и и е. р 15, Получение моно" холинового эфира 3-додецилсус 1 ьфонь 1 л- ПРОПИЛ ( 1 ) сфОСФОрнойс КИСЛО 1 Ы сПолученный в соответствии с примером 14 продукт окисляют Обычным способом перекисью водорода в ледяной уксусной кислоте, ВыхОд прод;кта74%. Т.пл. 95-99 Т (разл). Продуктсодержит 2 моль воды,П р и м е р 16. Получение монохолинового эфира 3"(2-пеитадецилок".сиэтилмеркапто)-пропил-(1)-Фосфорнойкислоты.2,8 г натрия растворяют ь 34 млэтиленгликоля. К приготовленному ра.створу прибавляют 53,5 мл 1-бромиентадекана, после чего реакционнуюсмесь перемешивают в течение 15 чпри 150 С, После охлаждения реакционную смесь экстрагируют смесью этилового эфира уксусной кислоты и лиг".роина (1.2). Затем смесь упариваюти остаток хроматографируют на колонке, заполненной силикагелем, приприменении в качестве элюирующегосредства лигроина, Выход продукта,представляющего собой маслообразноевещество, 29%. После выдержки в течение некоторого времени продуктзатвердевает,1 О г полученного продукта перемешивают в течение 5 ч при комнатнойтемпературе с 1,4 мл трехбромистогофосФора и 0,6 мл пиридина. Затемсмесь выливают на лед, проводятэкстрагирование диэтиловым эфиром.после чего продукт годвергают очистке на колонке, Выход 1 (2-броыэтокси-пентадекана, представляющего собоймаслообразное вещество, 60%, Последующие реакции осуществляют по аналогии с методиками описаннымипримере 1. В результате с вьгодом69% получают метиловый эфир бета-(2-пентадецилоксиэтилмеркапто)-про"пионовой кислоты и 3-(2-пентадецилоксиэтилмеркапто) пропанол, т,пл,которого 44-47"С, с вылодом 95%,После взаимодействия последнегос дихлорангидридом 2-бромэтилфосфорной кислоты и с триметиламином получают целевой продукт (выход 31%),т.пл, которого 231-233 С (разл.).Продукт содержит 1 моль воды.П р и м е р 17. Получение монокалинового эфира 3-(2-пентадецилокси-этилсульфонилпропил-(1)-фосфорнойкислоты.Полученное в примере 16 соединениеокисляют перекисью водорода в ледянойуксусной кислоте. После упариванияраствор, полученный в результате растворения остатка в воде, смешиваютс диэтиловым эфиром, в результатеВ. 1,74 г твердой гидроокиси калия растворяют в 60 мл абсолютногоэтилового спирта, К приготовленному 50раствору при комнатной температуреприбавляют при перемешивании раствор8,88 г октадецилмеркаптана в 60 млабсолютного этилового спирта. Через1 ч к смеси прибавляют по каплямраствор 693 г 2 0-метилглицеринмо 55нобензолсульфоната в 30 мл абсолютного этилового спирта, после чегопродолжают перемешивание при комнатной температуре в течение 1,5 ч. Не 15 20 30 15 40 45 чего гроисходит кристаллизация. Получают гигроскопическое кристалличес кое вещество (выход 75%) с т.разл.О95 С, Продукт содержит 2 моль воды.П р и м е р 18, Получение (3-октацецилсульфонилпропил)-(3 триметиламмонийпропил)фосфата.Аналогично примеру 1 из 3-(октадецилсульфонилпропанолаи дихлор(3- -бромпропил)фосфата получают целевой продукт с выходом 25%. Т.пл. 226- 229 С (с разложением).П р и м е р 19. Получение (3-ок тадецилсульфонилпропил)-(2".триметиламмоний-метилэтил)фосфата.Аналогично примеру 1 из 3-(октадецилсульфонил)пропанолаи дихпор (2-бромпропил)фосфата получают це левой продукт с выходом 3,1%. Т,пл, 203 оС (разл,). Продукт содержит 2 моль воды.П р и м е р 20 Получение монохолинового эфира 2-метокси".3-октаде цилмеркаптопропил-(1)-фосфорной кислоты.А, К 6 37 г 2-0-метилглицерина вФо 70 мл абсолютного пиридина при 0 С прибавляют по каплям при перемешива нии 77 мл бензолсульфонилхлорида. Реакционную смесь выдерживают в тече. ние ночи в холодильнике и затем выли" вают на 150 г льда, Водную фазу экстрагируют хлористым метиленом, органическук фазу встряхйвают с 2 н, раствором. соляной кислоты, с раствором кислого углекислого натрия и во дой, сушат и упаривают. Остаток после упаривания хроматографируют на заполненной силикагелем колонке (500 г; элюирующее средство - толуол, ацетон в объемном соотношении3:1). В результате получают 7,2 глить не представляется возможным. Вещество содержит 2 моль воды.П р и м е р 23,. Получение монохолинового эфира 3-.(2-пентадецилмеркаптоэтилмеркапто)-пропил-(1)-фосфорной кислоты,При использовании в качестве ис ходного вещества 3-(2-пентадецилмер 40 каптоэтилмеркаптопропанола с т.пл.53-55 С по методике, описанной в при" мере 1, получают целевой продукт в виде гигроскопического кристаллического вещества с т.разл. 237 С, которое содержит 2 моль воды.Исходное соединение получают следующим способом. 50 55 прибавляют 12 г метилового эфира посредственно после этого реакционную смесь выливают в 1 л воды, охлажденной льдом. Затем смесь подкисляют прибавлением 2 н,раствора соляной кислоты, проводят экстрагирование диэтиловым эфиром, органическую фазу сушат и упаривают. Полученный после упаривания остаток подвергают очистке на заполненной силикагелем колонке (500 г; элюирующее средстводиэтиловый эфир:лигроин в объемном соотношении 1:1). В результате получают 6,1 г (58%) 2-метокси-октадецилмеркаптопропанола (т.пл. 44-47 С).С. К 6,0 г 2-метокси-октадецилмеркаптопропанола в 70 мл абсолютно го толуола добавляют 5,67 г триэтиламина, при 0 С прибавляют по каплям при перемешивании раствор 4,91 г дихлор(2-бромэтил)фосфата в 50 мл абсолютного толуола. После выдержки реакционной смесив течение 4 ч при ОфС ее перемешивают в течение ночи при комнатной температуре, Затем реакционную смесь охлаждают до 0 С, прибавляют к ней 67 мл 0,1 н,водного раствора хлористого калия и смесь энергично перемешивают в течение 1 ч при 0 С и в течение 2 ч при комнатной температуре. После этого то луольную фазу отделяют, сушат и упаривают. Полученный после упаривания остаток растворяют в смеси 45 мл абсолютного метилового спирта и 30 мл абсолютного хлороформа, проводят фильтрование, после чего полученный раствор насыщают сухим триметиламином. Непосредственно после этого реакционную смесь нагревают в течение 16 ч при температуре ее кипения с обратным холодильником, после чего смесь упаривают. Остаток растворяют в 180 мл абсолютного метилового спир-. та, полученный раствор смешивают с 2,88 г уксуснокислого серебра, смесь перемешивают в течение 1,5 ч при комнатной температуре, проводят фильтрование, вещество на фильтре промывают абсолютным метиловым спиртом и фильтрат упаривают. Полученный остаток подвергают очистке на колонке, заполненной силикагелем (100 г; элюирующее средство - хлороформ:мети ловый спирт:вода в объемном соотношении 65:25:4). В результате получают 1,8 г (19,6%) целевого монохолинового эфира 2-метокси-октадецилмеркап 5 1 О 15 20 25 30 35 топропил-(1)-фосфорной кислоты. Образовавшийся аморфный продукт кристаллизуют путем растворения в абсолютном хлороформе и осаждения ацетоном (т.пл. 251-252 С). Вещество содержит 1 моль воды.П р и м е р 21, Получение монохолинового эфира 2-метокси-октадецилсульфинилпропил-(1)-фосфорной кислоты.По аналогии с описанным в примере2 монохолиновый эфир 2-метокси" ок.тадециямеркаптопропилфосфорнойкислоты обрабатывают 30%ной перекисью водорода в ледяной уксуснойкислоте. Неочищенный продукт несколько раз растирают с ацетоном, врезультате чего происходит кристаллизация, Т,пл. продукта 81 С (спекание)120-122 С (растекание), 270-272 С(разложение). Выход 75,7%. Веществосодержит 2 моль воды,П р и м е р 22. Получение монохолинового эфира 2-метокси-октадецилсульфонилпропил-(1)-фосфорной кис"лоты.По аналогии с описанным в примере 3 монохолиновый эфир 2-метокси-октадецилмеркаптопропил-(1)-фосфорной кислоты обрабатывают 30%-ной перекисью водорода в ледяной уксуснойкислоте, Неочищенный продукт несколь"ко раз растирают с ацетоном, в результате чего происходит кристаллизация,Выход продукта 73,5%. Т.пл. опредеК раствору, полученному из 2,3 гнатрия и 80 мл метилового спирта,3-меркаптопропионовой кислоты и12,5 г 2-бромметанола, после чего реакционную смесь нагревают в тече 241994ние 4 ч при температуре кипения собратным холодильником. Полученныйпосле упаривания остаток растворяютв хлороформе, раствор фильтруют иупариваю г. Б результате получают16 г метилового эфира 3-(2-оксиэтилмеркапто)-пропионовой кислоты в видемаслообразного вещества.8,2 г полученного вещества растворяют в 27 мл абсолютного диэтилового эфира, к раствору прибавляют0,8 мл пиридина и к приготовленнойсмеси при охлаждении льдом прибавляют по каплям 1,9 мл трехбромистогофосфора. Непосредственно после этого реакционную смесь перемешиваютпри комнатной температуре в течение5 ч. Затем к реакционной смеси прибавляют воду со льдом, проводят Оэкстрагирование эфиром, органическуюфазу промывают водой, сушат и упаривают, в результате чего получают10,1 г маслообразного вещества, которое хроматографируют на 480 г си- р,ликагеля. Элюирующее средство - лигроин:диэтиловый эфир (2:1). Получают7,1 г метилового эфира 3"(2-бромметилмеркапто)-пропионовой кислоты ввиде маслообразного вещества.ЗО5,9 г полученного соединения вводят во взаимодействие следующим способом,Раствор 0,6 г натрия в 30 мл метилового спирта, в которомсодержит 3ся 6,3 г 1-меркаптопентадекана и5,9 г сложного эфира, нагревают втечение 3 ч при температуре кипенияреакционной смеси с обратным холодильником. Затем реакционную смесьохлаждают и после растворения в ди"этиловом эфире, фильтрования и упаривания получают 9,4 г кристаллического метилового эфира 3-(2-пентадецилмеркаптоэтилмеркапто)-пропионовой45кислоты. Указанное количество полученного вещества растворяют в 80 млабсолютного диэтилового эфира и приготовленный раствор прибавляют покаплям к 0,66 г литийалюминийгидрида50в 50 мл абсолютного эфира, После нагревания в течение 30 мин при температуре кипения с обратным холодильни"ком реакционную смесь обрабатываютобычным способом, в результате чего55получают 7,7 г 3-(2-пентадецилмеркаптоэтилмеркапто)-пропанола в виде однородного по данным хроматографии втонком слое вещества с т.пл, 53-55 С,о П р и м е р 24. Получение (3-ок тадецилмеркаптопропил)-(3 триметиламмонийпропил)фосфата.Смесь, состоящую из 1 г дихлор- -(З-бромпропил)-фосфата, 1 г 3-октадецилмеркаптопропанола и 1,4 мл триэтипамина, в 20 мл абсолютного хлористого метилена перемешивают в течеоние 30 мин при -5 С и в течение 1 чна бане со льдом. Затем реакционную массу выдерживают в течение ночи при комнатной температуре, после прибавления 20 мл 0,1 н.раствора хлористого калия проводят гидролиз путем перемешивания в течение 4 ч при 40 С, прибавляют 40 мп метилового спирта, подкисляют концентрированной соляной кислотой, после чего отделяют орга ническую фазу. После упаривания органической фазы получают 1,5 г вещества, которое растворяют в 30 мл смеси, состоящей из хлороформа и метилового спирта (1:1), После пропускания в раствор триметиламина в течение 1 ч реакционную смесь перемешивают в теочение 3 ч при 40 С, Затем проводят упаривание реакционной смеси, после чего кристаллическое вещество переме" шивают с ацетоном. Продукт вновь растворяют в 55 мл метилового спирта и после прибавления 0,4 г уксусно- кислого серебра раствор перемешивают в течение 3 ч при комнатной температуре. После выдержки в течение ночи проводят фильтрование, раствор упа." ривают и полученный продукт подвергают очистке с помощью хроматографии на колонке по аналогии с описанным в примере 1, В результате получают 0,7 г (407) гигроскопичного кристаллического вещества, которое по данным элементного анализа содержит 4,5 моль воды. Т.пл. 228-230 фС(разл.).П. р и м е р 25. Получение моно холинового эфира 2-метил-октадецилмеркаптопропил (1)-фосфорной кислоты.К раствору 0,12 г натрия в 70 мл метилового спирта прибавляют 14,3 г октадецилмеркаптана, на бане со льдом прибавляют 5 г метилового эфи, ра метакриловой кислоты, реакционную смесь перемешивают в течение 1 ч при комнатной температуре, Образующуюся суспенэию фильтруют в холодном состоянии, продукт промывают холодным метилавым спиртом и сушат. В результате получают 16,3 г кристаллического вещества (887,), однородного поданным хроматографии в тонком слоеметилового эФира-метил- Р-октаде 5цилмеркаптопропионовай кислоты. Восстановление проводят с помощью1,14 г литийалюминийгидрида в 320 млбезводного диэтилового эфира. В результате получают 14,2 г (947.) 2-метил-З-октадецилмеркаптопропанола,т.пл. 37-39 ОС.фосфорилирование, гидролиз и взаимодействие с амином проводят по методикам, описанным в примере 1. Получают целевой продукт (выход 27 Е)однородный по данным хроматографии втонком слое, т.пл. 234-238 С, содержит 1,5 моль воды.П р и м е р 26, Получение монохолинового эфира 3-(2-пентадецилсульфонилэтилмеркапто)-пропил-(1)-Фосфорной кислоты,0,7 г натрия растворяют в 80 млметилового спирта. К приготовленному 25раствору последовательно прибавляют2,4 г меркаптоэтанола и 9 г пентадецилбромида, после чего смесь перемешивают в течение 3 ч при 60 С, Затемее растворяют в эфире, бромистый нат Орий отделяют и раствор упаривают. Остаток подвергают очистке с помощьюхроматографии на колонке. Элюирование проводят смесью, состоящей излигроина и диэтилового эФира (1:1),Выход 2-пентадецилмеркаптоэтанола8,9 г (977.), т.пл. 44-46 С. 13 г полученного соединения. окисляют перекисью водорода в 310 мл ледяной уксусной кислоты до тех пор, пока наполученной в тонком слое хроматограмме не обнаруживается только одно пятно. В результате получают 11,1 г(777.) 2-пентадекансульфонилэтанолас т.пл 64-66 С. Из этого соединенияпод действием трехбромистого Фосфорав диэтиловом эфире в присутствии пиридина с выходом 497 получают 2-пентадекансульфонилэтилбромид с т.пл.68 С (вспенивание), причем при 85 "С50получается прозрачный расплав.Последующие операции проводятЬаналогично примеру 1, в результатеполучают следующие промежуточные соединения: метиловый эфир-(2-пентадецилсульфонилэтилмеркапто)пропио-,55новой кислоты, который используют ввиде неочищенного продукта для восстановления; 3-(2 пентадецилсульфонилэтилмеркапто)пропанол, т.пл, 7375 С, иэ которого получают с выходом2 Е целевой продукт ( т.пл. 54 С(спекание), при 229-232 С происходитмедленное разложение, сопровождающееся окрашиванием в коричневый цвет).Продукт содержит 2,5 моль воды.П р и м е р 27. Получение монохолинового эфира 3-(2-метоксиоктадецилмеркапто)-пропил-(1)-фосфорнойкислотыАналогично примеру 1, из 3-(2-метоксиоктадецилмеркапто) -пропанола получают целевой продукт (выход ЗОБ).Он содержит 2,5 моль воды. Т.пл. полученного вещества определить непредставляется возможным вследствиеего сильной гигроскопичности.Исходный продукт - 3-(2-метоксиоктадецилмеркапто)-пропанол, представляющий собой бесцветное маслообразное вещество, которое при хранении постепенно затвердевает, получают следующим образом,.Х -Бромстеариновую кислоту с т.пп.47-51 С, полученную путем бромирования стеариновой кислоты, этерифицируют метиловым спиртом с применениемкаталитического количества паратолуол"сульфокислоты, Маслообразный сложныйэфир вводят во взаимодействие с метилатом натрия, в результате чегополучают метиловый эфир оС -метоксистеариновой кислоты (т.пл. 33-36 ОС),который восстанавливают литийалюминийгидридом до 2-метоксистеариловогоспирта с т.пл. 36-38 С (выход 977).После обработки трехбромистым фосфором получают 2-метоксистеарилбромид(выход 202) в виде маслообразноговещества, который вводят во взаимодействие с метиловым эфиром /3 -меркаптоцропионовой кислоты, в результаге чего получают маслообразный метиловый эфир-(метоксиоктадецилмеркапто)-пропионовой кислоты (выход337). После восстановления литийалюминийгидридом с выхоцом 943 получают3-(2-метоксиоктадецилмеркапто)пропанол,П р и м е р 28, Получение (3-октадецилмеркаптопропил)-(2-триметиламмоний-метилэтил)фосфата.Аналогично примеру 1 из 3-октадецилмеркаптопропанолаи дихлор(2-бромпропил)фосфата получают целевойпродукт, т,пл. 61 С (спекание), 139 С
СмотретьЗаявка
3347450, 20.10.1981
Вёрингер Маннхайм ГмбХ
ЭЛЬМАР БОЗИЕС, РУДИ ГАЛЛ, ГЮНТЕР ВАЙМАНН, УВЕ БИКЕР, ВУЛЬФ ПАЛЬКЕ
МПК / Метки
МПК: A61K 31/661, C07F 9/09, C07F 9/165
Метки: аммонийалкиловых, варианты, его, кислоты, фосфорной, эфиров
Опубликовано: 30.06.1986
Код ссылки
<a href="https://patents.su/38-1241994-sposob-polucheniya-ammonijjalkilovykh-ehfirov-fosfornojj-kisloty-ego-varianty.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения аммонийалкиловых эфиров фосфорной кислоты (его варианты)</a>
Предыдущий патент: Способ получения бициклических соединений или их гидрохлоридов
Следующий патент: Способ получения фосфолов
Случайный патент: Временной селектор