Способ получения триазолсодержа-щих эфиров тиофосфорных кислот
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
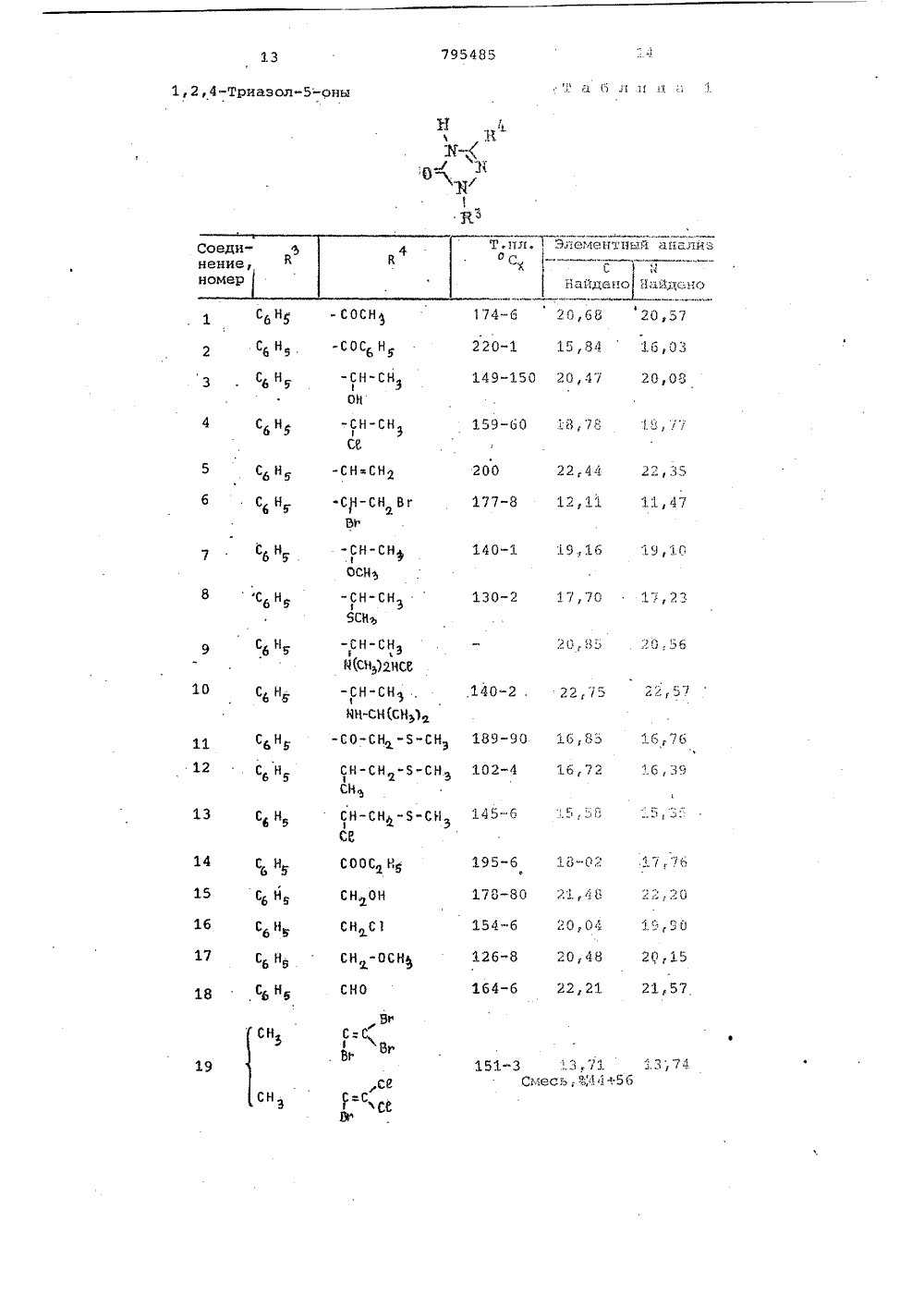
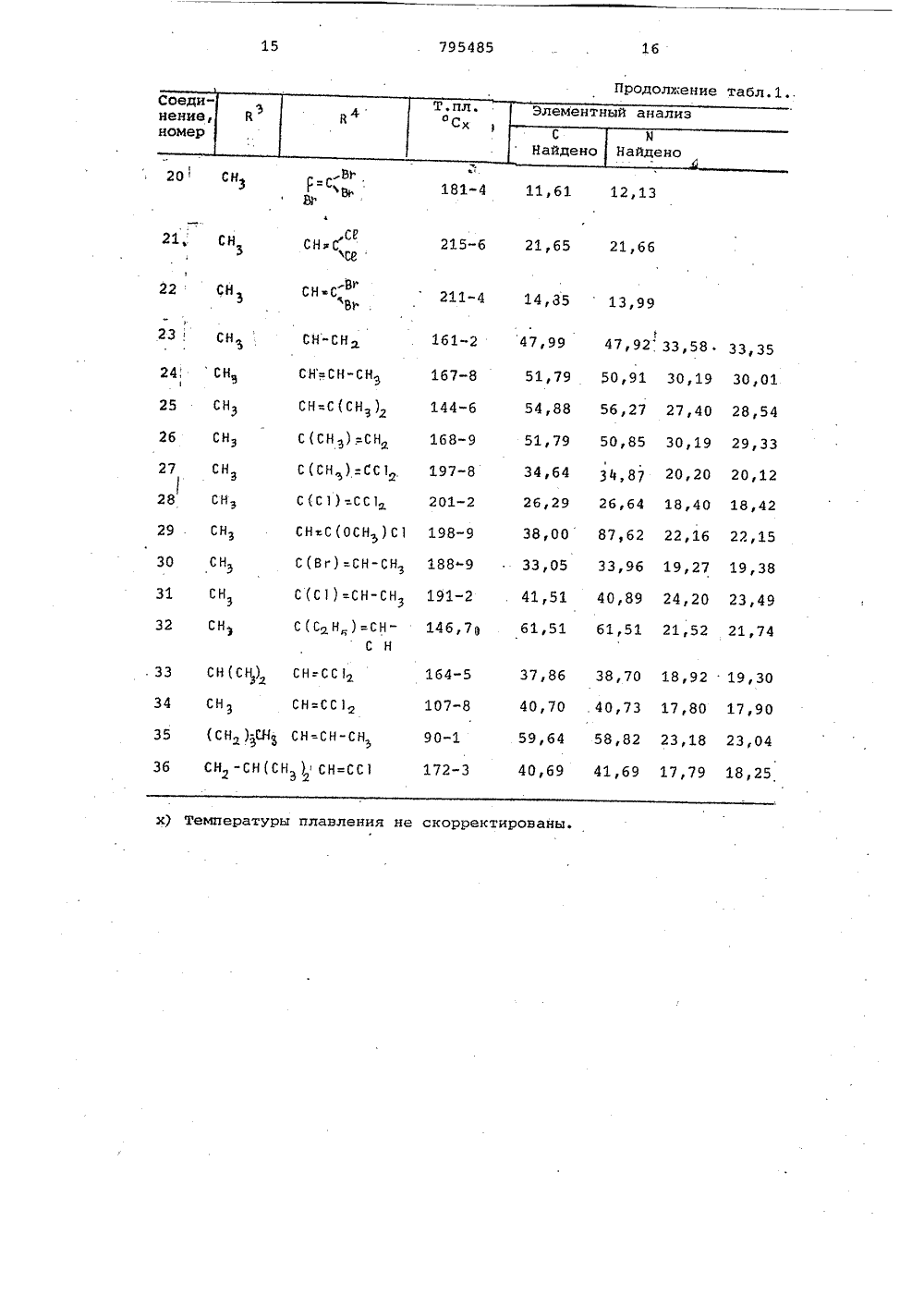
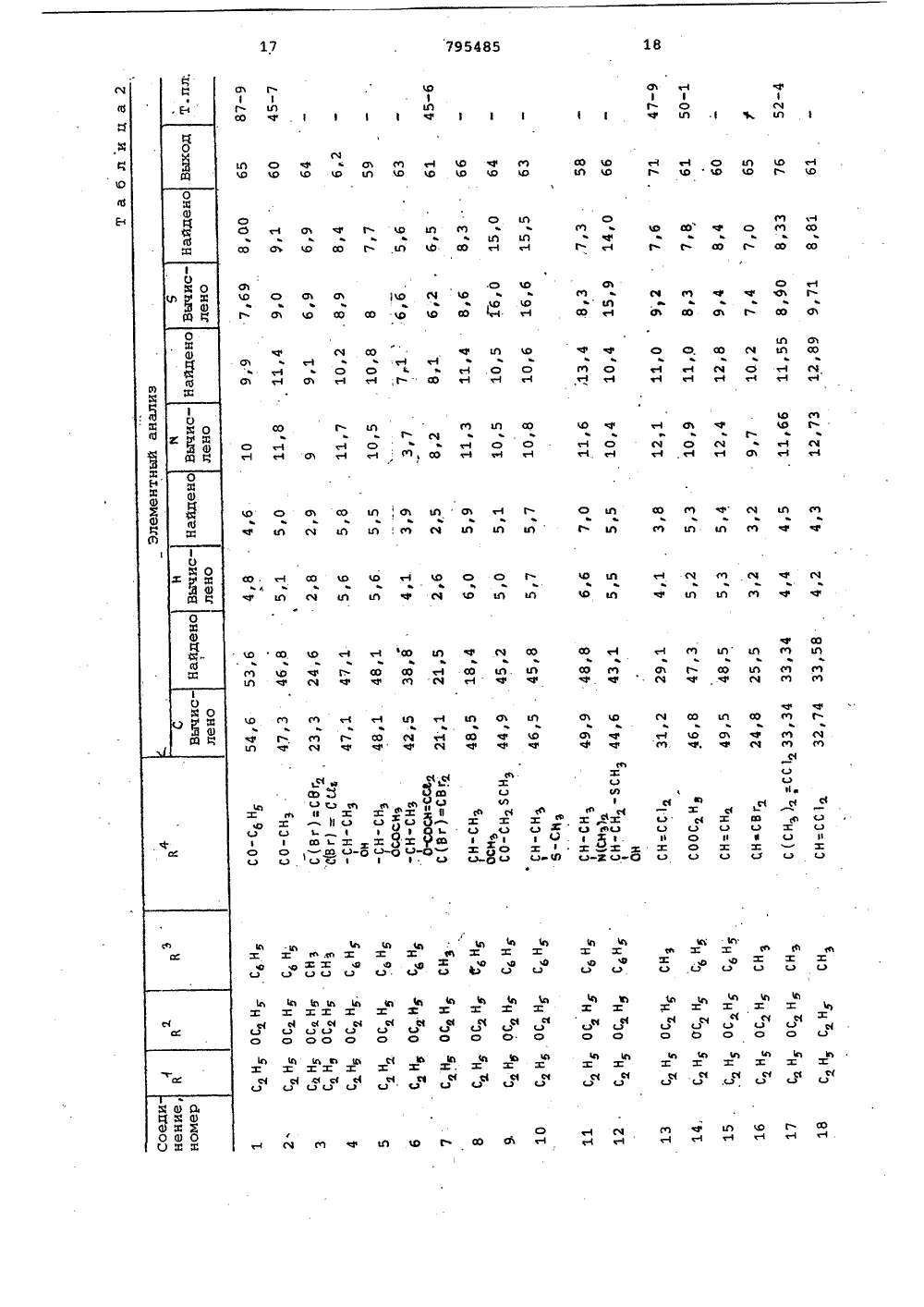
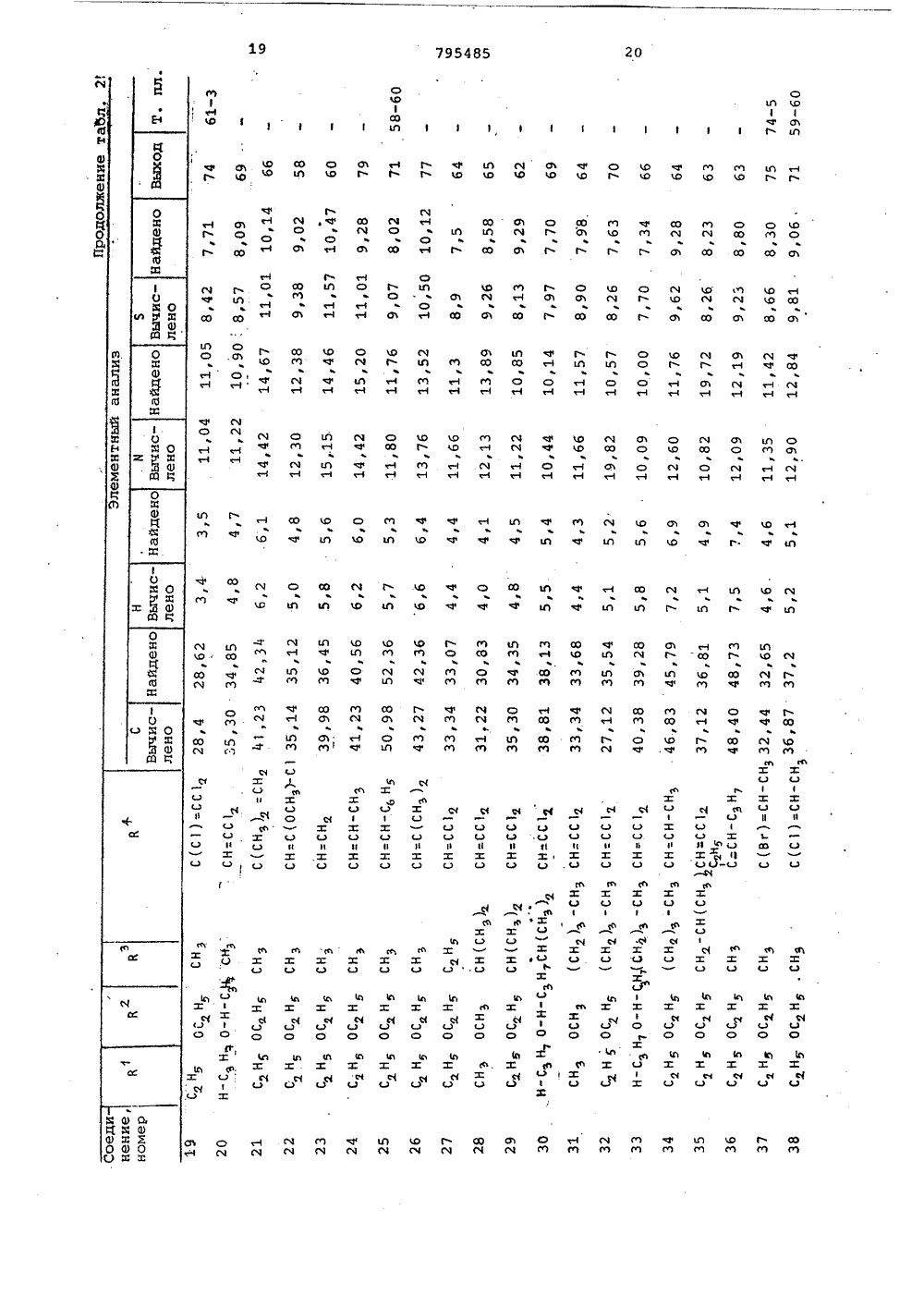
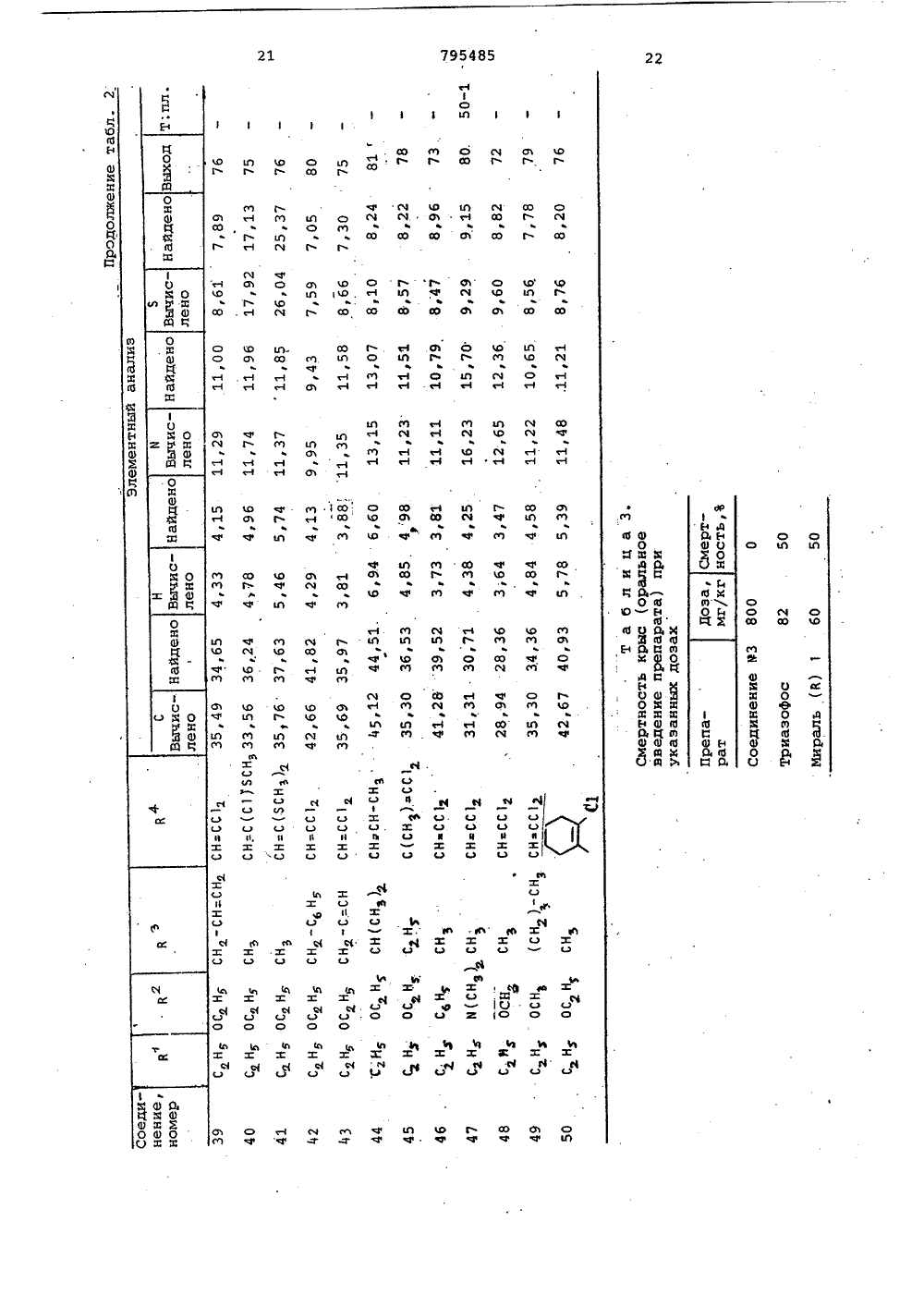
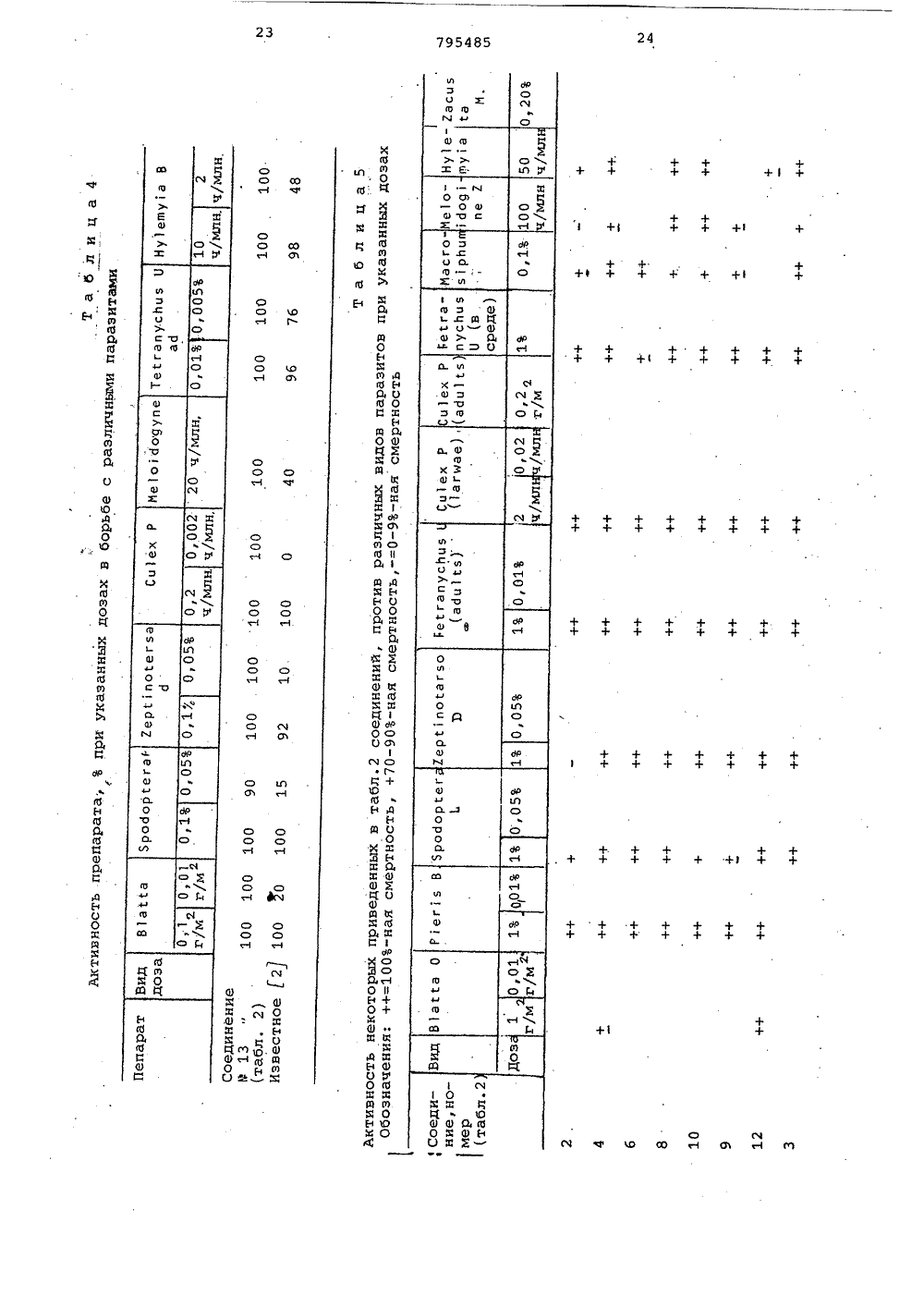
о х Ио хо фЮсл сО а а с с СОсО сЧ с с а соФ ОсФ сР Н 00 с с 3 Л Л СЧ Ю с 0 а сч с л04 Кц ио иИх хо о к .Э 1 х с.э сО1 ссс х ОсЧ Х о к 04х х О Хи о сс.Эх СЬ Ссхо осйк Фх хи ОГсЗ"44х х1ос ОЮхСсх оС 3" л ссс о О 1 о х 11 МЭ 1 од-о с о хсР лФ СО с с СЧ СО м м ст с х о иХ Х о о 1 Со О о о.Способ получения триазолсодержащих эфиров тиофосфорных кислот общей формулы где Р 4 1-окси этил, -Сбензоил,группа 0И)рформула изобретениязаключающийся в том, что соль щелочного металла 1-Р-Р 4 -1,2,4-триазол 5-она подвергают взаимодействию схлорангидридом тиофосфорной кислотыв среде инертного растворителя притемпературе 55-60 С,Приоритет по признакам; -14.07.1976 прий - РР-О-Р - алкил С, - С22И - Н Р - этил, фенил, алкоксигруппаР С 4 -Сз или диметиламиногруппа,10 Р - алкил С -С 4 или фенил,Р - винил, галоидвинил, полигалоидвинил, ацетил, карбалкоксиэтил, фенил, алкоксигруппа этил,СО-СН 2-5 Р -группа,С - С или диметиламино- или группа -СН-Р3группа;1 Ьалкил С 4 -С 4. или фенил, гвинил, галоидвинил, поли-где К -ОН,ОР,ЯР" Й 1 Р)я, О-С-Р, О-Сгалоидвинил, винил, заме 0щенный алкилом С 4 -С, , фе- -полигазоидвинил или -0-С-галоидалкинилом щ 3,03.1977 приалкильной группой С С 4 И - винил, замещенный алкилом С41или алкоксигруппой С -С 4, фенилом, 5 - алкильной группой С 4 -С-тиометилэтил, карбалкоксй- илп алкоксигруппой С 4 -С 4О-СН -5 Р -группа, ацетил, По признакам:1-.хлорциклогексенил или 5 Р - бензоил, хлорциклогексенил4или 1-окси-тиометилэтил устанав-СН- ливается приоритет по дате поступлед . й-ОН,ОР,6 й,ния заявки.Сн, "Источники информации,принятые во анимание при экспертизе1.Патент ФРГ 9 2260015,кл. С 07 Г 9/65, опублик. 1973.Составитель М.КрасновскаяРедактор Е.Емельянова Техред Н,граб Корректор Л.ИванЗаказ 9491/7 Тираж 406 ПодписноеВНИИПИ ГосударственноГо комитета СССРпо делам изобретений и открытий113035, Москва, Ж, Раушская наб д.4/5Филиал ППП"Патент", г.ужгород,ул.Проектная,46,0-диэтилтиофосфорной кислоты притемпературе 60 С (2),Однако триазолсодержащие эфирытиофосфорных кислот Формулы 1 этимспособом получены не были.Целью изобретения является разработка способа получения тиазолсо 5держащих эфиров тиофосфорных кислотФормулы 1.Поставленная цель достигаетсяописываемым способом получения триазолсодержащих эфиров тиофосфорныхкислот формулы 1, заключающимся втом что соль щелочного металла1-В 3-Р 4 -1,2,4-триазол-она подвергают взаимодействию с хлорангидридом тиофосфорной кислоты в среде 33инертного растворителя при темпера туре 55-60 С.Соединения формулы 1 обладают инсектицидным действием широкого диапазона, поскольку они эффективны для Щборьбы с ортоптерой, тлей, двукрылыми, колеоптерой,чешуекрылыми, атакже обладают акарицидным и нематоцидным действием, являясь в то жевремя мало токсичными по отношениюк теплокровным животным.Исходным соединением для получения производных 5 гидрокси,2,4 триаэола, в котором В -Фенильнаягруппа, является Ы. -хлор-.-замешенные Формилиденфенилгидразины,которые обрабатывают аммиаком споследующей конденсацией аминопроизводного фосгеном или тиофосгеном.В результате образуются тиазолы,которые в щелочной среде дают соли.В тех случаях, когда В" содержитФункциональные группы, для введениядругих групп в боковую цепь триазолона можно использовать различныереакции. Таким образом, из 1-фенилЗ-ацетил,2,4-триазол-она за счетспецифических свойств ацетильныхгрупп путем восстановления СО-группполучены соответствующие спирты,которые после обработки хлористымтионилом используют для получениясоединений Формулы 1.Триазолы, в которых В -алкил,получают реакцией конденсации альдегида Р 4-СНО с 2-алкилсемикарбаэидом, а затем обрабатывают получен 50ный таким образом семикарбазон бромом в ледяной уксусной кислоте, врезультате чего получают триазол,который в свою очередь обрабатываютв щелочной среде, 55установлено, что если Й представляет собой винильную группу, то после обработки бромом появляется возможность осуществления последовательности реакций присоединения и Яотщеплени, В частности, когда висходном альдегиде в ) -положениисодержатся атомы галогена, но неброма, то их можно заместить атомами брома в процессе циклизации. В зависимости от температурныхусловий превалирующим направлениемреакции может быть образование одного продукта циклизации, содержащего те же галоидвинильные группы,что и исходный альдегид или смесипродуктов, содержащих атомы брома ввинильных группах производных.тиазола.Винильные группы в положение3,1-фенил,2,4-триазол-она могутбыть введены с помощью реакции, исходным соединением для которой является 1-фенил-З-ацетил,2,4-триазол 5-он, протекающей по ацетильнымгруппам.Кроме того, установлено также,что циклизацию семикарбазонов общей.формулык-и=я-ъ - с -ън,ПЕЗзгде В и В имеют указанные значения, можно осуществить в присутствии хлорного железа.Описанная реакция циклизации позволяет осуществить прямое получение триазола высокой степени чистоты даже в тех случаях, когда группа Р4 содержит двойные олефиновые связи, по которым происходит присоединение брома, и таким образом, обладает преимуществами перед другими описанными выше методами.Реакцию проводят в среде полярного растворителя, предпочтительно в уксусной кислоте, при температуре кипения,Основные характеристики 1,2,4- триазол-онов, полученным одним из описанных методов, представлены в табл.1.В присутствии. основания 1,2,4- триазол -оны превращаются в соли щелочных металлов, которые, взаимодействуя с соответствующим хлорангидридом тиофосфорной кислоты, образуют триазолсодержащие эфиры тиофосфорных, кислот формулы 1.Полученные соединения Формулы 1 представлены в табл.2. 1П р и м е р 1. Получение 1-фенил- З-ацетил-2-4-триазол-она.80 Ьщ водного 32 Ъ-ного раствора аммиака (1,32 моля) приливают 500 мл этанола, к этому раствору небольшими порциями добавляют раствор бО г (0.,305 моля) с -хлор- с -ацетилФормилиденфенилгидразина. По окончании введения реагентов смесь перемешивают в течение 2 ч при комнатной температуре. Нерастворенный (,-амино-с;ацетилформилиденфенилгидразин (2) (48 г) отфильтровывают и прэмывают 200 мл воды (желтый осадок, т.пл. 182-184 С)42,5 г (0,24 моля) с -амино- с- ацетилформилиденфенилгидразина суспендируют в 300 мл бензола, к суспензии добавляют 57 мл (О, 72 моля) пиридина, а затем по каплям в , 40 мл бензольного. раствора Фосгена концентрации 10 (вес/объем, 0,36 моля), поддерживая температуру 15-20 С.По окончании введения реагента смесь перемешивают в течение 30 мин при комнатной температуре, а затем приливают к ней 100 мл воды и 10 мл концентрированной соляной кислоты. Смесь перемешивают при комнатной температуре еще в течение 2 ч, Нераство,римый осадок отфильтровывают через пористую диаФрагму и промывают водой. 15 Выход 1-фенил-З-ацетил,2,4-триазол-, 5-она 25 г,(т.пл. 174-176 С,)П р и м е р ы 2-4. Описанным в примере 1 методом,исходяиз с -хлора(;бензоилформилиденфенилгидразина, 20 получают 1-фенил-З-бензоил,2,4- триазол-он.Исходя из -хлор- с -метилтио-ацетилформилиденфенилгидразина получают 1-фенил-.З-(метилтиоацетил- р 1,2,4-триазол-он.Исходя из-хлор-с.-карбоэтоксиФормилиденфенилгидразина получают 1-фенил-(карбоксиэтил)-1,2,4,- триазол5-он.П р и м е р 5. Получение 1-фенил-(1-окси-метилмеркапто)этил"1,2,4- триазол-она.К 2,3 г 1"фенил-метилтиоацетил,2,4-триазол-сну, суспендирован" ному в 40 мл .метанола, по каплям35 добавляют раствор 0,3 боргидрида натрия в 5 мп воды. Реакционную смесь перемешивают в течение 1 ч, а затем добавляют 0,5 мл концентрированной соляной кислоты и раство ритель удаляют.Остаток смешивают с 20 мл воды и 0,5 мл концентрированной соляной кислоты, водный слой экстрагируют этилацетатом (Зх 30 мл ), а органический слой сушат над безводным сульфатом натрия.Растворитель отгоняют под вакуумом, а твердый остаток перекристаллизовывают из бензола (10 мл), в результате чего получают 1 г 1-фенил-(1-окси-метилмеркапто)этил 1,2,4-триазол-она(остаток цвета слоновой кости, т.пл, 102-104 С).П р и м е р 6. Получение 1-Фенил-(1-оксиэтил,2,4-триазол-она. " 55Следуя методике, изложенной в примере 5, и используя в качестве исходного соединения 70 г 1-фенил- ацетил,2,4-триазол-он, получают .56 г 1-фенил(1-оксиэтил) 1,2,4- 60 триазол-он (т.пл, 149-150 С).П р и м е р 7. Получение 1-фенил- винил -1,2,4-триазол-она.К 16 г продукта, полученноготак, как описано в примере 6, раст- Я воренном в 350 мл хлороформа, по каплям добавляют 7,6 мл хлористого тионила при перемешивании.Раствор перемешивают при комнатной температуре в течение 2 ч, а затем смешивают его с 150 мл воды. Хлороформный слой отделяют и сушат. После удаления растворителя получают 17 г 1-фенил-З-(1-хлорэтил)-1,2,4- триазол-она (т.пл, 159-160 С).5,5 г полученного таким образом продукта растворяют в 150 мл бензола и подвергают дегидрохлорированию в условиях слабого кипения в присутствии 7,5 г триэтиламина. Сразу же по окончании реакции в реакционную смесь вводят 10 мл воды и 10 мл концентрированной соляной кислоты. Бензольный слой отделяют, промывают водой и сушат над безводным сульфатом натрия. Часть растворителя отгоняют под вакуумом до тех пор, пока объем раствора не составит. 50 мл. По охлаждении из раствора выделяют 2 г 1-фенил-З-винил,2,4-триазол-она (т.пл.200 С),П р и м е р 8. Получение 1-метил- З-трибромвинил,3,4-триазол-она и 1-метил-(3)-с-бром-,-дихлорвинил) 1,2,4-триазол-она.3 г(0,0153 моля) 1-(,р-.дихлоракрилиден)-2-метилсемикарбазида растворяют в 15 мл ледяной уксусной кислоты, затем к этому раствору медленно добавляют 1,6 мл брома (0,031 моля), Затем смесь нагревают (при небольшом кипении в течение 30 минут, охлаждают и добавляют 150 мл воды. Реакционную смесь экстрагируют этилацетатом (50 мл х 2). Этилацетатные экстракты промывают 50 мл воды и насыщенным раствором бикарбоната натрия (40 мл х 3). Затем его сушат над безводным сульфатом натрия, отфильтровывают и упаривают.юПолученный остаток смешивают с 50 мл 10-ного водного раствора гидроокиси натрия и всю смесь нагревают до кипения. После этого смесь охлаждают иотфильтровывают. Фильтрат подкисляют концентрированной соляной кислотой. При этом образует" ся желтоватый осадок, который экстрагируют этилацетатом (2 х 50 мл). Затем органический раствор промывают водой (50 мл ) сушат над безводным сульфатом натрия и растворитель отгоняют. В результате получают 1,9 г желтоватого осадка, который перекристаллизовывают из бензола (т.пл 161- 163 С). Этот продукт представляет собой смесь соединений, о чем свидетельствуют результаты масс-спектрометрии, согласно которым обнаружены два молекулярных пика почти равной интенсивности (М=361,7 и М =273).П р и м е р 9. Получение 1-метил 3- ф,-дихлорвинил)-1,2,4-триазолона.9,7 г (0,0494 моля) 1-(,3-дихлоракрилиден)-2-метилсемикарбаэида растворяют в 50 мл ледяной уксусной кислоты. Раствор кипятят, добавляют покаплям 2,8 мл (0,054 моля) брома.По окончании введения брома раствор охлаждают.ФУксусно-кислый раствор медленно,по каплям добавляют к суспензии 120 гбикарбоната натрия в 300 мл воды.По окончании бурного выделения газовк смеси добавляют 250 мп этилацетатаи тщательно ее перемешивают.Органический слой отделяют, сушат 15над безводным сульфатом натрия ирастворитель частично выпаривают, как только объем смеси достигает40 мл, выпаривание прекращают и раствор охлаждают примерно до 0 С. Выпав ший желтоватый осадок отфильтровывают через стеклянный фильтр. В результате этого получают 2 г 1-метил"3- ф,Я(т.пл .215-216 С после нерекристаллиэации из этилацетата).П р и м е р ы 10-11, Используя в качестве исходного соединения соответствующий 1-(полигалоидакрилиден)- 2-метилсемикарбазиу, по методике примера 9, получают следующие 1,2,4- триазол-сны:1-метил-Я-дибромвинил)-1,2,4-триазол-он и 1-метил-(трибром" винил)-1,2,4-триазол-он.Л р и м е р 12. Получение 1-метил 3-(,дихлорвинил)-1,2,4-триазол- она в присутствии хлорного железа,Раствор 49 г (0,18 моля) гексагидрата хлорного железа в 100 мл воды добавляют к раствору 17,5 г 40 (0,089 моля) 1-(,-дихлоракрилиден) - 2-метилсемикарбазида в уксусной кислоте (50 мл). Полученный раствор нагревают в 4условиях охлаждения в течение 3,5 ч.,,затем дают воэможность самопроизвольно охлаждаться, после чего смешиваютего с 150 мл воды. Затем растворохлаждают примерно до 0 С (водно-ледяная баня), в результате чегополучают 12 г 1-метил-З-ф,-дихлорвинил)-1,2,4-триазол-она (т.пл.215-216 С после перекристаллизациииэ этилацетата).П р и м е р 13. Получение 1-метил 3-(,-диметилвинил)-1,2,4-триазол 5-она.К раствору 10,6 г (0,119 моля)2-метилсемикарбазида в уксусной кислоте (100 мл), по каплям добавляют Я10 г (0,119 моля) ),Д-диметилакролеина,Реакционную смесь перемешиваютпри тем 1.ературе 50 С в течение 15 мин,а затем добавляют к нему раствор д б 4, 2 г (О, 2 3 7) моля гексагидратахлорного железа в 60 мп воды.Всю смесь перемешивают при 75 Св течение 3 ч, а затем выливают егов воду (400 мл) и экстрагируют этилацетатом (2 х 150 мл), органический,слой отделяют, промывают водой и насыщенным раствором бикарбоната натрия и сушат над безводным сульфатомнатрия,После удаления растворителя получают 4 г 1-метил-З-(,-диметилвинил)1,2,4-триазол-она (т,пл. 144146 С)П р и м е р 14. Получение 1-метил-З-(-хлор-Р-метоксивинил)-1,2,4 триазол-она.В круглодонную колбу, снабженнуюобратным холодильником помещают. 6,8 г(0,035 моля) 1-метил-З-(,Я-дихлорвинил)-1,2,4-триазол-она, 50 мл метанола и 8 г КОН, Реакционную смесьперемешивают при температуре кипенияв течение 5 ч, затем выливают ее вводу (150 мл), подкисленную концентрированной соляной кислотой (20 мл)и экстрагируют этилацетатом (Зх 100 мл)Органический слой сушат над безводным сульфатом натрия, растворительудаляют и получают 3 г (1-метил(-хлорметоксивинил)-1,2,4-триазол-она (т,пл. 198-199 С).П р и м е р 15. Получение 1-метил"3-(2-хлор-циклогексенил)-1,2,4 триаэол-она.6 К раствору 27 г (0,1 моля) гексагидрата хлорного железа в 30 мл водыдобавляют 50 мл уксусной кислоты.Полученный раствор перемешивают притемпературе 100 С в течение 2 ч, добавляя по каплям раствор 10,8 г(0,05 моля) семикарбазона в 50 млуксусной кислоты. Нагревание смесипродолжают еще в течение 1 ч, а за"тем раствор охлаждают и вводят 300 млводы, после чего экстрагируют хлороформом (2 х 200 мл).Хлороформный экстракт отделяют,промывают насыщенным раствором. бикарбоната натрия и сушат над безводнымсульфатом натрия. После удалениярастворителя получают 4,5 г маслянистого продукта. При стоянии маслянистый.продукт затвердевает и этотвердое вещество промывают диэтило"вым эфиром, в результате чего получают 4 г 1-метил-(2-хлор-циклогексенил)-1,2,4-триазол-она(т.пл. 183-1850 С).По данным элементного анализа содержание С 1 в нем 16,76 против расчетных 16,60.П р и м е р 16. Получение 0,0-диэтил-(1-метил-трибромвинилтриазолил) тиофосфата.3,82 г (0,01 моля) натриевой соли1-метил".З-трибромвинил-окси,2,4,триазола растворяют в 100 мл ацетона.К этому раствору добавляют 1,6 мл(0,01 моля) хлорангидрида диэтил" тиофосфорной кислоты, Затем раствор нагревают при температуре 55-60 С в течение 2 ч. После этого ацетон выпаривают, а остаток растворяют в 100 мл диэтилового эфира и 50 мл воды, Смесь перемешивают. Органический слой отделяют, сушат над безводным сульфатом натрия и раст-. воритель выпариваютПолучают 4,7 г желтого масла, которое очищают хроматографически на силикагеле,используя в качестве элюента бензол: выход 0,0-диэтил-О-(1-этил-З-трибромвинил-триазолил)-тиофосфата 3,5 г (белое кристаллическое вещество,(т.пл.45-50 о С)Аналогичным способом были полу" чены и другие 0,0-диэтил-О-триазолилтиофосфаты, приведенные в табл.2. П р и м е р 17. Следуя методике, 20 описанной в примере 16, и используя в качестве исходных соединений натриевую соль 1-метил( ,ф-дихлорвинил)-5-окси,2,4-триазол и 0,0- диметилхлортиофосфат, получают 25 0,0-диметилтиофосфорный .эфир 1-метил-( ,3-дихлорвинил)-5-окси,2, 4-триазола, (т.пл. 102-103 С).Элементный анализ: С 1 (теорет).22,3, найдено 22,45.Н р и м е р 18. Получение 0,0- диэтилтиофосфата 1-метил-З-(,Д-дихлорвинил)-5-окси,2,4-тиазола.1-Метил-З(,1-дихлорвинил)-1,2,4- триазол-он (9,.15 г, 0,04 бб моля) суспендируют в ацетоне (150 мп). К этой суспензии добавляют СС 09 (6,9 г, 0,05 моля) и хлорангидрид 0,0-диэтилтиофосфорной кислоты (9,67 г 0,0466 моля). Реакционную смесь перемешивают при 55-60 еС в те чение 2 ч, затем отфильтровывают, и растворитель удаляют и получают твердое вещество желтого цвета (16,7 г) , которое перекристаллизовывают из гексана (250 мл), Таким образом получают 11,3 г продукта в виде белого нетвердого вещества с т.пл. 47-49 С, выход продукта после кристаллизации 70.В ИК-спектре продукта присутст- О вуют полосы при 1538 и 1515 см" (триазольное кольцо) и 1026 см (-Р-С- группайуЧистота соединения подтверждена с помощью тонкослойной хроматографии (ТСХ) с использованием в качестве элюента бензола и раствора РОС 1 в качестве проявителя.П р и м е р 19. Получение 0,0- диэтилтиофосфата 1-мстил- ф-метил- винил)-5.-окси,2,4-триаэола. во1-Метил-З-(-метилвинил)-1,2,4- триазол-он (1,5 г 0,0108 моля) суспендируют в ацетоне (50 мл) и к полученной суспензии добавляют КСОз (1,8 г, 0,013 моля) и О,Одйэтилтиофосфорилхлорид (2,03 г,0,0108 моля),Реакционную смесь перемешиваютпри температуре 55-60 аС в течение3 ч, а затем отфильтровывают. Раст"воритель удаляют, получая желтоемасло (3,5 г), которое очищают спомощью хроматографирования на силикагеле (40 г, бензол в качествеэлюента). Получают 2,5 г продуктав виДе бесцветного масла, выходочищенного. продукта 80, В ИК-спектре продукта присутствуют полосы поглощения на 1520 см-(триазольноекольцо) и 1020 см (-Р-С- груп 1па). Чистоту продукта проверяют спомощью тонкослойной хроматографии(элюент бензол, проявитель растворРдС 1 ) П р и м е р 20. Оценка биологи"ческой активности соединений.1) Биологическое действие наМасгоь 1 рбцв епрЬогЬ 1 ае (тлю).Сеянцы томатов, выращенные вгоршках, заразили женскими особямитли и через несколько часов опрыскали водной дисперсией исследуемыхсоединений (см, табл.5),Процент смертности тли оцениваличерез 24 ч после обработки (необработанные растения =О).2) Биологическое действие наРег 1 ьЬгавы сае (чешуекрылые).Срезанные листья сач 1111 оцгопрыскивали водными дисперсиямиисследуемых продуктов (см. табл.5),После высыхания листья заражалипятидневными гусеницами. Процент ихсмертности определяли через 48 чпосле обработки (необработанныелистья =О).3) Биологическое действие наЕерс 1 пойагьа десев 11 пеаса (колеоптера).Небольшие сеянцы томатов, выращенные в горшках, заражали четырехдневными гусеницами, а затем опрыскивали водными дисперсиями исследуемых продуктов (см.табл. 4 и. 5). Процент смертности (необработанные небольшие сеянцы =0) определяли через48 ч после обработки.4)Биологическое действие на Сц 1 ехр 1 р 1 епа (двукрылые). В два стаканас водными дисперсиями исследуемыхпродуктов (см. табл, 4 и 5 ) поместили трех- и четырехдневные личинкимоскитов. Процент смертности личинок(стаканы с чистой водой =О) определяли через 24 ч после обработки.5)Биологическое действие навзрослые особи ЬейгапусЬц цг 1 сае(клещи).Куски листьев бобовых заразиливзрослыми особями клещей, а затемобрабатывали водными дисперсиямиисследуемых соединений (см. табл.4и 5). Процент смертности определяличерез 24 ч после обработки (необработанные листья, смертность =О).б) Биологическое действие наГейгапусЬцс игс 1 сае,(клещи),Небольшие кусочки листьев бобовыхзаразили яйцами клещей, а затемопрыскали водными дисперсиями исследуемых продуктов (см. табл, 5). Процент смертности определяли через бдней после обработки (необработанныелистья, смертность =О).7) Биологическое действие наВродорсега 1 йогаа (чешуекрылые).Срезанные листья табака опрыскаливодными дисперсиями исследуемых продуктов (см. табл. 4 и 5).После высушивания листья заразили 15пяти дневными личинками. Процентсмертности личинок определяли через48 ч после обработки (необработанныелистья, смертность:0).8) Биологическое действие на 2 ОИе 1 о 1 додупе исо 9 п 1 а (нематоды).Смесь почвенного грунта и песка1:1, зараженную вновь появившимисягусеницами и яйцами нематоды, подвергали обработке водными дисперсиями исследуемых продуктов, смешиваяпоследние со смесью (см. табл.4 и 5).Затем грунт поместили в пластмассовые горшки и через 5 дней в каждыйгоршок посадили 5 небольших сеянцевтоматов высотой примерно 20 см.Результаты оценивали через 21день после посадки. Корни растений,извлеченных иэ грунта, оценивалипо степени заряженности на основеколичества образовавшихся галлов. 35Нематоцидное действие выражали впроцентном снижении заряженностив сравнении с контрольными образцами(небольшие сеянцы, высаженные внеобработанный грунт, активность =О).9) Биологическое действие наН 11 евуаЬгааасае(двукрылые),Небольшие порции грунта обработали водными дисперсиями исследуемыхсоединений путем равномерного смешения последних с грунтом (см. табл.4 и 5) . Затем грунт поместили в .два горшка, в каждый из которыхвысадили 4 сеянца редьки. Затемрастения заразили, поместив в грунтв середину поверхности горшков 50личинок Орезега.Результаты оценивали через 10дней после обработки путем извлечения растений из грунта и подсчета:количества личинок, находящихся вкорнях и в окружающем грунте.Инсектицидную активность выражалив процентном снижении заражения всравнении с контрольными образцами(растения, высаженные в необработанную почву, активность =О).10)Биологическое действие наВ 1 а 1 йа ог 1 епса 1 а(прямокрылые).Дно и стенки стеклянного кристаллизатора обработали ацетоновымраствором исследуемых продуктов(см. табл, 4 и 5).После испарения растворителя вкаждый кристаллизатор поместилидесять 80-100-дневных личинок. Затем кристаллизаторы закрыли металли"ческими сетками. Через 24 ч после начала обработки несекомых поместилив необработанные кристаллизаторы,где их выращивали. Процент смертности (необработанные насекомые =О)определяли через 48 ч после началаобработки.. ЗЗ СН(С 1) СН:СС 1 34 СНЗ СН=СС 1 35 (СН 2).СН СН=СН-СН Зб СН -СН(СН ) СН=СС 1 х) Температуры плавления не скорректированы. 22 СН 3-1 ОЪ уф ОЪ Ч) ф 3Ч 3 ОЪ с с с 11 Л СО Э фс3 О с ф 3 1 о хо ЧЗХОЙ СО СЧ с ф Ч 3 СОф м с с М О 1 ОЪ , В ОЪ.с с ОЪ . М СЧ ОЪ СО с СЧ 1 Л3 СЧс ОЪ Сф 1 1 о хо тихА 6 сО Х Ч 3 .3 СОс с ОЪ Ф СЧ СО . с ф 3 фМ СЧ с с 1 Л М о х 6 Ц фх ж СО 1 Л СфЪ м ф ;3 М с с со м вф 3 33 ф СЧ Зф фф ОЪ с с ф ф е 3 уф МСЧ1 Л ф с в бф Зф СЧ СС 3ССфхо о33 ф 1Х С,Ото оо х и 1 О о в О СС о о 11 Ю х ю о о СС 1 х о 1 х Ф хО о 1 О о в о о П Фх о ц фФ т оо 1 о ОЪ О О1 Ч 3ОЪ х е х О Х О о о Ь 3 фЪ 133х хФ 0о о Ф цф Ъ Ч 3х х ффф.в хСф сх Х 31 ф 0и о оо о о 13 Ъх х фр Оо о ь.ССф0о о 13 ССффхо .и Ь т С 3 о ь 3 й Ь Ь 333 333х хт х хО СС М ССи ои о оО О О О О а х х о о О О3 СЪ 333 Ь Сф В СС Ь 333 333 х х хх х х х х, х С 3 СС С 1 СС СС СС С 3 СС С 3 ООООООООО ф 33 х х СС СС о о3 фЪхССО сХбаЦХ 66 ХЕ О 1 СЧ М 3 ОЪ Щф СЧ М 3 1 Л Ч 3 1 с 00 В сф,3 -1фг 1 -1 -1 О 6 ох х, х 6 Е 6 Ц б)1 ССС 3 о С.1 131 СОСС 3 о ю СС,СС С 3 СО ю э 3 О сст 13 33 О О Дфс х Зх 333 ф о-Ц Оо
СмотретьЗаявка
2541750, 16.11.1977
ФРАНКО ГОЦЦО, ПЬЕР МАРИНО БОСЧИ, АНЖЕЛО ЛОНГОНИ
МПК / Метки
МПК: C07F 9/165
Метки: кислот, тиофосфорных, триазолсодержа-щих, эфиров
Опубликовано: 07.01.1981
Код ссылки
<a href="https://patents.su/14-795485-sposob-polucheniya-triazolsoderzha-shhikh-ehfirov-tiofosfornykh-kislot.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения триазолсодержа-щих эфиров тиофосфорных кислот</a>
Предыдущий патент: Способ получения -аминофосфонистыхкислот
Следующий патент: Способ получения ауранофина
Случайный патент: Устройство для извлечения инородных тел