Способ осаждения нуклеиновых кислот из растворов, содержащих фосфатный буфер
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
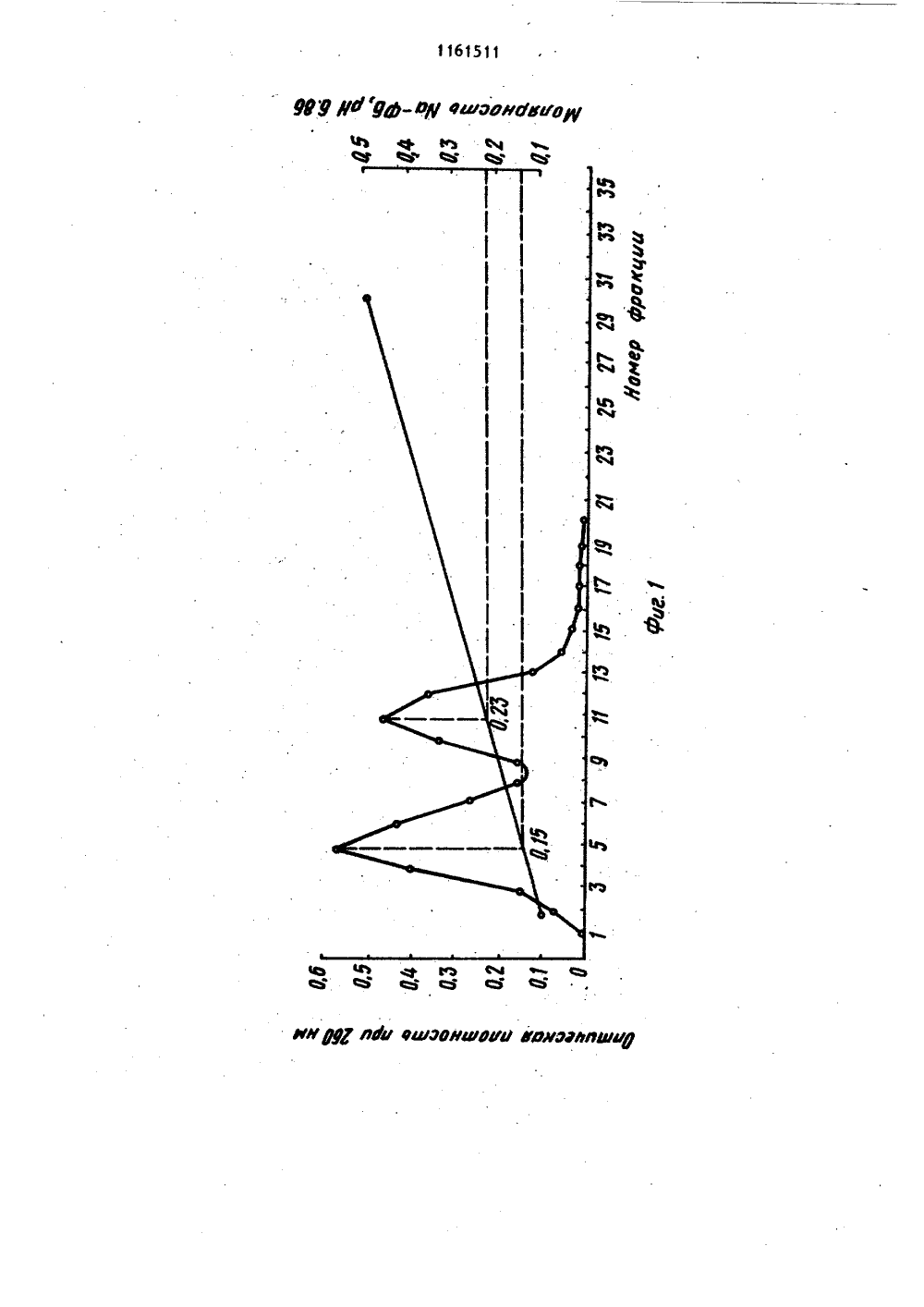
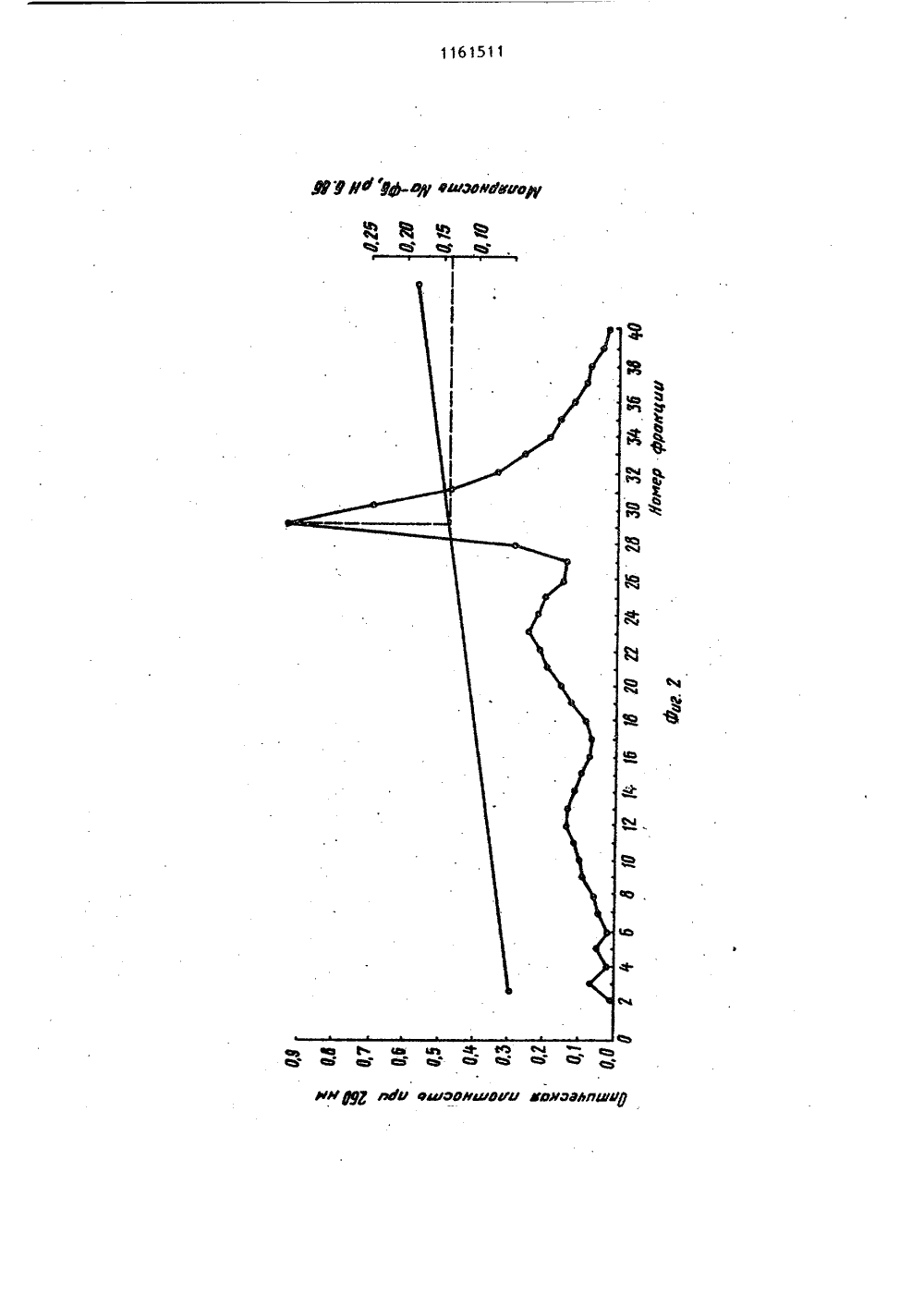
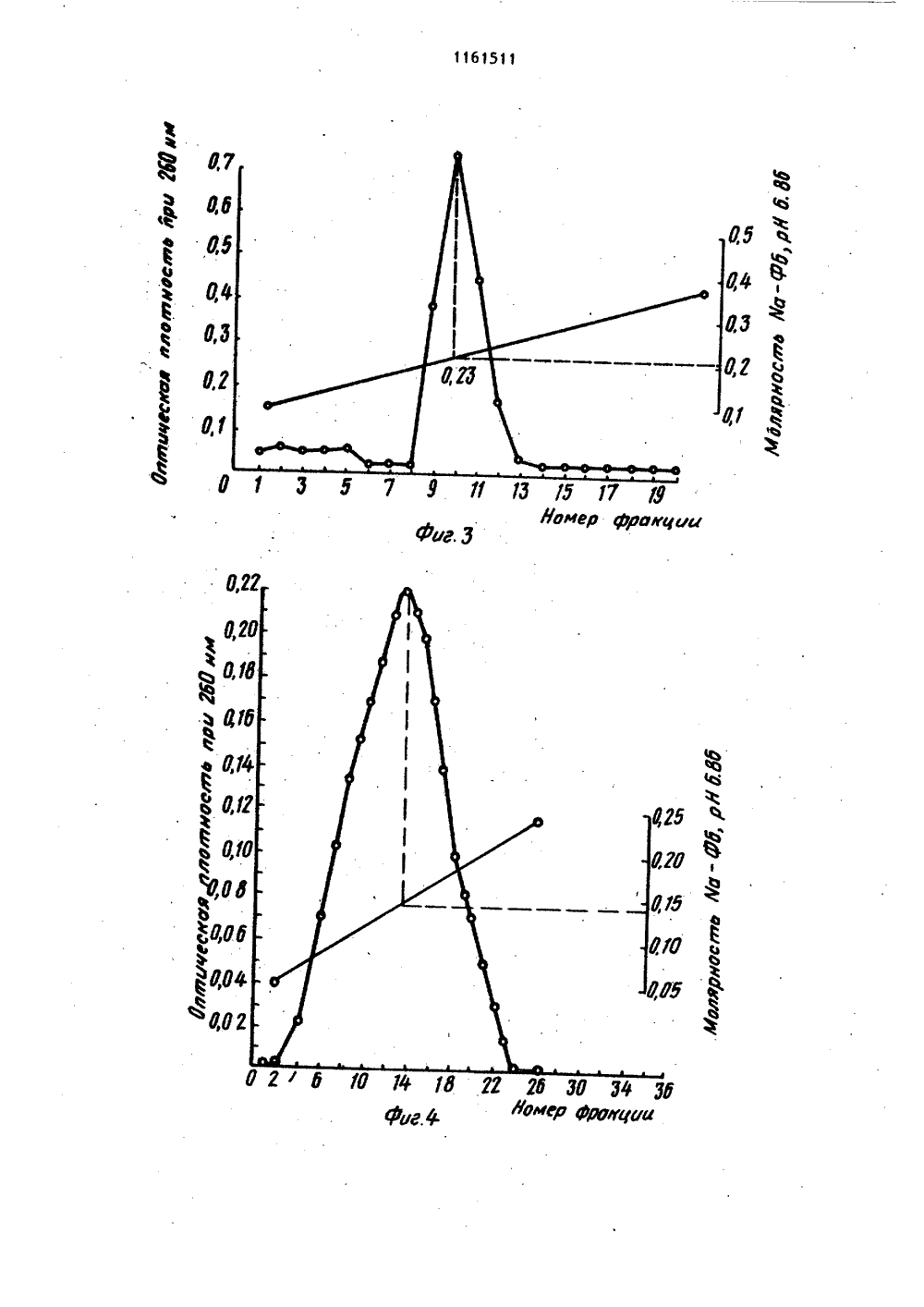
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСНИХРЕСПУБЛИК 4(50 С 07 Н 21 ОПИСАНИЕ ИЗОБРЕТЕНИК АВТОРСКОМУ СВИДЕТЕЛЬСТВУ ЭЙА-Ро 1 урерГЫе соар 1 ехезЮ. Мо 1. В 1 о 1 о 8.",. 1968,265 3,Р 2,юл. У Д.Ю. сследования нуклеино ред. акад. А.Н. Бе нр" щнй метод насеко 54, ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР10 делАм изОБРетений и ОтнРцтии(71) Институт биоорганической химииАН БССР(56) 1. Кау Е.К.М., Бипаопз Н.Б.,Эопсе А.1 Ап 1 вргочей Ргерагайдопой Бодыа ЭегохугхЬопцс 1 еае. - " 1.Аа. СЬев. Бос.", 1952, 74, 1724.2. Маг 1 соч С.С., 1 чапоч 1,С.Нудгохуараг 1 ге Со 1 апп СЬгошагоЕгарЬУдп Ргосейцгез Йог 1 зо 1 аС 1 оп оГРцгИдей ЭНА. - "Апа 1 У 1 са 1 ВдосЬеа 1 зггу", 1974, 59, 554 (прототип).3, Сулимова Г.Е., Дрожденюк А,П.,Ванюшин Б,ф. Выделение и очистка ДНКиз высших растений с помощью бромистого цетилтриметиламмония в сочетании с хроматографией на оксиапатите. -"Биоорганическая химия", 1976, т. 2,У 9, с. 1182-1188.4. Ландо Д,Ю., Кульба А.М.,Ахрем А.А. Влияние лигандов с избирательным характером взаимодействияна переход спираль - клубок ДНК Ч.Тепловая денатурация ДНК в кислойсреде. - "Молекулярная биология",1981, т. 15, В 5, с. 1093-1101.5. 01 дпз Э.Е., 011 пз А.1.Н 1 рре 1 М.Р. Оп гЬе зггцсйцге апйзгаЬ 1 Ыу оГ ЭМА- РЬогоаейгдс апд 6. Калинин Ф.Л., Лобов В.П.,Жидков В.А, Справочник по биохимииКиев, "Наукова думка", 1971, с. 7882-883.7. Методы и вых кислот. Подпелозерского. М. 3191.8, Черененко Е.И., Галкин А.П.,Лебедев В.Р., Кох И.П. Щадявыделения ДНК из ядер клетокмых. - "Укр. биох. ж.", 1982,с. 316-321.(54)(57) 1, СПОСОБ ОСАЖДЕНИЯ НУКЛЕИНОВЫХ КИ 1.ЛОТ ИЗ РАСТВОРОВ, СОДЕРЖАЩИХ ФОСФАТНЫЙ БУФЕР с концентрациейсолей 0,3 М, путем обработки раствора этиловым или изопропиловымспиртом, о т л и ч а ю щ и й с ятем, что, с целью сокращения длительности и упрощения процесса, раст вор перед обработкой спиртам титруют16 М формиатным буфером, имеющимрН 2,9-3,0, до значения рН раствора3,5-3,6.2. Способ по п. 1о т л и ч а ющ и й с я тем, что для осаждениядезоксирибонуклеиновой кислоты обрабатывают раствор одним .объемом спирта, а для осаждения рибонуклеиновойкислоты - двумя объемами спирта.11 б 1511 Изобретение относится к усовершенствованному способу вьщелениянуклеиновых кислот, а именно к способу осаждения спиртом дезоксирибонуклеиновой (ДНК).и рибонуклеиновой(РНК) кислот из растворов в присутствии фосфатного буфера, которыйпредставляет собой водный раствор со.лей НаНРО и ИаНРО, КНРО иКН РО,1 ОСпирты, такие как этанол и изопропанолшироко используются дляпрямого осаждения биополимеров и ихкомпонентов 1, в частности нуклеотидов, олигонуклеотидов и нуклеиновых кислот, из их водных растворов.Это наиболее распространенный и простой метод, который применяют при промьппленном производстве нуклеиновыхкислот. 20Однако если в растворе присутствуют соли фосфатного буфера,то вследствие их нерастворимости в 50-703-номэтаноле получение осадка нуклеиновойкислоты без примеси солей невозможно,25Известен способспиртового осаждения нуклеиновык кислот, который заключается в предварительном диализераствора нуклеиновых кислот для удаления солей фосфатного буфера с по-,следующим осаждением этанолом Я .Недостатками способа являются егодлительность (18-часовой диализ), атакже то, что при диализе происходитчастичная потеря биополимеров, свя 35занная с их сорбцией на диализноймембране. 2зтанола, отделения образовавшегося осадка, представляющего собой смесь фосфата кальция и ДНК, центрифугированием, обработки его этилендиамином для растворения солей кальция и диализа растворенных солей. ДНК осаждают этанолом после добавления хлорида натрия до концентрации ВаС 1 в смеси 0,2 М.Для получения растворов ДНК, содержащих фосфатный буфер с концентрацией солей 0,24 М, исходный растворобычно разбавляют водой, Выход полученной ДНК не указан 41,Основными недостатками этого метода являются, длительность стадии диализа и трудоемкость стадий перерастворения и центрифугирования,Цель изобретения - сокращениедлительности и упрощение процесса.Поставленная цель достигаетсятем, что согласно способу осаждениянуклеиновых кислот из растворов, содержащих фосфатный буфер с концентрацией солей 0, 3 М, раствор передобработкой этиловым или изопропиловым спиртом титруют 1 бМ формиатным буфером, имеющим рН 2,9-3,0 до значения рН раствора 3,5-3,6.При этом для осаждения ДНК обрабатывают раствор одним объемом спирта, а для осаждения РНК - двумя объемами спирта. Обычно снижение концентрации солей натрий-фосфатного буфера осуществляют путем разбавления исходногооили охлаждения его до 0 С с после Известен также способ осаждения нуклеиновых кислот из растворов в присутствии фосфатного буфера за ключающийся в добавлении бромистого центилтриметиламмония (цетавлона) ,в количестве 4 мг на 1 мг ДНК. Выход составляет 957 Ц , Однако необходимость проводить в дальнейшем очист ку полученного продукта от цетавлона, включающую растворение осадка, центрифугирование и двухкратное переосаждение этанолом, приводит к уменьшению выхода продукта. 50Наиболее близким к изобретению по технической сущности является способ осаждения нуклеиновых кислот, в частности ДНК, из растворов, содержащих фосфатный буфер с концентрациейсолей 55 приблизительно (0,24 М, путем обработки 1 мл исходного раствора 0,1 мл 0,5 М раствора хлорнда кальция и 1 мл дующим сливом надосадочной жидкости. Снижение концентрации солей калийфасфатного буфера достигается раэ; бавлением исходного раствора, поскольку гидроортофосфат и дигидроортофосфат калия обладают большей растворимостью, чем фосфорнокислые соли натрия, и при охлаждении не выпадают в осадок. При исходных значениях концентрации солей ниже 0,3 М первую стадию вообще опускают, Для осаждения ДНК обычно используют один объем спирта, а при осаждении РНК два объема,Известно, что при комнатной температуре 503-ная денатурация ДНК имеет место при рН 2,9 4. Кроме того, согласно 5 наличие в растворе 50-707 этанола понижает темперутуру плавления ДНК, что эквивалентно повышению кислотности денатурации11 4при спиртовом осаждении. Установлено, что при использовании формиатного буфера со значением рН 3, 1-3,2 возрастает необходимый для титрования объем этого буфера, а выход ДНК и РНК при последующем осаждении спиртом снижается. Буфер со значением рН 3,5 нельзя использовать, поскольку при этом не удается осадить нуклеиновые кислоты спиртом в присутствии фосфатного буфера.Выбор для осаждения формиатного буфера, а не глицин-НС 1 или фталатНС 1 буферов, у которых диапазон значений рН включает 2,9-3,0 С 63обусловлен тем, что растворимость в воде глицина ифталевой кислоты значительно ниже, чем муравьиной кислоты.1 Макснмальная концентрация глицин-НС 1 буфера не превышает 3 М, концентрация Фталат-НС 1 буфера ниже.При подкислении раствора нуклеиновых кислот, содержащего фосфатный буфер необходимо добавлять большой объем подкисляющего агента, что ведет к разбавлению растворов ДНК и РНК, в результате чего снижается выход нуклеиновых кислот при спиртовом осаждении и возрастает расход этилового (или изопропилового) спирта.Для титрования растворов необходимо использовать наиболее концентрированный Формиатный буфер, максимальная концентрация которого 16 М.Уменьшение концентрации буфера нецелесообразно, так как при этом возрастает раэбавление титр 9 емого раствора нуклеиновой кислоты и, как результат этого, снижается выход целевых продуктов, а расход используемого для осаждения спирта возрастает.Таким образом, существенным отличием предлагаейого способа является титрование растворов, содержащих Фос-. фатный буфер, перед обработкой спир том 16 М Формиатным буфером, имев-щнм рН 2,9-3,0, до значения рН раствора 3,5-3,6.Качество получаемых согласно предлагаемому способу препаратов ДНК и РНК проверяли хроматографическими и спектроскопическими методами. Для титрования используют формиатный буфер, имеющий рН 2,9-3,0.Нижняя граница рН буФера 2,9 подобрана с таким расчетом, чтобы приподкисленны, которое осуществляетсяпутем добавления формиатного буферак раствору нуклеиновой кислоты приодновременном перемешивании с.помощью магнитной мешалки, не произошла денатурация биополимера. При значении рН, которое имеет используемыйдля титрования буфер, денатурацнядезоксирибонуклеиновой кислоты, например, протекает за десятки секунд.Но поскольку перемешивание раствораи выравнивание рй происходит за период времени, который меньше на целый порядок, то биополимер после такой обработки остается в нативном.состоянии,Однако значение рН можно снизить.Так, согласно Ятитрование раствораДНК проводят с помощью концентрированной соляной кислоты (т.е. рН тит. рующего агента ниже 2,9).Титрование растворами, рН которыхниже критического значения 2,9, прикотором начинается денатурация ДНК, 40осложняет проведение процесса. Дляпредотвращения длительного локальногопонижения рН титрующий агент добавляют в микроколичествах (каннлляром)при крайне интенсивном перемешивании 45на магнитной мешалке. Это увеличиваеттрудоемкость метода и делает егонеприемлемым для работы с, большимиобъемами нуклеиновых кислот, так какобъем добавляемого титрующего агента 50и скорость перемешивания становятсякритическими моментами.Верхний предел значений рН Формиатного буфера выбран с таким расчетом, чтобы максимально снизить раз бавление раствора нуклеиновой кислотыпри титрованни, а следовательно,уменьшить потери целевых продуктов На Фиг. 1 представлены результаты анализа хроматографической очистки на гидроксиапатитеисходного препарата ДНК печени крысы в присутствии примесей РНК; на Фиг.2 - то же,3 11615 на О, 125-0,35 ед., т.е. до значения рН 3, 15-3,25. Поэтому титрование растворов ДНК или РНК, содержащих фосфатный буфер, заканчивают, когда рН раствора достигает 3,5-3,6, что выше значения денатурации. Значение рН более высокие, чем 3,6, использовать нецелесообразно, так как это приводит к снижению растворимости солей фосфатного буфера в водно спиртовой смеси и затрудняет процесс осаждения.11615 исходного препарата дрожжевой РНК;на фиг.3 - то же, ДНК печени крысы после спиртового осаждения из фосфатного буфера с предварительным подкислением; на фиг.4 - то же, дрож женой РНК после спиртового осаждения из фосфатного буфера с предварительным подкислением; на фиг.5 - кривая плавления ДНК печени крысы после спиртового осаждения иэ фосфатного 10 буфера с предварительным подкислением.Препараты ДНК и РНК, получаемые согласно предлагаемому способу проверяли на нативность и степень чис тоты. Нативность указанных биополимеров устанавливали по концентрации элюции с гидроксиапатита, а также по гиперхромному эффекту и температуре плавления, 20Известно, что при элюции с гидроксиапатита линейным градиентом концентрации Иа-фосфатного буфера (НаФБ) нативная ДНК элюируется при концентрации последнего, превышающей , 25 0,2 М, в то время как РНК и денату- рированная ДНК элюируются при более низкой концентрации Иа-ФБ (0,13- 0,15 М). Следует отметить, что при наличии смеси нативной и денатуриро- ЗО ванной ДНК соответствующие им пики полностью разделяются.Показано, что концентрация элюции ДНК составляет 0,23 М, а РНК - О, 14- 0,15 М Яа-ФБ; рН 6,86 (фиг. 1 и 2).После спиртового осаждения ДНК и РНК иэ фосфатного буфера .с предварительным подкислением 16 М формиатным буфером полученные осадки биополимеров растворяли и проводили их повторную хроматографию, Как видно из фиг. 3 и 4, концентрация элюции как ДНК, так и РНК не изменяется после осаждения предложенным способом. ДНК и РНК элюируются одиночными пиками соответственно в области 0,23 М и 0,14 М Иа-ФБ, что говорит о нативности и гомогенности этих препаратов.Спектрофотометрическое определение гиперхромизма получаемых согласноЯ предложенному способу образцов ДНК рри нагревании последних до 100 С с последующим добавлением формальдегида и охлаждением дало значение гиперхромного эффекта от 39,4 до 407,55 что характерно для нативных ДНК, Такое же:значение гиперхромного эффекта получено при плавлении препаратов 11 бДНК, полученных после спиртового осаждения из фосфатного буфера с предварительным подкислением, на спектрофотометре СФ. Температура плавления Т составила 86,6 С, что также характерно только для нативных ДНК Я .Кривая плавления ДНК печени крысы, в растворе, содержащем 0,15 М НаС 1 и 0,015 М цитрата Оа (рН 7,3), изображена на фиг.5.Чистота препаратов ДНК и РНК определялась их спектральными характеристиками. Препарат нуклеиновой кислоты считается чистым, если для его спектра выполняются соотношения Ебо /Ео 1,8; Еао/Еэ,.2 (Е- оптическая плотность при длине волны, равной 1 81 . В таблице приведены спектральные характеристики препаратов ДНК печени крысы и дрожжевой РНК до и после осаждения. Как видно иэ таблицы, обработка формиатным буфером перед осаждением не загрязняет препаратов нуклеиновых кислот. Наоборот, спектральные характеристики ДНК и РНК после спиртового осаждения нз фосфатного буфера с предварительным подкислением по сравнению со спектральными характеристиками исходных препаратов несколько улучшаются.П р и м е р 1, Осаждение ДНК из растворов, содержащих 0,5 М фосфатный буфер (рН 6,9).15 мл раствора ДНК печени крысы (0,18 мг/мл; 3,6 о.с.) мл; 2,7-10- г), ,содержащего Ма-фосфатный буфер в концентрации 0,5 М охлаждают в химическом стакане до 0 С и выдерживают приоэтой температуре в течение 10 мин. При этом выпадают кристаллы солей фосфорной. кислоты, после чего надосадочную жидкость осторожно сливают в чистыйхимический.стакан.Концентра- ция буфера при этомснижается до 0,3 М.Слитый раствор титруют 16 М формиатным буфером рН 3,0 при перемешивании с помощью магнитной мешалки.Перемешивание прекращают, когда рН титруемого раствора достигает значения 3,5. После окончания титрования к раствору ДНК добавляют 17,5 мл этанола. Выйадает осадок ДНК, его собирают. Получают 2,4510г (94 ) ДНК.П р и м е р 2. Осаждение ДНК из раствсров, содержащих 0,25 М Ма-фосфатный буфер (рН 7,0).11615 Спектральные характе- ристики Препарат Еаво /Еаво Емо /Евъо ДНК печеникрысы доосаждения 1,84 2,2 ДНК печени крысы после осаждения предлагаемым спосо бом 2,3 1,85 РНК дрожжейдо осаждения 1,9 2,17 РНК дрожжей после осаждения предлагаемым способом 2,2 14,8 мл раствора печени крысы(0,045 мг/мл; 0,9 о.с./мл; 0,6710г), содержащего 0,25 М На-ФосФатный буфер, титруют в химическомстакане формиатным буфером (16 М,рН 2,9), перемешивая раствор при помощи магнитной мешалки, до значениярН 3,5 Затем к раствору добавляют16 мл изопропанола, собирают выпавший осадок. Получают 0,54 10- г 10(80 Х) ДНК,П р и м е р 3. Осаждение РНК израстворов, содержащих О, 15 М Яа-фосфатный буфер (рН 7,0).Суммарный пул фракций, содержащих 1 ЗРНК дрожжей и собранных после хроматографии на оксиапатите, представляет собой раствор РНК (10,0115 мг/мл;2,3 о.с./мл; 1,495 х 10г) в 0,15 МЯа-фосфатном буфере, рН 7,0. 13 мл 20этого раствора подкисляют 16 М формиатным буфером на рН-метре до значения рН 3,5 при перемешивании намагнитной мешалке. Затем приливаютк раствору РНК 27 мл этанола и выдерживают при -20 С в течение 1 ч. Выпавший осадок РНК собирают центри 11 8фугированием (18 тыс. об./мин) в течение 10 мин. Выход РНК составляет 1,230 10г (82,5 Ж).П р и м е р 4. Осаждение ДНК из растворов, содержащих 0,5 М К-фосфатный буфер (рН 7,2).15 мл раствора ДНК печени свиньи (10, 10 мг/млр 2 о.с./млр 1,510- г), содержащего 0,5 М К-фосфатный буфер (рН 7,2), предварительно разбавляют дистиллированной водой в 2 раза.После подкисления формиатным буфером на рН-метре до рН 3,56 с одновременным перемешиванием раствора магнитной мешалкой добавляют 32,4 мл этанола. Осадок отделяют, выход ДНК 1 2710- г (84,5 Х).Таким образом, предлагаемый способ осаждения нуклеиновых кислот позволяет быстро и с высоким выходом выделять ДНК или РНК из растворов, содержащих фосфатный буфер, осуществляется при любом объеме раствора и не требует длительного и трудоемкого диализа.Я 9 КВ Яр оу вшэонбвиорМЪ 4 ФфЪ Ф ъс, Ф Ч М Ф М
СмотретьЗаявка
3614513, 01.07.1983
ИНСТИТУТ БИООРГАНИЧЕСКОЙ ХИМИИ АН БССР
АХРЕМ АФАНАСИЙ АНДРЕЕВИЧ, ЛАНДО ДМИТРИЙ ЮРЬЕВИЧ, ШУМИЛИНА ТАТЬЯНА АНТОНОВНА
МПК / Метки
МПК: C07H 21/00
Метки: буфер, кислот, нуклеиновых, осаждения, растворов, содержащих, фосфатный
Опубликовано: 15.06.1985
Код ссылки
<a href="https://patents.su/9-1161511-sposob-osazhdeniya-nukleinovykh-kislot-iz-rastvorov-soderzhashhikh-fosfatnyjj-bufer.html" target="_blank" rel="follow" title="База патентов СССР">Способ осаждения нуклеиновых кислот из растворов, содержащих фосфатный буфер</a>