Способ конструирования рекомбинантных векторов усr р 2, усr р 3 и усr р 4
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
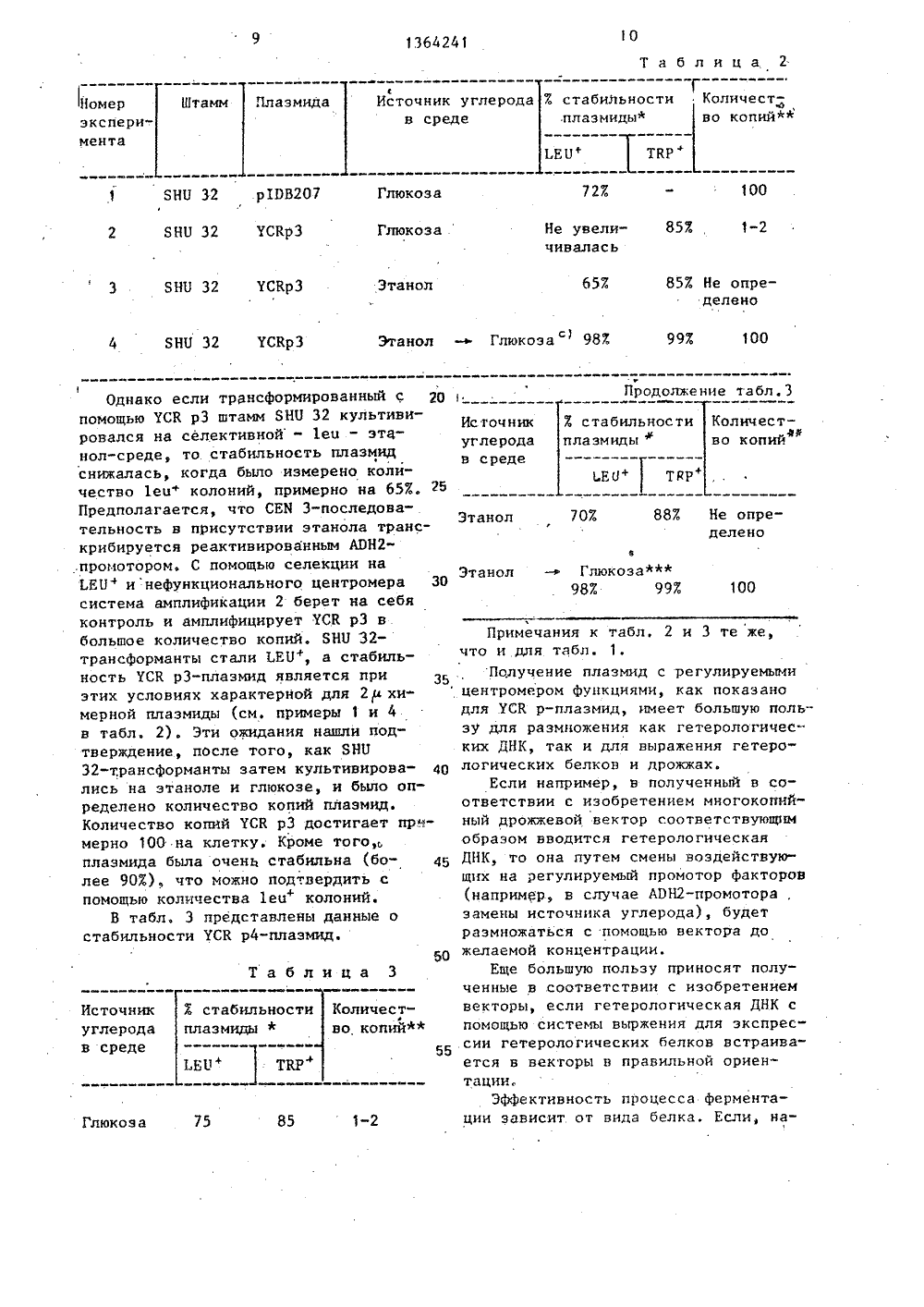
(1980) ЯаГОСУДАРСТВЕННЫЙ КОМИТЕТ СССРПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЗ(71) Верингер Ингельгеймналь ГмбХ О)Е)(54) СПОСОВ КОНСТРУИРОВАНИЯ РЕКОИБИНАНТНЫХ ВЕКТОРОВ УСКр 2, УСКр 3 и ТСКр 4(57) Изобретение относится к генной инженерии и касается способа получе ния рекомбинантного многокопййного дрожжевого вектора. Цель изобретенияповыщение стабильности рекомбинянтных векторов, Способ получения векторов УСК р 2-4 заключается в том, что вектор, который имеет стабнлизирукицую функцию, вводят в регулируемый промотор так,что имеется возможность с помощью этого промотора управлять регулирукзцей функцией, 2 ил,3 табл.13642Изобретение относится к геннойинженерии и.касается спбсоба получе.ния рекомбинантного многокопийногодрожжевого вектора. 5Целью изобретения является повышение стабильности рекомбинантныквекторов.Стабильность векторов УСК р 2-4обеспечивается за счет помещения 10СЕВЗ-последовательности перед промотором алкоголь-гидрогеназы 11 (АОН 2) .При этом трансформированные с помо-,щью АОН 2-СЕИЗ-плазмиды слияния дрож-жи культивируются в присутствии глюкозы, то АОН 2-промотор дезактивируется (АРН 2-АУЯ), а СЕИЗ митотическистабилизирует УСКр-плаэмиду (СЕЯЗ"АК).. При переводе источника углерода на.этанол АОН 2-промотор реактивируется 20и полностью блокируется экспрессиейс помощью, региона СЕМЗ, что обеспечивает возможность амплификации дожелаемого числа копий,На фиг.1 схематически изображеныкарты сайтов рестрикции к генетические карты плазмид рВСЗТ 1 и АОН 2-ВЯи показано получение УСК р 2-плазмиды;на фиг.2 - карта сайтов рестрикциии генетическая карта плазмиды 1 РВ20/ и показано получение УСК рЗ" иУСК р 4-плазмид,Способ осуществляют следующимобразом.П р и м е р 1. Плазмнда РЙСЗТ 1 35содержит часть рВК 322 с геном устойчивости к ампицилину (АрК) ОК 1 дляселекции и стабильного роста в Е.со 1 кКроме того, плазмида содержит ген1:гр 1 на Есо К 1/Есо К 1-1 фрагменте 40(45 1 сЬ), который происходит из хромосомы дрожжей 111. Этот ген позволяетосуществлять отбор нужных клонов наштамме дрожжей гр 1 . На том же са"мом ОНК-фрагменте находится АКЯ 1-. 45Фрагмент (автономно реплицирующаясяпоследовательность). АКЯ 1-фрагментпозволяет ОНК реплицироваться в дрожжах. рВСЗТ 1-плаэмида содержит к томуже и СЕИЗ-последовательность на . ВО2,0 ЕЬ Н 1 пй П 1 Вав НХ-Фрагменте,который происходит от.хромосомыдрожжей 111. Плазмиды, которые содержат СЕИЗ-последовательность, митотически стабильны и в клетке имеется1-2 копии.Плаэмида АО Н 2 ВЯ - это РВВ. 322с клонированным в ВавН 1 сайте,2,0 1 сЬ ВавН 1 - Яао ЗА-фрагментом хро 41мосомной ОНК дрожжей, который содержит ген АОН 2. При этом в результатесоединений концов ВавН 1 и Яаы ЗА рггенерируются места рестрикции ВавН 1,так что ген АОН 2 из АОН 2 Я-плаэмндыможет вырезаться,Из опубликованной ДНК-последова/тельности для гена АОН 2 и 5 фланкирующих регионов известно наиболееблагоприятное место рестрикции в позиции +67 (причем +1 является А АТСкодона). Это место выреза ЕсоКЧ совместно с местом выреза ВавН 1 было использовано в позиции -1027 "противтечения", чтобы изолировать АОН 2 промоторсо всеми его 5 фланкирующими регуляционными последовательностями.5 мкг ЮН 2 ВЯ-плаэмидной ДНК полностью переваривают с помощью ЕсоКЧ(фиг, 1)., очищают с помощью экстракции фенолом и осаждают этанолом,связывают "тупым концом" с 2 мкгфосфолированных Вя 111-звеньев( САСАТСТСЗ) (биологическая лаборатория) и вновь разрезают с помощьюВАш Н 1 и ВЯ 111; после препаративного арагоза-гель-электрофореза иэоли"руют 1300 Ь р-фрагмент, Этот фрагментсодержит полный АРН 2-промотор совсеми регуляционными последовательностями и небольшой участок кодирующего ЛОН 2 региона,5 мкг рВСЗТ 1"плазмндной ДНК полностью переваривают с помощью ВашН 1 эндонуклеазы, очищают с помощью экс.тракции фенола и осаждения этанола ис помощью телячьей кишечной фосфатозы.После новой экстракции фенолом иосаждения этанолом 100 нг ВашН 1 разрезают и дефосфолированной рВСЗТ 1 плазмидной ДНК соединяют с 200 нг1,3 кЬ"Фрагмента ВавН 1/Вя 111, АОН 2 промотора, Т ДНК"лигаэой. После этого компетентйые КК 1-клетки трансформируют с помощью 1/5 этой смеси. Ре"зистентные к ампицилину колонии отбирают путем гибридизации колоний благодаря тому, что маркированный радио"активно с помощью ник-трасляции1,3 кЬ ВавН 1/ВЯ 111 АОН 2-промоторныйфрагмент был использован в качествепробы. Иэ 12 проявивших себя положительно колоний получают плаэмиднуюДНК и перерабатывают различными рестрикционными эндонуклеазами, чтобыидентифицировать клоны, которые имеют АОН 2"вставку с ориентацией, котоз136рая дает возможность транскрипциюАОН 2"промотора с помощью СЕЮ 3-после"довательности. Этот клон изолируют.С целью определения количества копий и стабильности плазмиды в дрожжах с помощью УСВ Р 2-плазмидной ДНКтрансформируют в штамм дрожжей ЯНО32(игр-, 1 еи , сч, а 3 ). ТКР-трансформанты были изолированы и прове-,рены на стабильность и количесгвокопий.Трансформацию дрожжей осуществляютв соответствиис известным способомсо следующими модификациями,200 мл клеток с концентрацией2 х 10 клетка/мл очищают промываниемв 25 мл Н О путем центрифугирования.Эти клеткй обрабатывают 10 мл раствора 1 М сорбитола, 25 мМ ЕВТА (рН 8) и50 мИ дитиотрейтола в течение 10 минпри 30 С и затем промывают 10 мл 1 Мсорбитола. После этого пеллетированные клетки ресуспендируют в 10 млБСЕ (1 М сорбитол, О,М цнтрат натрия, рН 5,8, и 0,01 М ЕОТА) и обрабатывают при 300 С с помощью 1 мг цимолиза 5000 (фирма "Кирин брауэрай").807.-ную сферопластификацию осуществляют путем добавки 100 мп суспензиик 0,9 мл 107,-ного раствора БОБ; изме-.рения проводят при АЬЯ 00 с применением клеточного раствора перед добавкой фермента как ОХ"ное выравнивание/лизис в 107-ном растворе ЯЭЯ привел к осаждению осадка АЬБ 0).Затем клетки трехкратно промывают, 10 мл 1 М сорбитола, один раз 1, Мсорбитола, 10 мИ СаС 1и 10 мИ трисНС 1 (рН 7,4) и затем ресуспендируютв 1 мл того же раствора. Затем добавляют 5-15 мкг очищенной плазмиднойДНК и осторожно смешивают со 100 мклресуспензированных клеток в течение. 15 мин. При осторожном перемешиваниив течение 15 мин добавляют 1 мл раствора, который содержал 207.(М/Ч) полиэтиленгликоля 4000 (Мсг ск), 10 мМСаС 11 и 10 мМ трис-.НС 1 (рН 7,5). Затем клетки центрифугируют и нкубируют в течение 20 мин при 30 фС в 200 икл,(Ч/Ч) УЕРД-бульона и 6,5 мМ СаС 1).Затем 100 мкл этой суспензии помеща-ют на чашку Петри, которая содержит 4241 4 пластины (ТВР илиЕ 11 селекция). Процентную стабильность плазмид определяют путем деления количества вколониях, которые выращены селективно, на количество в колониях, кото 30 рые выращены неселективно, и после"дующим .умножением на 100. Определение количества копий плазмид осуществляют птуем анализа35;Соузерна. Всю ДНК ЯЕВ 32-(УСК р)трансформантов, которые выращены в селективной среде, перерабатывают с помощью Есо К 1-рестриктированной эндонуклеазыи Фракционируют путем агарозного-гель-электрофореза. После 40 переноса на нитроцеллюлозные фильтры ДНК гибридиэуют маркированной радиоактивно ник-трансляцией У 1 р 5-плазмидой ДНК (Лр 5 - это рВВ. 322, кото рый содержит ДЖАЗ-ген дрожжей). После экспонирования на рентгеновскую пленку наблюдают по меньшей мере две полосы. В .качестве другого контроля .служит ДНК-проба трансформированного с помощью УСр-плазмиды ЯНН 32; благо 50 даря этому оказалось возможным непосредственное сравнение количествакопий УСр и УСК р-центромерных плазмиде Данные приведены в табл. 1. 20 мл Воггош Аяаг (182 г сорбитола, 20 г глюкозы, 0,7 г УИВ и 30 г ЫЕео Айаг" на 1 л Н 10), и 10 мл 50 С "ТорАаг" (тот же состав, что и "Во;Сош 11Аяаг , однако дополнительно с добавлением 1 мл алеина (1,2 мг/мл), 1 мл урацина (2,4 мг/мл) имл смеси без триптофана на 50 мл "Воганов-ЛЕаг" О (смесь без триптофана содержит следующие аминокислоты на 100 мл НО: 0,2 г аргинина; О, 1 г гистидина;0,6 г изолейцина; 0,6 г лейцина;0,4 г лизина; 0,1 метионина; 0,6 г 5 Фенилаланина и 0,5 г треонина, этаТгр+-селекция дала 10 трансформантов дрожжей ка 1 мкг плазмидной ДНК.Стабильность плазмид в дрожжахпроверяют благодаря тому, что клетки после селективного или неселективно.го выращивания разбавлены водой и 1плакированы на УРД-пластины (неселек.тивно). После 30 ч роста при 28 С эти пластины плакируют на УИВ+СЛА,Номер экспе- римента Количество копий 11-2 ЗНН 32 г Бнц зг 3 янц зг 4 Знц 32Глюкоза Этанол 807 рВСЗТ 1 рВСЗТ 1 1-2 Глюкоза УСКрг Этанол 5-10 367 УСКрг ускрг Этанол Глюкоза957 5, ВНО 32 Этанол - Глюкозасф957 8-12 6 БНН 327 стабильности .плазмиды определяется по 25 генерациям на неселективном выращивании,ф Количество копий определялось по 12 генерациям на селективнойсреде.Штамм культивировался (12 генераций) на селективной средеэтанола, затеи на 12 генерациях проверялся на селективной:есреде глюкозы и инокулят этой культуры был взят для определениястабильности и количества копий.фд Штамм культивировался в. тех же условиях, что и в пункте ,однако для 50 генераций на этайоле. Была подтверждена стабильность УСЫ рг-плазмидь, после того как на различных источниках углерода были выращены трансФорманты. Если их культивируют только на среде глюкозы, стабильность плазмид перемещается в сФеру других УСр-плазмид (примерно 40 80%); количество копий было незначительным (1-2 копни на клетку, см. примеры 1 и 3 в табл, 1), Глюкоза деэактивирует АОН 2-промотор (АОН 2-А%;, а СЕИ 3"последовательность может ра Б ботать нормально (СЕИ 3"АИ).Однако если УСЕ р 2-трансФорманты культивируют на содержащей этанол среде, то стабильность плаэмиды резко снижается (примерно до 36%), одна- бо ко количество копий возрастает (до 5-10 койий на клетку). УСр-плазмиды при одинаковых условиях прежде были стабильны и в наличии имелось незначительное количество копий (см. приме ры 2 и 4 в табл. 1). Это показывает, как транскрипция вновь реактивироваиного АВНг-промотора (АОН 2"АИ) блокирует СЕИ 3-последовательность (СЕИ 3-АУЯ). Как результат УСКгр-плазмида ведет теперь себя, как Жр-плаэмида; очень нестабильна, однако с большим количеством копий.Стабильность УСврг-плазмида стала вышее, чем прежде, когда среда была вновь перемещена на глюкозу. Стабильность на этой средесоставила почти 95%, а количество копий на клетку ос" талось постоянным: 5-10 копий (см. пример 5 в табл. 1). Таким образом, глюкоза вновь дезактивирует АПН 2-промотор (АЭН 2"АУЯ) и реактивирует СЕИЗ"Функцию (СЕИ 3-АИ). Однако сами дрожжи во время культивирования на этаноле не могли больше аккумулиро-. вать УСКрг-плазмиду, Даже после 50 генераций на среде этанола УИВ+САА ко" личество копий не превьппало 8-12 копий на клетку (см. пример 6 в табл.3),П р и и е р 2. Получение УСЕ рзи УСЕ р 4-плаэмид схематически пред; ставлено на Фнг. 2. Вектор р 1 ПВ 207 содержит бактериальную рАТ 153-плаэмиду (34) с резистентнымн генами ампицилина (Арй) и тетрациклина (Тес" ) и7 136424 ОК 1 для селекции и стабильного роста в Е.со 11. Кроме того, плазмида содержит 2,7 кЬ - ЕсоК 1/ЕсоК 1 фрагмент 21-ДНК. На этом фрагменте локализова но как 2,и место репликации, что дает возможность вектору экстрахромосомно реплицироваться и проявляться, так и КЕРЗ-локус 2 р-ДНК. Этот локус является важным элементом 2 системы ам О плификации и должен занимать цис-положение, чтобы сделать плазмиду способной к амплификации. Селекционный маркер ЬЕ 11 2, из которого происходит дрожжевая хромосома 111, был клониро ван после нескольких модификаций в РЯС 1 места разреза упомянутого 2 р ДНК фрагмента, Этот ген ЬЕП 2-й дает возможность осуществлять селекционирование на Ьец 2 -дрожжевых мутантах и дополняет мутацию Ьец 2 только тогда, когда она существует в "многокопийном векторе". Для получения ХСК рЗ- и ХСК р 4- 25 плазмид перерабатывают 5 мкг ХСК р 2-ДНК с Вя 1 11- и Ваш Н 1-рестрикционной эндонуклеазой, После препаративного электрофореза в арагозном геле изолируют фрагмент Вя 1 11/Ваш ЗО Н 1 размером 4,2 кЬ. Этот фрагмент содержал ТКР 1-ген дрожжей и АОН 2-СЕЯ 3-слияние. 5 мкг р 1 РВ 207 плазмидного ДНК перерабатывают с Ваш Н 1 и очищают путем экстракции фенолом и осажде" 35 ния этанолом и дефосфорилируют с помощью телячьей кишечной.фосфатазы.100 нг полученной таким образом р 103207-плазмидной ДНК лигируют с помощью 200 нг 4,2 кЬ - Вд 1 11/Ваш Н 1 4 О ХСК р 2-фрагмента. Е.со 1 х КК 1 клетки трансформируют с помощью 1/5 этой смеси и изолируют колонии АрК. Все без исключения колонии проверяют путем их. гибридизации с применением 45 пик-транслированного 4,2-кЪ-фраг-. мента ХСК р 2 в качестве пробы. Иэ , проявивших себя положительно колоний изолируют плазмидную ДНК и составляют карту сайтов рестрикции этих плазмид, Так как Вя 1 11/Ваш Н 1-фрагмент .клонируют в двух различных ориентациях в Ваш Н 1-местах разреза р 1 ВВ 207,18возникает две плазмиды: УСК р 3 нХСК р 4 (фнг. 2).Ориентирование клоннрованвого влияния АПН 2-СЕЯ 3-слияния не оказываетникакого влияния на стабильность иколичество копий УСК р-плазмнды вдрожжах. ХСК р 3-плазмнда теперь со-держит два маркирующих гена дрожжей:ЬЕУ 2-й и ТКР 1-ген, дополняют однуггр 1 -мутацию в самих дрожжах тогда,когда он содержится только в однойкопии на клетку, ЬЕБ 2-й-ген дополняет 1 ец 2-мутацию только тогда, когда он находится на "многокопийнойплаэмиде" (50-100 копий на клетку).Эта система дает возможность осуществлять проверку количества копийпутем простого плакирования на селективной среде. Все ЬЕУ+ клетки должнысодержать по меньшей иере 50 плазмидных копий на клетКу, в то время какТКР-клетки содержат по меньшей мере одну копию плазмиды, Кроме того,существует ЯНП 32-штаммы с 1 г, т,е,он имеет "дикий тип" 2 ДНК, чтообеспечивает ХСКрЗ-вектор двумя другими компонентами системы амплификации 2: КЕР 1 и КЕР 2. Полностью активная система амплификации 2 р требует КЕР 1 и КЕР 2 в транс и КЕРЗ иОК 1 в цис,Дрожжевой штамм ЯНБ 32 (с(ггр 1 , 1 ец 2 цг аЗ ) трансформируютс помощью ХСКр 3-плазмидной ЛНК,ТКР-трансформанты изолируют и проверяют на Ьец и цга . Все трансформанты, которые были проверены, являлись Ьец .и .цга и показали, чтоХСКрЗ-плазмнда существует в незначительном количестве копий. Этот результат не был неожиданным, так какв качестве источника углерода использовалась только глюкоза, т,е. СЕВ 3должен был быть полностью Функционально способным. СЕВ 3-Функция преодолевает систему амплификацни и стабилизирует количество копий плазмидв пределах 1-2 копии на клетку (пример 2 в табл. 2). Стабильность ХСКрЗв дрожжевом штамме ЯНБ 32 при выращивании на глюкозе также характернадля ХСр-плазмиды (около 807),10 1 Зб 4241 Таблица 2. Номер ФИсточник углерода в среде Штамм Плаэмида во копийф плаз миды эксперимента ТКР 100 727 Глюкоза 857., 1-2 Ие увели"чивалась Глюкоза 2 ЯНУ 32 УСКрЗ 857 Не опре- делено 3 БНБ 32 УСКрЗ Этанол Этанол -в Глюкоза 1 987 4 ЯНУ 32 УСКрЗ 997 00 1Однако если трансФормированный с 20 , помощью УСК рЗ штамм 8 НН 32 культивировался на селективной - 1 еи - этанол-среде, то стабильность плазмид снижалась, когда было измерено количество 1 ео+ колоний, примерно на 657, 25 Предполагается, что СЕЯ 3"последовательность в присутствии этанола транскрибируется реактивированным АЭН 2- .промотором. С помощью селекции иа 1.ЕН+ и неФункционального центромера 30 система амплификации 2 берет на себя контроль и амплифицирует ТСК рЗ в большое количество копий, БНН 32- трансФорманты стали 1.ЕБ+, а стабильность УСК р 3-плазмид является при этих условиях характерной для 2,и химерной плазмиды (см, примеры 1 и 4 в табл. 2). Эти ожидания нашли подтверждение, после того, как БНУ 32-трансформанты затем культивирова лись на этаноле и глюкозе и было определено количество копий плазмид. Количество копий УСК р 3 достигает примерно 100 на клетку. Кроме того, плаэмида была очень стабильна (более 907) что можно под,вердить с помощью количества 1 ео+ колоний.В табл. 3 представлены данные о стабильности УСК р 4-плазмид. Продолжение табл. 3 Х стабильностиплазмиды ф Колич ес тво копий Ис точ нихуглеродав среде.ЕО+ ТЯР 887 Не опре- делено Этанол 707 Этанол -+ Глюкоза987. 997 100Примечания к табл, 2 и 3 те же,что и для табл. 1.Получение плазмид с регулируемымицентромером Функциями, как показанодля УСК р-плазмид, имеет большую пользу для размножения как гетерологических ДНК, так и для выражения гетерологических белков и дрожжах.Если например, в полученный в соответствии с изобретением многокопийный дрожжевой вектор соответствующимобразом вводится гетерологическаяДНК, то она путем смены воздействую"щих на регулируемый промотор Факторов(например, в случае АЭН 2-промотора,замены источника углерода), будетразмножаться с помощью вектора дожелаемой концентрации.Еще большую пользу приносят полученные в соответствии с изобретениемвекторы, если гетерологическая ДНК спомощью системы выржения для экспрессии гетерологических белков встраивается в векторы в правильной ориентации,ЭФФективность процесса Ферментации зависит от вида белка. Если, на 50Таблица 3 Х стабильности Количестплазмидыво, копий Источникуглеродав среде 55 1.ЕУ ТКР Глюкоз а 75 1 БНУ 32 рПВ 207 7. стабильности Количест136пример, экспрессируется белок, который, начиная с определенной концентрации, является токсичным для организма, то весь процесс ферментацииможет стать неэффективным, если количеством белков нельзя управлять непосредственно или косвенно.С помощью полученных в соответсфтвии с изобретением векторов можнотолько путем смены воздействующихна регулируемый промотор факторов,например, путем смены источника углерода, количество копий экспрессионных плазмид устанавливать на низкое,среднее или высокое значение и на соответствующем уровне стабилизировать.С помощью этих векторов даже можнополучить токсичный для организма продукт благодаря тому, что количество 2копий векторов выражения в основаниифермечтации нескольких генераций малои отдельные плазмиды поддерживаютстабильными. Если затеи образованодостаточно клеточного материала, промотор "переключается", например, путем сиены источника углерода, и количество копий в экспрессионных плазмидах резко увеличивается. Тем самымодновременно производится желательныйбелок в большой концентрации; токсичность белка к этому моменту временималоважна.Полученные в соответствии с изобретением векторы даютвозможность выбирать неселективные условия культивирования; значительное преимуществопрежде всего с точки зрения использо"вания для получения белков на генотехнологическом пути,28 декабря 1984 г в "Немецкую коллекцию микроорганизмов (ПБМ)", Гризе,бахштрассе, 8, ДГеттинген былисданы нахранение: О 30 ЗВ 40 5 0 5 аЕ.со 11 штамм КК 1 (обозначение КК 1) под номером ПБИ 3176;ЯассЬагошусез сеге 1 ззае штамм БН 1 32 (обозначение ЯН 1 32) под номером ПЯИ 3182; 5плазмида: рВСЗТ 1, трансформированная в Е.со 11 КК 1 (обозначение рВСЗТ 1) под номером ПБИ 3180 уплазмида: рАП Н 2 Б, трансформированная в Е.со 11 КК 1 (обозначенная рЬП Н 2 В) под номером ПЯИ 3179 иплазмида; р 1 П В 207, трансформированная в Е.со 11 КК 1(обозначенная р 1 П В 207) под номером ПЯИ 3181,Все пробы ДИК были обрезаны с поМощью ЕсоК и гибридиэированы У 1 р 5 плазмидной ник-трансляционной ДНК.1) 3 мкг всей ДНК штамма БНО 32 (рЕВ 108) - типичная ТСр плазмида;2) 3 мкг всей ДНК штамма БНБ 32 (УСКр 2) - глюкоза;3) 3 мкг всей ДНК штамма БНН 32 (7 СКр 2) - этанол - глюкоза;4) 3 мкг всей ДНК штамма Б 1 Ш 32 (УСКр 2) - этанол (50 генераций) глюкоза;5) 1 мкг всей ДНК штамма БН 1 32 (р 1 ПВ 207);6) 0,2 мкг всей ДНК штамма БНБ 32 (р 1 ПВ 207);7) 0,05 мкг всей ДНК штамма БНН 32 (р 1 ПВ 207);8) 5 мкг всей ДН( штамма БНУ 32 (УСКрЗ) - глюкоза;9) 1 мкг всей ДНК штлз:а БНУ 32 (УСКрЗ) - этанол - глюкоза;О) Ор 05 мкг всей ДНК штамма БНЮ 32 (УСКр 3) - этанол -глюкоза;11) 0,05 мкг всей ДНК штамма ЯН 132 (УСКрЗ).- этанол - . глюкоза.Формула изобретенияСпособ конструирования рекомбинантных векторов УСКр 2, УСКрЗ и УСКр 4, з а к л ю ч а ю ц и й с я в том, что плазмиду рВСЗТ расщепляют рестрикционной эндонуклеазсй ВашН 1 с последующей очисткой и дефосфорилированием полученной линейной ДНК, плазмиду АПН 2 ВБ расщепляют рестрикционной эндонуклеазой ЕсоРЛ с последующей очисткой полученной линейной ДНК и ее связыванием с фосфолированным линкероч Вя 111 и полученный при этом фрагмент расщепляют рестрикционной эндонуклеазой ВашН 1 и В 111 с последующей очисткой фрагмента размером 1,3 кЬ, полученные фрагменты связывают Т-ДНК-лигаэой с получени" ем вектора УСКр 2, который расщепляют рестрикционнои эндонуклеазой ВашН 1, и Бя 111 с последующим выделением и очисткой фрагмента 4,2 кЬ, а плазми- . ду р 1 ПВ 207 расщепляют рестрикционной эндонуклеазой ВашН 1 с последую;- щей очисткой и дефосфорилирсванием полученной при этом линейной ДНК и полученные фрагменты связывают с.ДНК-лигазой с получением векторов ТСКрЗ и УСКр 4.1364241 ЕсоН НЬб 11 Ес 1 Я соЯ 1 соЯ со Есо Составитель Н. гузенкоактор А. Лежнина Техред Л.Серд 1 оковапа ееааюэю ююа 1 кторВ .Бу Заказ одписное 5 Производственно-полиграфическое предприят Уагоро Проектна 87/58 . ТиракВНИИПИ ГосудаРпо делам из113035, Москва, Ж 500твенногобретений-35, Раув омитета СС открытий кая наб.,
СмотретьЗаявка
3991833, 03.12.1985
Верингер Ингепьгейм Интернациот наль ГмбХ
АНДЖЕЙ СЛЕДЗИЕВСКИ, ЭВА ХЛЕБОВИЧ-СЛЕДЗИЕВСКА
МПК / Метки
МПК: C12N 15/00
Метки: векторов, конструирования, рекомбинантных, усr
Опубликовано: 30.12.1987
Код ссылки
<a href="https://patents.su/9-1364241-sposob-konstruirovaniya-rekombinantnykh-vektorov-usr-r-2-usr-r-3-i-usr-r-4.html" target="_blank" rel="follow" title="База патентов СССР">Способ конструирования рекомбинантных векторов усr р 2, усr р 3 и усr р 4</a>
Предыдущий патент: Способ получения производных 4, 5, 6, 7-тетра-гидротиазоло-(5, 4-с)-пиридина или их фармацевтически приемлемых солей
Следующий патент: Способ нанесения покрытия на изделия из нелегированной стали
Случайный патент: Солефенотиазинованые брикеты