Способ получения рестриктазы s ii
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
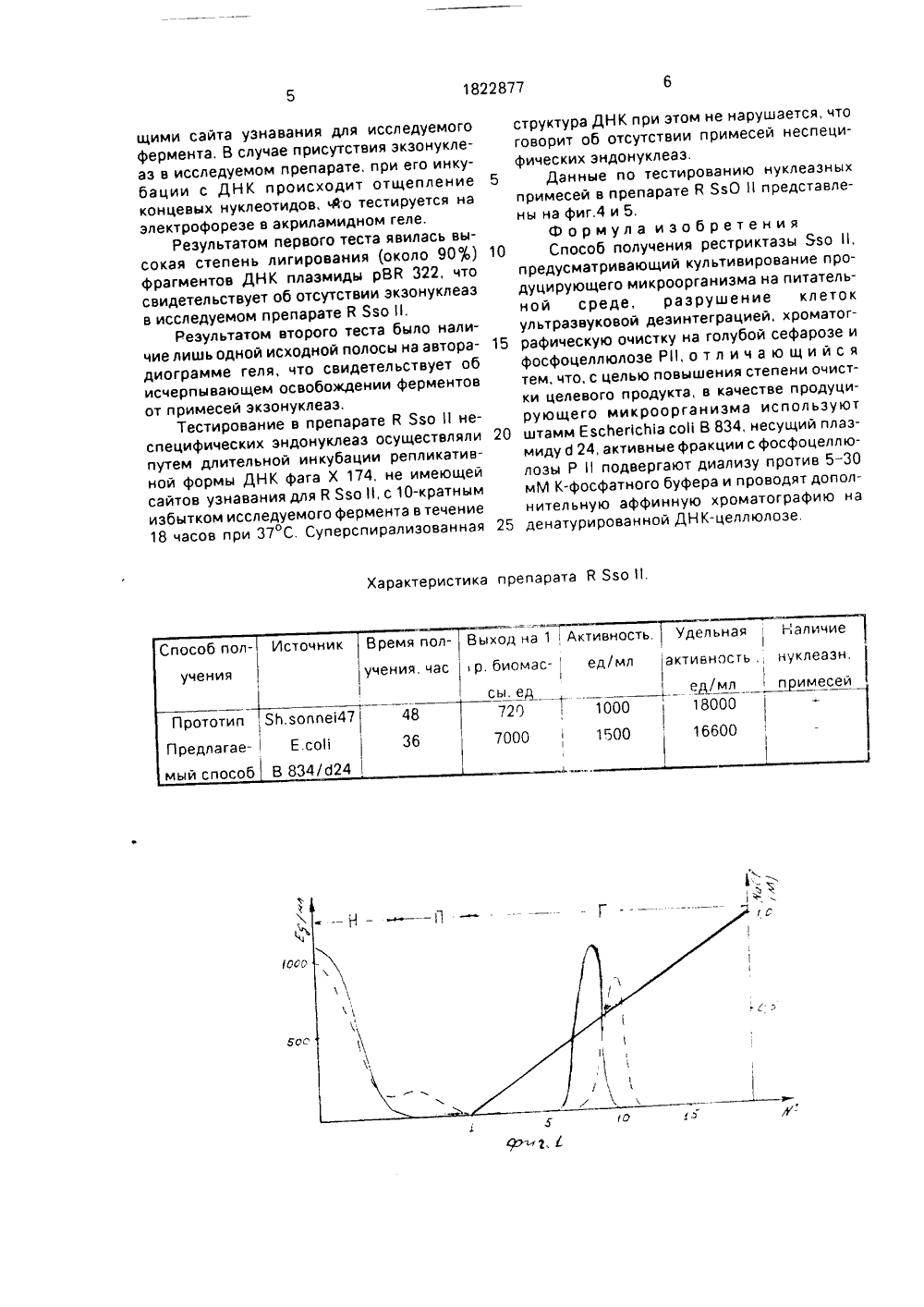
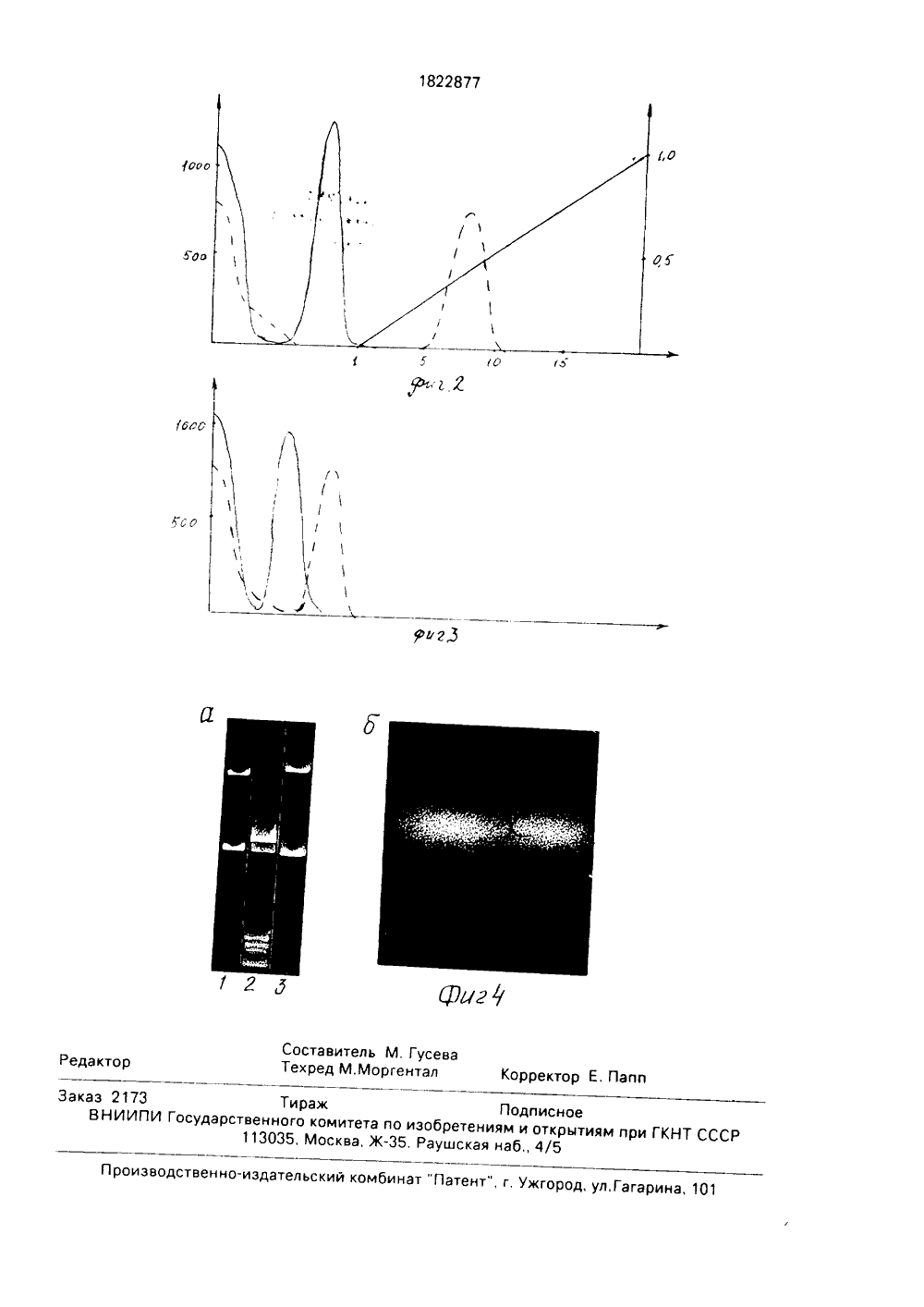
)5 С 12 М 9/14 4 ьС 66 йЭМПОгН, 1 сИеЧРг,4%Я 5е ф1ЕТ У отехнология и генная изобретения: способ биолоособа леазы ована ы ДНК, я гибыш, что низГОСУДАРСТВЕННОЕ ПАТЕНТНВЕДОМСТВО СССР(ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗ АВТОРСКОМУ СВИДЕТЕЛ(71) Институт биологической и медицинскойхимии АМН СССР и Научно-исследовательский институт вакцин и сыворотоким, И, И.Мечникова(56) ВоЬепз В,.). Везтг 1 ст 1 оп апО гпос 1 И 1 сат 1 опепгугпев апб йе 1 г гесоцп 1 т 1 оп зецоепсех)цс 1, Ас)с 1 з. Вез 1983, 11. М 1, р, 135-166,Косых А,МПунтежис М,А, Выделениерестриктирующей эндонуклеазы Есо В 1Биохимия, М 47, с,619-624,Упорова Т.М., Карташева И.М., Скрипкин Е.АЛопарева Е.ННикольская И,ИДебов С,С, Рестриктирующие эндонуклеазы из воппе 147, Вопр. мед. химии, 1985, т.31, с, 131-136.(54) СПОСОБ ПОЛУЧЕНИЯ РЕСТРИКТАЗЫБзо 11(57) Использование; биинженерия. Сущность Изобретение относится к микро гии и генной инженерии и касается сп получения рестриктирующей эндонук Язо 1, которая может быть использ для определения первичной структур рестрикционного анализа. создани ридных молекул. Целью изобретения является по ние степени очистки целевого продук Поставленная цель достигается те в качестве продуцирующего микроор1822877 А 1 выделения рекстриктазы 5 зо 11 из клеток Е,со 1 В 834 б 24, несущих плазмиду О 24, предусматривает трехстадийную схему хроматографической очистки голубая сефароза, фосфоцеллюлоза Р 11, аффинная хроматография на денатурированной ДНК- целлюлозе, причем активные фракции с фосфоцеллюлозы подвергают диализу противв 5-30 м М К-фосфат ного буфера, Получают рестриктазу с высокой степенью чистоты, полностью свободную от неспецифических нуклеазных примесей Фермент как и аналогичные препараты коммерческих фирм, обладает высокой удельной активностью и стабилен в течение 12 месяцев Фермент Язо 11 узнает последовательность СС х Сб, в которой центральный нуклеотид вырожден по всем четырем основаниям. Фермент может быть использован в генной инженерии для клонирования индивидуальных генов, создания гибридных молекул и в тонких структурных исследованиях, при картировании генома 1 табл. 5 ил ма используют штамм Е со 1 В 834/о 24 несущий рекомбинантную плазмиду О 24, ответственную за синтез В Язо 11(4). Активные фракции с фосфоцеллюлозы Р 11 подвергают диализу против 5 - 30 мМ К-фосфатного буфера и проводят дополнительную аффинную хроматографию на денатурированной ДН К-целлюлозе,За единицу активности рестриктазы принимают минимальное количество фермента, необходимое для полного расщепле 1822877ния 1 мкг ДНК фага в течение 1 ч при 37 С, Активность фермента определяется в инкубационной смеси объемом 50 т, содержащей 1 - 2 гп ферментного препарата, 1 мкг ДН К фага 1 и буферный раствор следующего состава: 0,1 М трис-НС, 0,01 М МцС 2, 0,001 М меркаптоэтанола, 50 мМ чаС рН,4. Время инкубации 1 час при 37 С,Фрагментацию ДНК тестируют в 0,8 агарозном геле, Гель окрашивают раствором этидия бромида в концентрации 3 мкг/мл в течение 15 мин и фотографируют в ультрафиолетовом свете при 254 нм с красным светофильтром.Примеры конкретного осуществления способа.П р и м е р 1. Клетки Е,со выращивают в ферментере АНКУМна среде Лурия до конца экспоненциальной фазы роста, Разрушение клеток проводят методом ультразвуковой дезинтеграции при +4 С в течение 5 мин в режиме 12 кГц, Обломки клеток удаляют центрифугированием при 40000 об/мин. Хроматографическую очистку фермента на ГС и ФЦ Р проводят аналогично способу-прототипу, Фракции после ФЦ Р содержащие рестриктазную активность, диализуют против рабочего буфера(РБ) рН 7,4. содержащего 5 мМ фосфата калия, 7 мМ меркаптоэтанола и 10 мМ ЭДТА, наносят на колонку с денатурированной ДНК-целлюлозой размером 1,2 х 36 см, уравновешенную тем же буфером, Белок элюируют градиентом концентрации МаС от 0,0 до 1,0 М. Фермент обнаруживается во фракциях, соответствующих 0,3 - 0,4 М чаС, неспецифическая нуклеазная активность - в области 0,35 - 0,45 М МаС частично перекрываясь с пиком ресктриктазной активности, Колонку уравновешивали РБ, содержащим 5 мМ фосфата калия, Элюирующая система представлена линейным градиентом концентрации Нас От 0,0 до 1,0 М. Скорость фракционирования 1,5 мл/ч. Объем промывочного буфера 12 мл, объем градиента 60 мл, объем одной фракции 1 мл (см,фиг,1)На фиг, 1 обозначены; Н - оттекающая жидкость П - промывочный буфер, Г - градиент, По оси абсцисс - номера фракций, по оси ординат слева - активность фермента (ед/мл), справа - молярность элюирующего раствора чаС (М),Облучен препарат К Явоза 36 ч с удельной активностью 10 тыс,ед/мг белка, однако целевой продукт содержит нуклеазные примеси, Потери активности фермент- ного препарата составляют 25 .П р и м е р 2, Фракции градиента с ФЦ Р, содержащие рестриктазную активность, диализуют против РБ содержащего 5 10 15 20 25 30 35 40 45 50 55 10 мМ фосфата калия, и проводят аффинную хроматографию на денатурированной ДЕК- целлюлозе, также используя 10 мМ К-фосфатный буфер. Остальные параметры фракционирования аналогичным примеру 1. Я Язообнаруживается в первых фракциях промывочного буфера, т.е. элюируется 0,0 М МаС, пик неспецифических нуклеаз - в области 0,35-0,45 М чаС, Колонку уравновешивали РБ, содержащим 10 мМ фосфата калия. Элюирующая система и обозначения аналогичны примеру 1 (см.фиг,2), Фракции, обладающие рестриктаэной активностью диализуют против РБ, содержащего 504 глицерина, с целью концентрирования и стабилизации фермента,За 30 часов получен препарат Я Язос удельной активностью 16 тыс, ед/мг белка, полностью свободный от неспецифических эндонуклеазных и экзонуклеазных примесей, и пригодный для любых видов структурных исследований, Потери активности фермента в процессе очистки составляют 20 .П р и м е р 3, Способ получения й ЯзОвключает все названные стадии, При хроматографии на денатурированной ДНК-целлюлозе используют буфер, содержащий 30 мМ фосфата калия. й Явои неспецифические нуклеазы обнаруживаются в оттекающей жидкости в виде двух перекрывающихся пиков, Колонку уравновешивали РБ, содержащим 30 мМ фосфата калия Обозначения те же (см,фиг,З), За 26 ч получен препарат К Язос удельной активностью 8 тыс. ед/мг белка. Целевой продукт содержит нуклеазные примеси, Потери активности Е ЯзО составляет 25 .Для стандартной процедуры выделения рестриктазы Явовыбран пример 2,Преимущества предлагаемого способа получения В Бво по сравнению с прототипом заключаются в том, что фермент полностью свободен от примесей экзонуклеаз и пригоден для всех видов молекулярно-биологических работ, включая структурные исследования, например, картирование генома,Препарат В Язо хранится при -20 С в течение 12 месяцев (срок наблюдения) без потери активности,Сравнительные данные по прототипу и предлагаемому способу представлены в таблице,Для доказательства отсутствия примесей экзонуклеаэ в полученном ферментном препарате были использованы два теста: 1) на эффективность лигирования фрагментов ДНК 2) тест короткими синтетическими мезгчеными Р олигонуклеотидами, не имею1822877 Характеристика препарата Р Язо 11. активность нуклеаз ед/млпдимесе с- ед 0 800 100 150 60 щими сайта узнавания для исследуемогофермента. В случае присутствия экзонуклеаз в исследуемом препарате, при его инкубации с ДНК происходит отщепление 5концевых нуклеотидов, 4 о тестируется наэлектрофореэе в акриламидном геле.Результатом первого теста явилась высокая степень лигирования (около 90 ф) 10фрагментов ДНК плазмиды рВВ 322, чтосвидетельствует об отсутствии экзонуклеаэв исследуемом препарате В Язо 11,Результатом второго теста было наличие лишь одной исходной полосы на авторадиаграмме геля, что свидетельствует обисчерпывающем освобождении ферментовот примесей экзонуклеаэ,Тестирование в препарате й Язо 11 неспецифических эндонуклеаз осуществляли 20путем длительной инкубации репликативной формы ДНК фага Х 174, не имеющейсайтов узнавания для К Язо 1, с 10-кратнымизбытком исследуемого фермента в течение18 часов при 37 С. Суперспирализованная 25 структура ДНК при этом не нарушается, что говорит об отсутствии примесей неспецифических эндонуклеаз.Данные по тестированию нуклеазных примесей в препарате Р ЯзО 11 представлены на фиг,4 и 5,Формула изобретения Способ получения рестриктазы Ьзо 11, предусматривающий культивирование продуцирующего микроорганизма на питательной среде, разрушение клеток ультразвуковой дезинтеграцией, хроматографическую очистку на голубой сефарозе и фосфоцеллюлоэе Р 11, о т л и ч а ю щ и й с я тем, что, с целью повышения степени очистки целевого продукта, в качестве продуцирующего микроорганизма используют штамм ЕзсЬегсЫа со 11 В 834, несущий плазмиду О 24, активные фракции с фосфоцеллюлозы Р 11 подвергают диализу против 5-30 мМ К-фосфатного буфера и проводят дополнительную аффинную хроматографию на денатурированной ДНК-целлюлозе.1822877 ГОо дг Я Составитель М, ГусевТехред М.Моргентал Редакто орректор Е, Папп Заказ 2173 Тираж ПодписноеВНИИПИ Государственного комитета по изобретениям и открытиям113035, Москва, Ж, Раушская наб., 4/5 КНТ СС енно-издательский комбинат "Патент", г, Ужгород, ул,Гага Произ 01
СмотретьЗаявка
4920753, 20.03.1991
ИНСТИТУТ БИОЛОГИЧЕСКОЙ И МЕДИЦИНСКОЙ ХИМИИ АМН СССР, НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ВАКЦИН И СЫВОРОТОК ИМ. И. И. МЕЧНИКОВА
НИКОЛЬСКАЯ-САНОВИЧ ИРИНА ИГОРЕВНА, УПОРОВА ТАТЬЯНА МАРКОВНА, ГРОМОВА ЕЛИЗАВЕТА СЕРГЕЕВНА, ЛЕВЧЕНКО ИРИНА ЯНОВНА, АРУТЮНЯН ЕЛЕНА ЕВГЕНЬЕВНА, ГРУБЕР ИРИНА МИРОНОВНА, КУБАРЕВА ЕЛЕНА АЛЕКСАНДРОВНА
МПК / Метки
МПК: C12N 9/14
Метки: рестриктазы
Опубликовано: 23.06.1993
Код ссылки
<a href="https://patents.su/4-1822877-sposob-polucheniya-restriktazy-s-ii.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения рестриктазы s ii</a>
Предыдущий патент: Способ приготовления подложки для культивирования клеток заднего эпителия роговицы глаза
Следующий патент: Способ получения фосфолипазы д
Случайный патент: Компрессионный прибор