Способ получения сложных эфиров полиоксистероидов прегнанового ряда
Формула | Описание | Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Формула
СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ ПОЛИОКСИСТЕРОИДОВ ПРЕГНАНОВОГО РЯДА общей формулы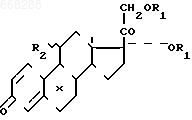
где R1 - остаток карбоновой кислоты алифатического ряда с 1-12 атомами углерода;
R2 - атом водорода или ацилоксигруппа;
X - атом водорода или галоида,
путем ацилирования полиоксистероидов со свободными ![]() - и 21-оксигруппами или их 21-ацилатов смесью карбоновой кислоты и ангидрида карбоновой кислоты в присутствии кислотного катализатора при 18-35oС с последующим выделением целевых продуктов, отличающийся тем, что, с целью интенсификации процесса и повышения выхода и качества целевого продукта, процесс ацилирования проводят, используя в качестве катализатора 55-70%-ную хлорную кислоту в количестве 0,9-3 моль на 1 моль исходного стероида, и стероид прибавляют к охлажденной до 0-10oС ацилирующей смеси.
- и 21-оксигруппами или их 21-ацилатов смесью карбоновой кислоты и ангидрида карбоновой кислоты в присутствии кислотного катализатора при 18-35oС с последующим выделением целевых продуктов, отличающийся тем, что, с целью интенсификации процесса и повышения выхода и качества целевого продукта, процесс ацилирования проводят, используя в качестве катализатора 55-70%-ную хлорную кислоту в количестве 0,9-3 моль на 1 моль исходного стероида, и стероид прибавляют к охлажденной до 0-10oС ацилирующей смеси.
Описание
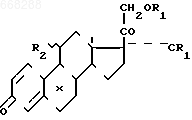 где R1 - остаток карбоновой кислоты алифатического ряда с 1-12 атомами углерода;
где R1 - остаток карбоновой кислоты алифатического ряда с 1-12 атомами углерода;R2 - атом водорода или ацилоксигруппа;
Х - атом водорода или галоида, представляющих собой промежуточные продукты высокоэффективных лекарственных препаратов, например триамцинолона и его производных.
Сложные эфиры полиоксистероидов прегнанового ряда, содержащий пространственно затрудненную третичную 17
Известен способ получения 11,17,21-триацетата 9
Существенными недостатками этого способа являются большая продолжительность процесса и образование побочных продуктов реакции при ацетилировании, особенно свободного 9
Целью изобретения является интенсификация процесса и повышение выхода и качества целевого продукта.
Поставленная цель достигается тем, что процесс ацилирования проводят, используя в качестве катализатора 55-70%-ную хлорную кислоту в количестве 0,9-3 моль на 1 моль исходного стероида, и стероид прибавляют к охлажденной до 0-10oC ацилирующей смеси.
Предлагаемый способ получения сложных эфиров полиоксистероидов прегнанового ряда общей формулы I заключается в том, что к приготовленной ацилирующей смеси: ангидрид карбоновой кислоты - карбоновая кислота - хлорная кислота, охлажденной до 0-10oC, прибавляют исходный стероид, полученную реакционную массу перемешивают при комнатной температуре 40-90 мин и затем выделяют целевой продукт известными приемами.
Описываемый способ позволяет значительно сократить продолжительность процесса и получать целевые продукты с количественным выходом и хроматографически чистыми из полиоксистероидов со свободной 21-оксигруппой.
П р и м е р 1. 11,17,21-Триацетат 9
К смеси 32 мл (339 ммоль) уксусного ангидрида, 25 мл уксусной кислоты и 1,55 мл (13,2 ммоль) 57%-ной хлорной кислоты, охлажденной до 5oС, прибавляют 5 г (13,2 ммоль) 9
Получают 5,65 г (100%) 11,17,21-триацетата 9
ИК-спектр, см-1: 1753-1738, 1235 (ацетатные группы), 1668 (3-кето), 1630 (
УФ-спектр:
П р и м е р 2. 11,17,21-Триацетат 9
К смеси 15 мл (159 ммоль) уксусного ангидрида, 12,5 мл уксусной кислоты и 0,78 мл (6,6 ммоль) 57%-ной хлорной кислоты, охлажденной до 5oС, прибавляют 2,78 г (6,6 ммоль) 21-ацетата 9
ИК-спектр, см-1: 1753-1738, 1233 (ацетатные группы), 1668 (3-кето), 1630 (
УФ-спектр:
П р и м е р 3. 11,17,21-Триацетат 11
К смеси 20 мл (189 ммоль) уксусного ангидрида, 13,5 мл уксусной кислоты и 0,88 мл (7,5 ммоль) 57%-ной хлорной кислоты, охлажденной до 5oC, прибавляют 2,7 г (7,5 ммоль) 11
Получают 4,03 г (100%) 11,17,21-триацетата 11
ИК-спектр, см-1: 1755-1733, 1235 (ацетатные группы), 1663 (3-кето), 1625 (
Заявка
2400022/04, 17.08.1976
Филиал Всесоюзного научно-исследовательского химико фармацевтического института им. Серго Орджоникидзе
Гаценко Л. Г, Крымов А. П, Казакова Н. В
МПК / Метки
МПК: C07J 5/00
Метки: полиоксистероидов, прегнанового, ряда, сложных, эфиров
Опубликовано: 15.09.1994
Код ссылки
<a href="https://patents.su/0-668288-sposob-polucheniya-slozhnykh-ehfirov-polioksisteroidov-pregnanovogo-ryada.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения сложных эфиров полиоксистероидов прегнанового ряда</a>
Предыдущий патент: Емкостный датчик давления
Следующий патент: Кабина подъемно-транспортного средства
Случайный патент: Подшипник качения



