Способ получения 1, 4-бис-замещенных2, 6, 7-триоксабицикло (2, 2, 2)октанов
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
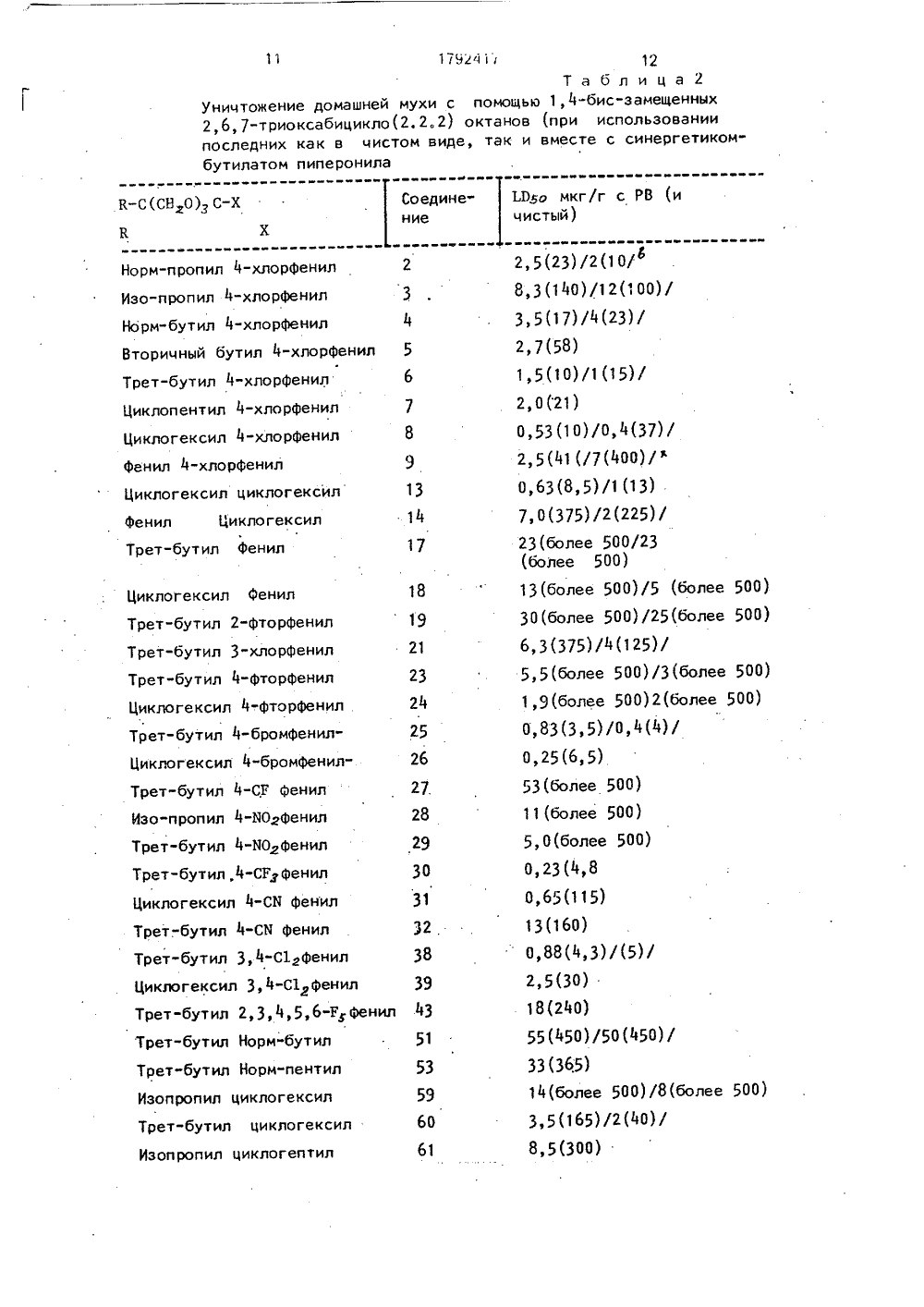
Текст
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСКРЕСПУБЛИК ГОСУДАРСТВЕНН ВЕДОМСТВО СС (Г СПАТЕНТ ССС ПАТЕНТНОЕ ИЕ ИЗ ЕНИЯ К ПАТЕ 2 е ОЙ ерсити оф Джон Е,Ка с,1140-43, ИС-ЗАМЕ- ИЦИКЛО роцикличеучения 1,4- би цикл о(2, О ракановкопитаю4 табл,уч нь пр та ти едующими .(4 30,01.93, Бюл.й 4 (7 Дзе Риджентс оф Дзе Юни Ка ифорния (ОЯ) (7 КристоферДж,Палмер(ОВ) и си а(ОЯ) (5 ЕЛ.Вогаз ет а 1, 1 АСЯ, 1966, 88 (5 СПОСОБ ПОЛУЧЕНИЯ 1,4-Б Щ ННЫХ 2,6,7-ТРИОКСА (2,2)О КТАН О В (5 Изобретение касается гете ск х веществ, в частности пол би -замещен н ых 2,6,7-тоиокса 2, октанов общей ф-лый Изобретение относится к способу полния новых соединений 1,4-бис замещенх 2,6,7-триоксабицикло (2,2,2)октанов, орые обладают инсектицидной активною и могут найти применение в сельском о яйстве. Цель изобретения - получение новых из водных 2,6,7-триоксабицикло(2,2)оков, которые обладают инсектицидной акностью, не характерной для данного л сса соединений.Способ иллюстрируется сл р мерами,П р и м е р 1, Смесь, состоящая из 1 рет-бутил.2 оксииетил,3.пропаиоиолаоличестве 0,4 г, 2,5 ммоля, триметил оро иклогексанкарбоксилата в количестве.,Ж 179241 5 С 07 О 493/08//А 01 М 43/9 гд В 1-СЗ.СБ-алкил с прямой или разветвленн цепью, фенил, или Сз-Св-циклоалкил; Х = н-бутил или -пентил, этинил, бромфенил, фенил,хлорфенил, фторфенил, С 5-СБ-циклоалкил, трифторметилфенил, цианофенил, нитрофенил, Из-фенил, 3,4-дихлорфенил, циклогекс-енил или 2-бицикло(2,2,1)гептил, обладающих инсектицидной активностью, что может быть использовано в сельском хозяйстве. Цель - создание новых веществ с активностью, не характерной для данного класса. Синтез ведут реакцией соединения ф-л В 1-С(СН 2 ОН)з, (ВгО)зС-Х, где В 2-низший алкил; В 1 и Х указаны в присутствии кислоты при нагревании, Новые вещества активны в отношении черных тараканов, домашних мух, личинок москита, рыжых таклопов при токсичности для млеих животных ЛД 5 о200 мгlкг,0,5 г, 2,5 ммоль и 4-толуолсульфокислоты в количестве 10 мг, подвергают нагреванию до 160 С до тех пор, пока не происходит выпаривание метанола. Полученный в результате остаток подвергают вакуумной сушке (при давлении 1 мм рт.ст. и затем пропускают сверху вниз через колонку, заполненную основным глиноземом (короткая колонка) с получением в результате триоксабицилооктана (соединение 60, где Х = с-Нех. В 1 = 1-Ва) в количестве 0,6 г, выход составляет 95% оттеоретического. Аналогичные процедуры используют для получения соединений, приведенных в табл,1,Определение биологической активности. 50%-ная летальная доза Е 050 для домашней мухи.Соединения, указанньн. в табл,1, были подвергнуты испытаниям с целью определения их инсектицидной активности и эти соединения подвергались растворению в ацетоне в тетрагидрофуране, в том случае, если они являлись нерастворимыми в ацетоне, Ряд последовательных растворов был получен с использованием одного и того же растворителя, Растворы соединения объемом 0,5"мкл наносились топически на Чеп 1 гцгп брюшйой полости анастеризированных взрослых, самок домашних мух (Мцзса богпезтса), вид 5 СВ спустя 3 - 5 дней после рождения, каждая муха имела вес, равный 20 мг. Исследования по определению токсичности проводились путем обработки (топической) домашних мух с использованием бутилата пиперонила в количестве 250 мкг на 1 г за 2 или 3 ч перед применением токсичного вещества, Обработанным мухам давали сахар и воду и уровень смертности определялся спустя 24 ч пои 25 С, Данные, представленные в табл.2, указаны как летальные дозы, выраженные в микрограммах токсичного вещества на 1 г веса насекомого, необходимые для того, чтобы уничтожить 50 летающих насекомых и эти данные обозначены как 50 О летальные дозы, ЕОво.В табл.2 представлены зависимости между структурой и активностью для соединений, подвергаемых испытаниям на мухах, а также на мухах, предварительно обработанных бутилатом пиперонила, Многие из этих соединений являются активными в том же самом диапазоне для данного вида испытаний, что и производимые в настоящее время промышленностью пестициды,Соединения, которые были получены и подвергнуты испытаниям с целью определения их инсектицидной активности и которые характеризуются очень высокой активностью(в общем случае их 50 О летальная доза .05 о является меньшей или равной примерно 5,5 микрограмм) живого веса, . в тех случаях, когда используются вместе с бутилатом пиперонила),Токсичность по отношению к домашним мухам зависит от природы как Й 1-заместителя, так и Х-заместителя, что представлено в приводимой далее табл.2, и в этой таблице данные являются первым очевидным свидетельством эффективности соединений, являющихся предметом настоящего изобретения и позволяет осуществить дальнейшие оценки. Соединения формулы 1,4-бис-замещен ные,6,7-триоксабицикло (2,2,2) октаны, были подвергнуты испытаниям как в чистом виде, так и вместе с бутамтом пиперонила (РВ), 25 в количестве 250 мкг/г живого веса за 2 ч доввода триоксабициклоактана. 50летальные дозы Ю 5 о определялись спустя 24 ч при 30 35 40 45 50 55 5 10 15 20 Токсичность соединений формулыпо отношению к черным тараканам, на примере топического применения 1,4-бис-замещенных,6,7-триоксабицикло (2,2,2) октанов, была подвергнута испытанию и при этом вещество использовалось как в чистом виде, так и вместе с бутилатом пиперонила. Полученные результаты испытаний представлены далее в табл,3,П р и м е р 2. Испытание с другими насекомыми,Соединения, указанные в табл.2, были подвергнуты испытаниям с целью определения их токсичности по отношению к взрослым самцам черных тараканов (Репрапета агпегсапа),Тест заключался в применении растворов, подвергаемых испытаниям, как было указано в примере 1, в область торакса с использованием одного микролитра раствора носителя на одно насекомое. В каждом случае тараканы также подвергались испытаниям после предварительной топической обработки с помощью бутилата пиперонила 25 С. Соединения, подвергаемые испытанию, были очень сильно подвержены воздействию синергетика - бутилата пиперонила с достижением в результате эффективности, аналогичной той, которая была достигнута при испытаниях на домашних мухах, обработанных бутилатом пиперонила, за исключением двух соединений (13 и 38), которые примерно в 10 раз являются более токсичными для домашних мух, чем для тараканов. Другие испытания показали, что соединение б является также токсичным для личинок москита, тли, живущей на черной фасоли, рыжых тараканов, а также клопов,Таким образом, широкий диапазон эффективности нового класса пестицидов, указанных выше, был подтвержден,П р и м е р 3. Опыты с другими синергетиками,Другие синергетики, которые, как известно, являются ингибиторами оксидативной детоксификации, могут быть использованы вместо бутилата пиперонила. Этот факт был подтвержден при испытаниях на домашних мухах при использовании соединения, в котором В представляет собой третичный бутил, а Х представляет собой 4-хлорфенил. Синергетический фактор, достигаемый при использовании бутилата пиперонила в количестве 250 микрограмм/грамм был также достигнут в тех случаях, когда этот синергетик заменяли другим синергетиком: О-(2-метилопропил) О-(2-пропинил) фенилфосфатом при концентрации, равной 125 мкг/г живого веса или синергетиком; О,О-диэтил О-фенил фосфоротилатом при концентрации 50 мкг/г живого веса. В этих испытаниях синергетик и инсектицид были использованы в одно и,то же время с тем, чтобы наиболее близко промоделировать сИтуации, связанные с применением. Эти сИнергетики имеют . относительно низкую стоимость и токсичность для млекопитаю щих, Многие соединения таким образом являются пригодными и дают экономический эффект, поскольку синергетики обеспечиваю улучшение инсектицидной активности трйоксабициклооктанов, применяемых для уничтожения насекомых,П р и м е р 4. Опыты по определению то сичности для млекопитающих.Уровень токсичности для млекопитающ х соединений, соединений формулы 1, бьл определен следующим образом. Эти дв соединения индивидуально растворяли в ливковом масле, и полученный таким обра ом раствор вводили внутрибрюшинно мь шам для определения смертности через 24 ч. Эти соединения представляли собой сл дующее: В 1 - третбутил, Х - циклогексил (с единение 60); В 1 - изопропил, Х - циклоге сил (соединение 59). Значения 50 О лета ьной зоны .05 о при инъекциях длятр тбутильного соединения и изопропильно о соединения составляют соответственно более 200 и более 500 млг/кг живого ве в,Таким образом, является очевидным, чт соединения формулы характеризуются от осительно низкой активностью по отноше ию к млекопитающим и при этом, как пр вила, 50 О/, летальная доза составляет боле 200 млг/кг живого веса, Токсичность по от ошению к млекопитающим может изменя ься в значительной степени в зависимост от типа носителя, способа ввода в ор анизм и вида мйекопитающего.Результаты сравнительных испытаний по взывающие эффективности соединений фо мулы 1.Превосходство триоксабициклооктанов26, 0 и 60 по сравнению с традиционнымиФормула изобретения25 Способ получения 1,4-бис-замещенных2,6,7-триоксабицикло(2,2,2)октанов общейформулы где В 1 - Сз-С 5-алкил с прямой или разветвленной цепью;ф е н ил ил и Сз-Сб-циклоалкил; Х-н.бутил,35 н,пентил, этинил, фенил, хлорфенил, бромфенил, фторфенил, С 5-Сб-циклоалкил,трифторметилфенил, цианофенил, нитрофенил,Из-фенил, 3,4-дйхлорфенил," виклогексенил или 2-бицикло 2,2,1)гептил,40 о т л и ч а ю щ и й с я тем, что триол общейформулыВ-С(СН 2 О Н)з,где В имеет указанные значения,подвергают взаимодействию с ортокарбок 45 силатом общей формулы. Х имеет укаэанныев присутствии кислоты и,взначения, при нагревани инсектицидами такими, как диелдрин, паратион, ДДТ и аллетрин демонстрирует прилагаемая табл.4, Например, при местном нанесении на домашних мух, которых потом5 держат при 25 С, совместно с пипероксилбутоксидом, являк щимся обычным синергистом инсектицидов соединения формулы 1 столь же или более эффективными, чем известные соединения промышленного10 производства. Прилагаются также данные для температуры 11 С, т.к, они могут оказаться полезными в случае конкретной рассматриваемой страны. Данные даны в табл.4,15 Предпочтительный заместитель в позиции 4 зависит от заместителя в позиции 1, например, 4-с-НЕх лучше, чем 4-1-Вц с 1-Рп или 1-(4-гало-Рп)/8, 18,24 и 26 против 6,17, 23 и 25 соответственно/ тогда как 4-1-Вц20 лучше, чем 4-с-Нех с 1-(4-СИ-Рп) и 1 - 3,4 - С 2 - Рп) /30 и 38 против 31 и 39 соответственно/..9 4-Хпорфенил 239-240 240-242 13 Циклогексил 281 Циклогексил 14 Циклогекснл 195-196 275 17 . Фенил 249 158-160 Трет-бутил 275 18фемид 181-183 Циклогексил 143-145 267 19 2-Фторфенил Трет-бутил Трет-бутил 19-166 21 3-Хлорфенил 23 4-ФторфенилТрет-бутил 148-149 267 24 4-Фторфенил 225-228 293 Циклогексил 25 4-Бронфенил. Трет-бутил 196"198 223-225 26 4-Бромфенил Циклогексил 27 4-Сфенил 20 ЭТрет-бутил 28 4-О,Ф 163-166 280 Изопропнп ТаЬпицаХарактерные данные 14-бис-замеыенных"2,С,7-триоксаоицикпо /2.2,2/октановее вета е ва е е ее аваев евваеавееевеетЬеевеевееаваее т етП р и мвчан н е. а) Спектры, полученные при частотах 90 и 300 негагерц для обраэцов, растворенных вдейтерохлорофорне. Объединения соответствуют структурным интерпретациям.в) Кваэимолекулярный ион, полученньй с помощью химической иоииэации при 230 электроновольтах с метаном (08 торр).с) Соединение 65 получено иэ соответствуацей 1 ебромэтил проиээодной с испольэованнем ви.нильной и 1,2-дибронэтильной проиэводных путем последоватевмого дегидробромирования,бронирования и дегидробронирования.(более 500)13(более 500)/5 (более 500)30(более 500)/25(более 500)6,3(375)/4(125)/5,5(более 500)/3(более 500)1,9(более 500)2(более 500)0,83(3,5)/0,4(4)/0,25(6,5)53(более 500)11(более 500)5, 0(более 500)0,23(4,80,65(115)13(160)0,88(4,3)/(5)/2,5(30)18(240)55(450)/50(450)/33(365)14(более 500)/8(более 500)3,5(165)/2(40)/8,5(300) Норм-пропил 4-хлорфенил Изо-пропил 4-хлорфенил Норм-бутил 4-хлорфенил Вторичный бутил 4-хлорфенил Трет-бутил 4-хлорфенил Циклопентил 4-хлорфенил 7 8 9 13 14 17 Циклогексил 4-хлорфенилфенил 4-хлорфенилЦиклогексил циклогексилФенил Циклогексил Трет-бутил Фенил Циклогексил Фенил 19 Трет-бутил 2-фторфенил Трет-бутил 3-хлорфенилТрет-бутил 4-фторфенилЦиклогексил 4-фторфенил .Трет-бутил 4-бромфенилЦиклогексил 4-бромфенил 21 23 24 25 26 Трет-бутил 4-СГ ФенилИзо-пропил 4-ИОдфенилТрет-бутил 4-ИОдфенилТрет-бутил,4-СРтфенилЦиклогексил 4-СИ фенилТрет.-бутил 4-СМ фенилТрет-бутил 3,4-С 1 фенилЦиклогексил 3,4-С 1 ФенилТрет-бутил 2,3,4,5,6-РфенилТрет"бутил Норм-бутил 27.28 29 30 31 32 38 39 43 51 53 59 60 61 Трет-бутил Норм-пентилИзопропил циклогексилТрет-бутил циклогексилИзопропил циклогептил 1112Та блица 2 уничтожение домашней мухи с помощьа 1,4-бис-замещенных 2,6,7-триоксабицикло(2,2.2) октанов (при использовании последних как в чистом виде, так и вместе с синергетикомбутилатом пиперонила) Норма соединений являются указанными условно.) Данные, указанные вне скобок, являются уточненными оценками,в то время, как данные, указанные в скобках, являются первымочевидным . признаком эффективности,Таблица 3ичность топически примененных 1,4-бис-замещенных 2,6,7-триоксабицикло /2.2.2/ октанов по отношению к черным тараканам Ток 1.05 о мкг/г с применением РВ) По меньшей мере 20-кратный синергетический эффект за счет РВ.Таблица 4 Ю 5 о мкг/г с РВ /и без/ Соединение Инсектицид 25 оС Сое инения с положительным темпе а ным коэ и иентом 0,25/6,5/ 0,23/4,8/ 3,5/165/ 0,83/0,65/ 0,43/1,3/ 1,3 1,3 9;5 14 10 26 30 60 ех-С(СНг 0)зС-РЬВ гц-С(СНгО)зС-РЬ-Сйо-С(СНгО)зС-с-НехДиелдрин Па атион Сое инения с от и ательным темпе а ным коэ и иентом 12/14/ 0,32/14/ДДТ лет ин 1 В, агапэ, аБСоставитель И, Дьяченко Техред М.Моргентал Корректор 3. Салко Ред ктор Зак 3 169 Тираж ПодписноеВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР113035, Москва, Ж, Раушская наб., 4/5 Патент", г, Ужгород, ул, Гагарина, 101
СмотретьЗаявка
3966912, 27.09.1985
Дзе Риджентс оф Дзе Юниверсити оф Калифорния
КРИСТОФЕР ДЖ. ПАЛМЕР, ДЖОН Е. КАСИДА
МПК / Метки
МПК: C07D 493/08
Метки: 2)октанов, 4-бис-замещенных2, 7-триоксабицикло
Опубликовано: 30.01.1993
Код ссылки
<a href="https://patents.su/7-1792417-sposob-polucheniya-1-4-bis-zameshhennykh2-6-7-trioksabiciklo-2-2-2oktanov.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения 1, 4-бис-замещенных2, 6, 7-триоксабицикло (2, 2, 2)октанов</a>
Предыдущий патент: Способ получения n -1, 2-цис-2-галогеноциклопропил замещенной пиридонкарбоновой кислоты
Следующий патент: Способ получения аналога соматостатина
Случайный патент: Устройство для моделирования нейтрона