Способ получения электропроводных фермент-ковакторных систем
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
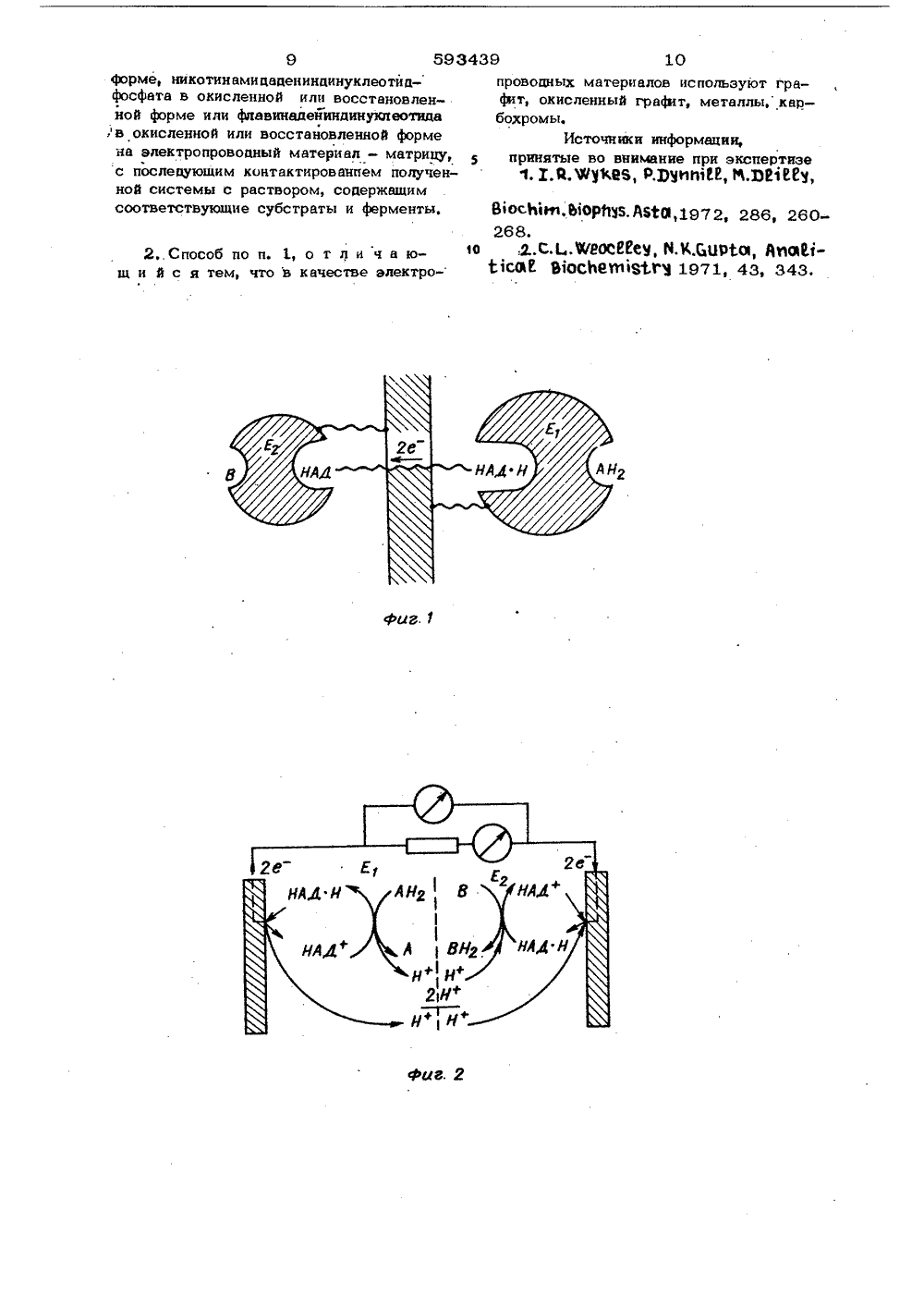
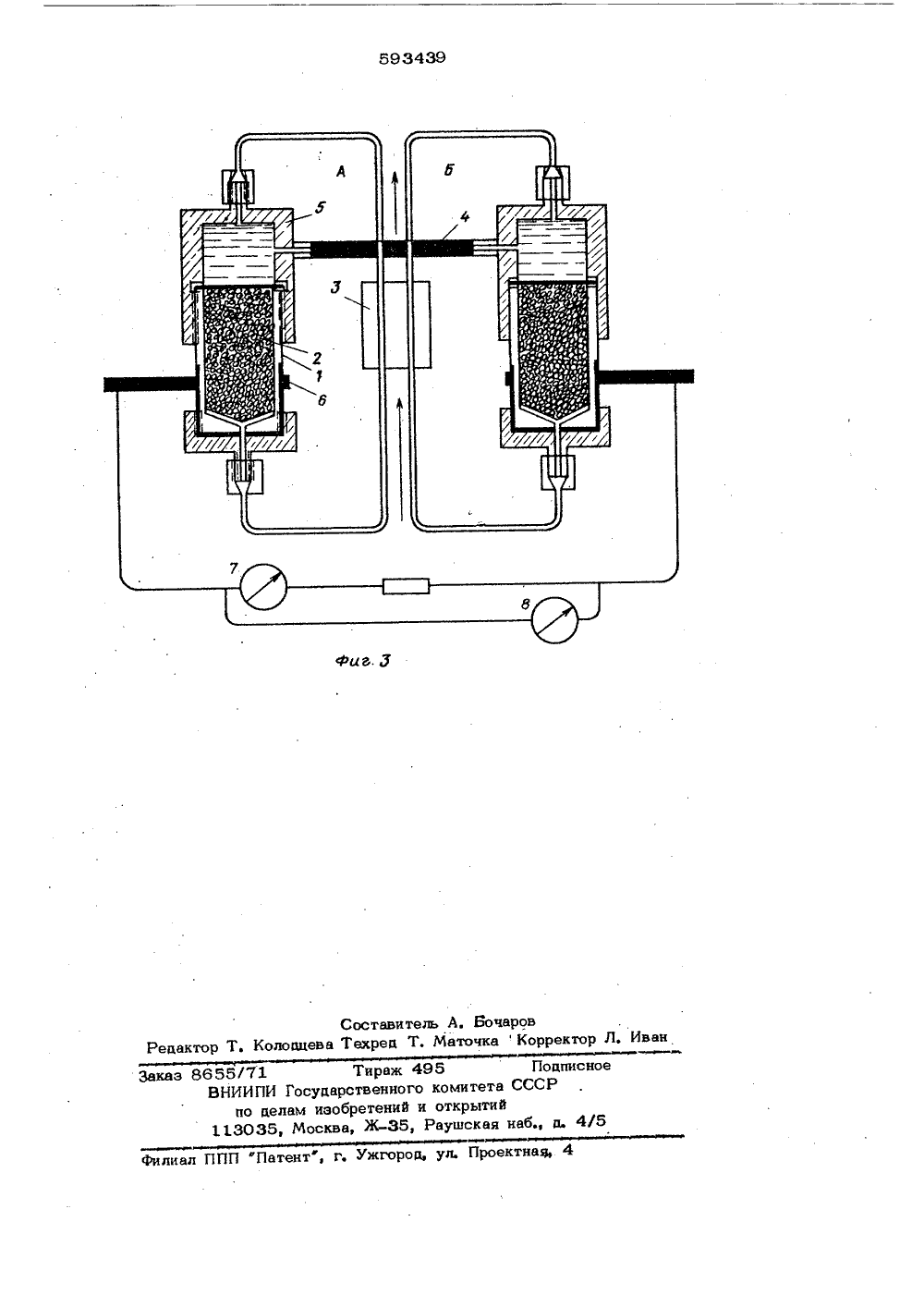
Союз СоветскикСоциалистическихРеспублик ОПИСАНИЕ ИЗОБРЕТЕНИЯ К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ(51)М. Кл. с присоединением заявки ЖС 07 6 7/02 Государственный комитет(53) УД К 577. 15, ,07(088,8) Опубликовано 07, 10,80. Бюллетень37 Дата опубликования описания 10,10,80(72) Авторы изобретения П, П. Гладышев, М, И. Горяев и Й, А. Шаповалов Ордена Трудового Красного Знамени институт химических наук АН Казахской ССР(54) СПОСОБ ПОЛУЧЕНИЯ ЭЛЕКТРОПРОБСДНЫХ ФЕРМЕНТ-КОФАКТОРНЫХ СИСТЕМИзобретение относится к способу получения электропровоаных фермент-кофакторных систем, которые могут найти применение в ферментативных электрохимических реакторах, топливных алемен 5тах и индикаторных электродах.Известен ряа способов полученияиммобилизованных коферментов, Такиесистемы используются в основном дляцелей аминной хроматографии. Известен,тОв частности способ получения кофермента никотинамиаадеииндинуклеотида (НАД)ковалентно связанного с полиэтиленом 33,Это воаорастворимое производное, обла-дающее коферментной активностью со свот 5бодной и связанной с матрицей дегидрогеназой (кофермент может быть,восстановлен до НАДН). Ковалентносвязанное восстановленное производноеНАДН) в свою очередь может бытьокислено с участием лактатдегидрогеназы. Однако полученные ао последнеговремени продукты иммобилизации коферментов на нерастворимых и растворимых неэлектропровоаных полимерах и продуктах неорганической прироаы непригодны аля ис польз ов ан ия их в ферментативных электрохимических реакторах, топливных элементах и индикаторных электродах, вследствие их неспособности обеспечить электропровоаность иммобилизов анной системы.С целью получения ферменткофакторных систем, облаааощих проводниковыми свойствами и способных обеспечить перенос заряда с иммобилизованных кофакторов на электропроводный материал матрицы, а также с целью разработки способа удаления с электропровоаной основы отработанных неактивных веществ и нанесения на нее новых активных компонентов в предлагаемом .способе сорб. цию кофактора производят на различные электропроводные материалы (графит, окисленный графит, металлы, карбохромы). Замена инактивированных в процессе длительной работы кофактора й фермента на новые осуществляется посредст3 5934 вом десорбции в условиях, отличных от тех, в которых работает система - ферментиммобилизоввнный кофермент.Предлагают способ получения электро проводных ферменткофакторных систем путем адсорбции кофакторов - никотинамидадениндинуклеотида в окисленной (НАД) или восстановленной (НАДН) форме, никотинамидааениндинуклеотидфосфата в окисленной (НАДФ) или восстановлен ной (НАДфН) формах или флавинаденин.динуклеотида в окисленной (ФАД) или восстановленной (ФАДН) формах - на различные алектропроводные материалы - графит, окисленный графит, метал лы, карбохромы, с последующим контактированием полученной системы с раствором, содержащим соответствующие субстраты и Ферменты.20Воэможность получения фермент-коФвкторных систем на различных электро. проводных материалах проверена на системе: окисленный графит - НАД- алкогольдегидрогенаэа. Для этого 25 кофермент НАД сорбируют из водного 0,015 М буферного раство 15 а фосфора калия с рН 7,7 на гранулированный графит, который предварительно обрабатывают кипацей концентрированной азот- З 0 ной кислотой в течение 6 ч. Получен-ная таким образом ферменткоферментная систсма прочно удерживается на , алектропроводном метериале - окисленном графите. Система работает в течение 250 ч в условиях работы системы Фермент-кофактор, при атом не наблюдается заметной инактивации активных компонентов. В случае потери активности системы, например, во време ни, осуществляют ее десорбцию водно- спиртовой смесью (3:1) при рН 10 с последующей иммобилизацией активных компонентов.45П р и м е р 1. Иэ исходного раствора восстановленного никотинамидадениндинуклеотида (НАДН) с концентрацией 0,005 моль/л в буферном0,015 М растворе фосфата калия с рН 7,7 берут ликвоту, содержащую26010 г НАДН в 2 мл буферного раствора (количество взятого для сорбции НАДН проверяют спектрофотометрическим методом при 340 ммк в 1 см кювете, учитывая, что коэффициентсветопоглощения для НАДН Е +6,2). Приготовленный раствор кофермента приливают к 0,1 г гранулиро 39 4ванного графита, предварительно окисленного кипяцей концентрированной азотной кислотой в течение 6 ч. Сорбциюкофермента проводят при 5 фС в течение 1 чи периодическом перемешиваиии. Послесорбции графит отделяют от раствораи последний спектрофотометрируют.По разности исходных и конечных количеств НАДНопределяют величинусорбции. Для окисленного графита онасоответствует 62%. Слабо связанный ссорбентом НАДН отмывают буфернымраствором. Количественное определение иммобилизированного нв графите НАДН осуществляют по цинги прин-сернокислотной методике 21, Для этого готовят раствор, содержащий следующие компоненты: 0,15 ммоль/мл буфера фосфатв калия и рН 7,7, 50 мкмоль/мл этвнола, 17 мкмоль/мл лвктальдегидв и 0,16 мг/ мл алкогольдегидрогеназы (все компоненты реакционной смеси смешиваютопрй О С). 0,2 мл полученной смеси приливают в пробирки: со стандартными растворами, содержащими известное количество НАДНд, и с О, 1 г графита ссорбироввнным НАИН ъРеакционные смеси инкубируют в термостате при 37 С в течение 45 мин, после чего графит отделяют от раствора, Ферментативную реакцию останавливают добавлением 1 мл концентрированной серной кислоты в выделенный и стандартные растворы. Растворы тщательно перемешивают и снова инкубируют при 70 ф С в течение 10 мин. Затем реакционную смесь охлаждают до комнатной температуры и при тщательном перемешивании добавляют 40 мкл свежеприготовленного раствора нингидрина (3% нингидрина и 5% бисульфита натрия). Раствор оставляют стоять при комнатной температуре в течение 60 мин, затем в смесь приливают еще 1 мл концентри- рованной серной кислоты и оставляют стоять при комнатной температуре в течение 5 мин, Оптическую плотность раствора замеряют при 595 ммк. Количество сорбированного кофермента определяют по калибровочной кривой в зависимости от величины оптической плотности, Получают количественное значение сорбированного НАДН, проявляющего физиологическую активность ь иммобилизоввнном состоянии. Оно равно 74% от общего количества кофермента, сорбированного на графит.51 О152 О 5 593Многократные опыты по определению активности иммобилизованного на окис- ленную поверхность графита кофермента дают стабильноедают стабильные результаты.П р и м е р 2. К 100 мг карбохрома приливают 2,5 мл 0,002 М раствора НАДФН, содержащего 0,015 М буферный раствор фосфата калия с рН 7,8, Количественную оценку содержания НАДФН осуществляют спектрофотометрическим методом при 340 ммк в 1 см кварцевой кювете. Коэффициент светопоглощения для НАДФН равен Е.о= 6,310 Сорбцию проводят в течение 2,5 ч при 5 С, раствор затем отделяют центрифугированием и спектрофотометрируют, По разности исходных и конечных количеств НАДФН определяют величину сорбции, На карбохроме сорбция НАДФН составляет 4,8 мг на 1 г сорбента Много - кратное промывание сорбента 0,0 15 М буферным раствором с рН 7,8 и последующее с пектрофотометрирование промывных вод свидетельствует о стабильности иммобилизованной системы. Сорбцпю коферментов НАДН И ФАД на карбохроме проводят аналогичным путем. Разница лишь в том, что для ФАД в качестве буферного раствора используют 0,1 М раствор фосфата калия с рН 7,0. Коэффициент светопоглощения для ФАД Етого= 253 10, Сорбцпя ФАД наЪкарбохроме составляла 1;2 мг/г, НАДН 35 3,1 мг/г.П р и м е р 3. К 100 мг окисленного графита. приливают 2,5 мл 0,0032 М раствора ФАД, содержащего 0,1 М буферный раствор фосфата калия с рН 70.4 О Количество ФАД определяют спектрофотометрическп по максимуму поглощения в области 260 ммк. Анализ выполняют . в 1 см кварцевой кювете. Еб25,3Ъ10 . Сорбцию проводят в течение 2,5 ч гри 5 э С, затем раствор фильтруют : центрифугированием. По количеству ФАД до и после сорбции судят о ее величине, На 1 г окисленного графита сорбируется 21 мг ФАД. Промывание сорбента 0,1 М буферным раствором с рН 7,0 и последующий анализ промывных вод свидетельствует о стабильности полученной системы.Аналогично проводят сорбцию НАДФН на окисленном графите, Для этого используют 0,015 МФосфатный буферный раствор с рН 78, Количественную оценку сорбции осуществляют спектрофотометрически по максимуму поглощения при 340 ммк.Е у р= 6,310 . Найдено, что сорбцияНАДФН на окисленном графите составляет7,8 мг на 1 г сорбента.П р и м е р 4. 2,5 мл О 002 М раствора НАДФН в 0,0 1 5 М раствора фосфата калия с рН 7,8 приливают к 100 мгплатиновой черни. Сорбцию проводятЬ течение 2,5 ч при 5 С. Затемлорошок отделяютот раствора центрифугированием. Раствор спектрофотометрируюти определяют количество сорбированного НАДФН, На платиновой черни сорбируются 4,4 мг НАДФН на 1 г сорбента. Многократное промывание буфернымраствором сорбента с иммобилизованнымНАДФН показывает стабильность системы,Аналогично проводят сорбцию коферментов НАДН и ФАД на платиновойчерни. Величина сорбции НАДН 3,6 мг/г,ФАД 2,6 мг/г,Сорбция рассматриваемых коферментов на графите незначительна ( в пределах О, 1-0,5 мг на 1 г). Восстановленные и окисленные формы коферментов сорбируются одинаково,П р и м е р 5. С целью доказательства способности фермент-кофакторной системы обеспечивать перенос заряда на электропроводный материал матрицы использован биологический топливный элемент, в котором ЗДС возникает за счет сопряженной ферментативной окислительно-восстановительной реакции. Перенос заряда в элементе достигается за счет того, что в качестве катализатора используется иммобилизованный на электропроводной основе фермент-кофакторный комплекс. В этом случае фермент и его кофактор являются частью электрода, на котором происходит непосредственный перенос заряда с материала электрода вактивные центры ферментов.На фиг. 1 приведена схема реконструированной НАД-зависимой ферментативной системы где Е и Е - иммобилизованные ферменты, АН и В - продукты скис, ления и восстановлениц.на фиг. 2 - механизм работы двухэлектродной системы,построенной по указанному принципу;на фиг. 3 - схема топливного элемента.Чтобы исключить возможность протекания побочных процессов, используется симметричная система из эквивалентных полу- элементов с одним и тем же НАД-зави59343симым ферментом и фоновым электролитом, В качестве модельной ферментативной системы выбрана алкогольдегидрогеназа(АДГ) в сочетании с никотинамидадениндинуклеотидом (НАД), Ферменткофакторная система получена иммобилиэацией на электропроводной матрице. Вкачестве электролита используют 0,015М фосфатиый буфер с рН 7,7 на фоне0,5 М раствора хлорида натрияе Электро 10химические исследования проводят в. микроячейках, изготовленных из полиметилметвкрилата и фторопласта. В одномиз полуалементов проходит окислениеспирта до ацетальдегида, и другом - 15восстановление лактальдегида до 1,2 -пропандиола, В результате алектрохимического сопряжения указанных процессовв системе возникает ЭДС. При замыкании полуалементов через нагрузку в 20системе генерируется устойчивый ток.Биологический топливный алемент,работающий по предлагаемому способу,в котором используется иммобилизованная на алектропроводном носителе фермент-кофакторная система, имеет рядпреимушеств; исключается стадия диффузии компонентов в объему раствора,а также перенос кофактора междуэлектродом и ферментом, лимитирующиеокислительно-восстановительную реакцию; и обеспечивается эффективный переносзаряда с кофермента на матрицу электрода; появляется возможность распространения этого принципа на многие фермент-кофакторные системы, что позволяет использовать в топливных алементах самыеразнообразные субстраты в качестветоплива и окислителя.Топливный элемент состоит из симмет ричных аквивалентных камер А и Б. Графитовый электропроводный корпус 1 камерзаполняется гранулиров анным окисленнымграфитом 2 с сорбированной ферменткофакторной системой. В целях аффективной подачи продуктов в зону реакции иудаления отработанных веществ проводятрециркуляцию растворов в камерах А иБ. Рециркуляцию субстратов осуществляютс помощью перестальтического насоса 3,Электрическая схема топливного элерймента состоит иэ алектролитического мостика 4, заполненного сефадексом Г 150в 0,015 М буферном растворе фосФата1 держащим 0 5 1 1 яраствор хлорида натрияа Для аффективного снятия заряда к омеаненной снаружиповерхности 5 графитового корпуса 1топливно о элемента лрипаан контакт 6. 9 8Для контроля тока .и напряжения,возникающего в результате ферментативных окислительно-восстановительных, процессов, используются микроамперметр7 и милливольтметр 8.В качестве модели выбрана НАД-зависимая фермент-кофакторная система.Она создается сорбцией НАДН наокисленном графите в растворе 0,015 Мбуферного раствора фосфата калия срН 7,7 и последующей иммобилиэациейферментаалкогольдегидрогенаэы (АДГ),В предлагаемой системе фермент АДГучаствует как в окислении этилового спирта до ацетальдегида, так и в восстановлении лактальдегида в 1,2-пропандиол.Камера А биологического топливного элемента, в которой идет окисление спиртапо схемеСН ОНСН СНО + 2 Н, содержит 1 М растворатилового спирта в 0,015 М фосфатномбуферном растворе с рН 7,7 на фоне 0,5М раствора хлорида натрия. Спирт, окисляясь, отдает .два электрона, которыепосредством фермента по сопряженнойиммобилизированной электропроводнойцепи, включающей кофактор, переносятся вкамеру БНАДНф НАД + Н, (камера А - генерация восстановленной формыкофактора)(камера Б - генераппя окпспенной Пармыкофактора) и затем принимают участиев восстановлении лактальдегида в 1,2 пропандиол СН СН (ОН) СН + 2 Не не СНй СН (ОН) СНйОН,В камере Б нспопьеуется 0,03 М раствор лактальдегида в фосфатном буферномрастворе на фоне 0,5 М хлорида натрия.Опыты показывают, что реконструированная ферментативная система можетэксплуатироваться в течение длительного времени беэ потери каталитической Ек-тивности. Увеличение скорости рециркуляции субстратов приводит к значительному воэростанию тока, что обусловленоинтенсификацией транспорта субстрата кферментативной системе. формула изобретения 1. Способ получения электропроводных фермент-кофакторных систем, о т л и ч аю,щ и й с я тем, что производят адсорбцию кофакторов-никотинамидадениндинуклеотида в окисленной или восстановленной9 593439 форме, никотинамидадениндинуклеотидфосфата в окисленной или восстановленной форме или фпавинадейиндинуклеотида ,в окисленной или восстановленной форме на электропроводный материал - матрицу, с последующим контактированпем полученной системы с раствором, содержащим соответствующие субстраты и ферменты,2,. Способ по и. 1, о т л и ч а ющ и й с я тем, что в качестве электро проводных материалов используют графит, окисленный графит, металлы, карбохромы.Источники информации,принятые во внимание при экспертизе593439 и Составитель А. Бочаровдактор Т. Колодцева Техред Т. МаточкаКорректор Л. Иван одписСР б.,лиал ППП "Патент", г, Ужгород, ул. Проектна Заказ 8655/71 ВНИИ ПИ по де 1 13035Тираж 498осударственного комитета См изобретений и открытийМосква, Ж-ЗВ, Раушская н
СмотретьЗаявка
2163635, 04.08.1975
ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ ИНСТИТУТ ХИМИЧЕСКИХ НАУК АН КАЗАХСКОЙ ССР
ГЛАДЫШЕВ П. П, ГОРЯЕВ М. И, ШАПОВАЛОВ Ю. А
МПК / Метки
МПК: C07G 7/02
Метки: систем, фермент-ковакторных, электропроводных
Опубликовано: 07.10.1980
Код ссылки
<a href="https://patents.su/6-593439-sposob-polucheniya-ehlektroprovodnykh-ferment-kovaktornykh-sistem.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения электропроводных фермент-ковакторных систем</a>
Предыдущий патент: Ионизационная 4 -камера
Следующий патент: Делитель напряжения
Случайный патент: Антистатическая композиция на основе термопластического полимера