1s, 3r-2, 2-диметил-3-(2-метил-2-оксипропил) циклопропанкарбонитрил в качестве промежуточного соединения в синтезе пиретроидного инсектицида-дельтаметрина и способ получения промежуточного соединения
Формула | Описание | Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 1679761
Авторы: Рукавишников, Ткачев
Формула
1S,3R-2,2-ДИМЕТИЛ-3-(2-МЕТИЛ-2-ОКСИПРОПИЛ)ЦИКЛОПРОПАНКАРБОНИТРИЛ В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ В СИНТЕЗЕ ПИРЕТРОИДНОГО ИНСЕКТИЦИДА-ДЕЛЬТАМЕТРИНА И СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ.
1. IS, 3R-2,2-Диметил-3-(2-метил-2-оксипропил)циклопропанкарбонитрил формулы I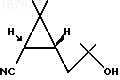
в качестве промежуточного соединения в синтезе пиретроидного инсектицида дельтаметрина.
2. Способ получения IS, 3R-2,2-диметил-3-(2-метил-2-оксипропил)циклопропанкарбонитрила формулы I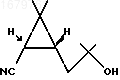
отличающийся тем, что кетонитрил формулы II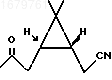
обрабатывают трет-бутилнитритом в метанольном растворе метилата натрия при нагревании при молярном соотношении кетонитрил: третбутилнитрит: метилат натрия, равном 1 : 1 : 1,2, полученный при этом оксим формулы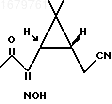
обрабатывают пятихлористым фосфором при охлаждении до 0 - плюс 5oС, образовавшийся при этом соответствующий динитрил формулы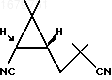
обрабатывают избытком хлористого водорода в метанольном растворе при комнатной температуре с получением эфира формулы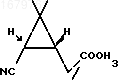
который обрабатывают метилмагнийиодидом, полученным in situ.
Описание
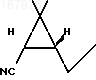
Целью изобретения является изыскание нового оксициклопропанкарбонитрила для синтеза пиретроидного инсектицида-дельтаметрина - и разработка нового способа получения промежуточного соединения I, который осуществляют по более простой технологии по сравнению со способом получения известного промежуточного соединения для синтеза дельтаметрина.
П р и м е р 1. Получение кетонитрила из 3-карена.
10 г (+)-3-карена, выделенного при ректификации соснового скипидара и имеющего [
 в виде желтоватого масла, кристаллизующегося при стоянии. Перекристаллизация из метанола дает аналитический образец с т.пл. 118оС и [
в виде желтоватого масла, кристаллизующегося при стоянии. Перекристаллизация из метанола дает аналитический образец с т.пл. 118оС и [ К раствору 6 г указанного аминооксима в 40 мл хлороформа добавляют 3 г измельченного карбоната натрия и при интенсивном перемешивании при комнатной температуре по каплям прибавляют 4 мл уксусного ангидрида. После прибавления всего количества уксусного ангидрида реакционную смесь выдерживают при перемешивании около 1 ч, после чего фильтруют, фильтрат упаривают в вакууме водоструйного насоса на водяной бане, остаток нагревают в вакууме (остаточное давление 5 мм рт.ст., температура бани 100оС) в течение получаса для удаления диметилацетамина и получают 4,5 г (выход 96%) в расчете на аминооксим и 81% в расчете на 3-карен кетонитрила формулы
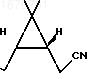
П р и м е р 2. Получение оксинитрила (I) из кетонитрила (II).
К раствору 20 г указанного кетонитрила прибавляют 12,6 г трет-бутилнитрита и 50 мл 3М раствора метилата натрия, реакционную массу нагревают до 50оС и оставляют самопроизвольно охлаждаться. Через 15 ч метанол упаривают в вакууме при температуре бани не выше 60оС. К остатку прибавляют 100 мл воды и экстрагируют эфиром (2 х 30 мл). Водную фазу подкисляют 1М раствором соляной кислоты до рН 1-2 и экстрагируют продукт эфиром (50, 30 мл). Объединенный эфирный экстракт промывают насыщенным раствором хлористого натрия, сушат безводным сульфатом магния и после удаления растворителя получают 21 г оксима формулы
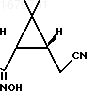 в виде бурого вязкого масла, кристаллизующегося при стоянии. Аналитический образец получают перекристаллизацией сырого продукта из эфира - гексана, т.пл. 87оС.
в виде бурого вязкого масла, кристаллизующегося при стоянии. Аналитический образец получают перекристаллизацией сырого продукта из эфира - гексана, т.пл. 87оС.Найдено, %: С 61,8; Н 7,3; N 14,4.
С10Н15N2O
Вычислено, %: С 62,0; Н 7,3; N 14,5.
ИК (ССl4): 3570, 3340, 2260, 1700 см-1.
ЯМР - 1Н (СДСl3): 0,89, 1,26, 2,34 с по 3Н.
ЯМР - 13С (СДСl3): 23,24 д, 155,20 с, 197,95 с, 119,31 с, 15,53 т, 23,24 д, 18,85 с, 26,78 к, 16,02 к, 26,56 к.
Масс-спектр, m/z (% ): 177(11), 154(12), 135(12), 108(10), 194(12), 85(13), 83(18), 43(100).
[
Указанный сырой оксим в количестве 17,88 г растворяют в 80 мл хлористого метилена и при перемешивании и охлаждении реакционного сосуда в бане со льдом прибавляют 19,3 г пятихлористого фосфора небольшими порциями в течение 20 мин. Полученный раствор разлагают 60 г льда, отделяют водную фазу, органический слой промывают 0,5 н. раствором карбоната натрия, затем насыщенным раствором хлористого натрия, высушивают безводным сульфатом натрия и после упаривания растворителя получают 12,74 г динитрила формулы
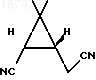 в виде темноокрашенного подвижного масла, кристаллизующегося при стоянии. Аналитический образец получают перегонкой сырого продукта в вакууме (т.кип. 80-90оС (5 мм рт.ст.) с последующей перекристаллизацией из этилацетата, т.пл. 63оС.
в виде темноокрашенного подвижного масла, кристаллизующегося при стоянии. Аналитический образец получают перегонкой сырого продукта в вакууме (т.кип. 80-90оС (5 мм рт.ст.) с последующей перекристаллизацией из этилацетата, т.пл. 63оС.Найдено, %: С 72,1; Н 7,8; N 21,2.
С8Н10N2
Вычислено, %: С 71,6; Н 7,5; N 20,9.
ИК (ССl4): 2260, 2240 см-1.
ЯМР - 1Н (ССl4): 1,21, 1,27 с по 3Н; 1,34-1,76 м, 2Н; 2,26-2,76 м, 2Н.
ЯМР - 13С (СДСl3): 14,30 д, 117,11 с, 117,03 с, 14,23 т, 24,64 д, 23,30 с, 25,29 к, 15,44 к.
Масс-спектр, m/z (%): 134(42), 133(38), 94(100), 67(67), 41(28).
[
Сырой динитрил в количестве 6,67 г растворяют в 40 мл метанола и при охлаждении на водяной бане насыщают раствор сухим хлористым водородом. Реакционную массу оставляют на ночь при комнатной температуре, после чего сливают жидкость с выпавших кристаллов и упаривают метанол в вакууме водоструйного насоса при температуре бани не более 50оС. Остаток объединяют с полученными ранее кристаллами и размешивают с 30 мл воды. После выдерживания реакционной смеси в течение 20 мин при комнатной температуре продукты реакции экстрагируют 50 мл эфира, водный слой насыщают твердым хлористым натрием и повторно экстрагируют эфиром (2 х 30 мл). Объединенный экстракт промывают насыщенным раствором хлористого натрия, высушивают безводным сульфатом магния и упаривают. Остаток перколируют на силикагеле (элюент - диэтиловый эфир/петролейный эфир 1:1). После упаривания элюата получают 4,58 г эфира формулы
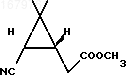 в виде светло-желтого масла. Аналитический образец получают перегонкой сырого продукта (т.кип. 100-110оС/5 мм рт.ст.) и последующим хроматографированием на силикагеле (элюент - диэтиловый эфир/петролейный эфир 1:1).
в виде светло-желтого масла. Аналитический образец получают перегонкой сырого продукта (т.кип. 100-110оС/5 мм рт.ст.) и последующим хроматографированием на силикагеле (элюент - диэтиловый эфир/петролейный эфир 1:1).Найдено, %: С 62,5; Н 7,6; N 7,9.
С9Н13NO2
Вычислено, %: С 64,6; Н 7,9; N 8,4.
ИК (ССl4): 2240, 1740, 1180-1200 см-1.
ЯМР - iН (ССl4): 1,26 с, 6Н; 2,31-2,57 м, 2Н; 3,66 с, 3Н.
ЯМР - 13С (СДСl3): 14,16 д, 118,04 с, 171,36 с, 30,32 т, 25,11 д, 22,94 с, 25,84 к, 15,93 к.
Масс-спектр, m/z (%): 167(3), 135(60), 108(60), 107(100), 94(50).
[
Указанный сырой эфир в количестве 1,5 г растворяют в 10 мл абсолютного эфира. Полученный раствор прибавляют по каплям при перемешивании к 30 мл 1М раствора реактива Гриньяра. Смесь перемешивают 4 ч при комнатной температуре, после чего прибавляют 20 мл воды. После разложения избытка реактива Гриньяра к смеси прибавляют 30 мл 1М раствора соляной кислоты, перемешивают до растворения осадка и отделяют эфирный слой. Водный слой насыщают твердым хлористым натрием и экстрагируют эфиром. Объединенный эфирный экстракт промывают насыщенным раствором хлористого натрия, высушивают безводным сульфатом магния и после упаривания растворителя получают 1,47 г оксинитрила формулы I в виде желтоватого масла. Выход продукта I в расчете на кетонитрил 49%.
Аналитический образец оксинитрила (I) получают хроматографированием сырого продукта на силикагеле (элюент - диэтиловый эфир).
Найдено, %: С 71,0; Н 10,1; N 8,1.
С10Н17NO
Вычислено, %: С 71,8; Н 10,3; N 8,4.
ИК (ССl4): 3620, 2240 см-1.
ЯМР - 1Н (СДСl3): 1,17 с, 6Н; 1,22, 1,26 с, по 3Н; 1,57 д, 2Н; 2,62 с, 1Н.
ЯМР - 13С (СДСl3): 26,35 д, 38,90 т, 70,45 с, 119,29 с, 14,24 д, 23,05 с, 26,40 к, 16,59 к, 29,17 к, 28,79 к.
Масс-спектр, m/z (%): 92(27), 82(30), 59(100), 56(21), 43(53), 41(22).
[
П р и м е р 3. Получение лактона формулы
O
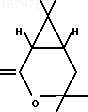 из оксинитрила формулы I.
из оксинитрила формулы I.К раствору 0,16 г оксинитрила (сырой продукт из примера 2) в 2 мл этанола прибавляют раствор 0,75 г едкого кали в 2 мл воды. Смесь кипятят с обратным холодильником 24 ч, после чего подкисляют 1М раствором соляной кислоты до рН 1-2, насыщают твердым хлористым натрием и экстрагируют эфиром (2 х 30 мл). Объединенный экстракт упаривают, к остатку прибавляют 10 мл 10% -ного раствора едкого кали. Щелочной раствор промывают эфиром (2 х 10 мл), подкисляют 1М раствором соляной кислоты и экстрагируют эфиром (3 х 20 мл). Эфирный экстракт сушат безводным сульфатом магния и упаривают растворитель. Остаток растворяют в 3 мл бензола, прибавляют 0,05 г n-толуолсульфокислоты и кипятят смесь 1 ч с обратным холодильником, после чего промывают 2 мл 0,5 н. раствора карбоната натрия, высушивают безводным сульфатом магния и после упаривания растворителя получают 0,11 г лактона, кристаллизующегося при стоянии. Выход указанного лактона (исходного для получения дельтаметрина) в расчете на оксинитрил (I) 68%. Для получения аналитического образца лактон перекристаллизовы- вают из эфира/гексана, т.пл. 83оС.
Найдено, %: С 71,4; Н 9,93.
С10Н16O2
Вычислено, %: С 71,4; Н 10,6.
ИК (ССl4): 1730, 1270, 1200 см-1.
ЯМР - 1Н (ССl4): 1,06, 1,21, 1,42, 1,32 с, по 3Н.
ЯМР - 13С (ССl4-CДСl3): 21,91 д, 29,38 т, 81,93 с, 169,10 с, 23,60 д, 25,03 с, 28,14 к, 15,21 к, 26,31 к, 26,63 к.
Масс-спектр, m/z (% ): 168(18), 124(37), 110(63), 109(100), 95(81), 67(77), 43(64).
[
П р и м е р 4. Получение указанного лактона из известного промежуточного соединения.
К раствору 1,55 г диола* формулы
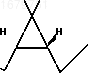 OH в 15 мл ацетона при 10оС по каплям при перемешивании прибавляют 5 мл реагента Джонса (133,5 г хромового ангидрида, 115 мл концентрированной серной кислоты и 200 мл воды). Смесь перемешивают 2 ч, после чего разлагают избыток реагента изопропиловым спиртом. Смесь разбавляют 25 мл воды и экстрагируют эфиром (25,10, 10 мл). Остаток после упаривания эфирного экстракта нагревают с 10 мл 10%-ного раствора едкого натра на водяной бане в течение 30 мин, разбавляют 10 мл воды и экстрагируют эфиром (2 х 15 мл). Водный раствор подкисляют 10%-ной серной кислотой (6 мл) и экстрагируют толуолом (15, 10, 10, 10 мл). К экстракту прибавляют 50 мг n-толуолсульфокислоты и кипятят смесь 1 ч, используя насадку Дина-Старка. Раствор охлаждают, промывают 10 мл 10%-ного раствора карбоната натрия, затем насыщенным раствором хлористого натрия, высушивают безводным сульфатом натрия и после упаривания растворителя получают 1,32 г указанного лактона, который перекристаллизовывают из петролейного эфира. Выход лактона после перекристаллизации 0,95 г (70%).
OH в 15 мл ацетона при 10оС по каплям при перемешивании прибавляют 5 мл реагента Джонса (133,5 г хромового ангидрида, 115 мл концентрированной серной кислоты и 200 мл воды). Смесь перемешивают 2 ч, после чего разлагают избыток реагента изопропиловым спиртом. Смесь разбавляют 25 мл воды и экстрагируют эфиром (25,10, 10 мл). Остаток после упаривания эфирного экстракта нагревают с 10 мл 10%-ного раствора едкого натра на водяной бане в течение 30 мин, разбавляют 10 мл воды и экстрагируют эфиром (2 х 15 мл). Водный раствор подкисляют 10%-ной серной кислотой (6 мл) и экстрагируют толуолом (15, 10, 10, 10 мл). К экстракту прибавляют 50 мг n-толуолсульфокислоты и кипятят смесь 1 ч, используя насадку Дина-Старка. Раствор охлаждают, промывают 10 мл 10%-ного раствора карбоната натрия, затем насыщенным раствором хлористого натрия, высушивают безводным сульфатом натрия и после упаривания растворителя получают 1,32 г указанного лактона, который перекристаллизовывают из петролейного эфира. Выход лактона после перекристаллизации 0,95 г (70%).П р и м е р 5. Получение дельтаметрина из указанного лактона осуществляют по следующей схеме:
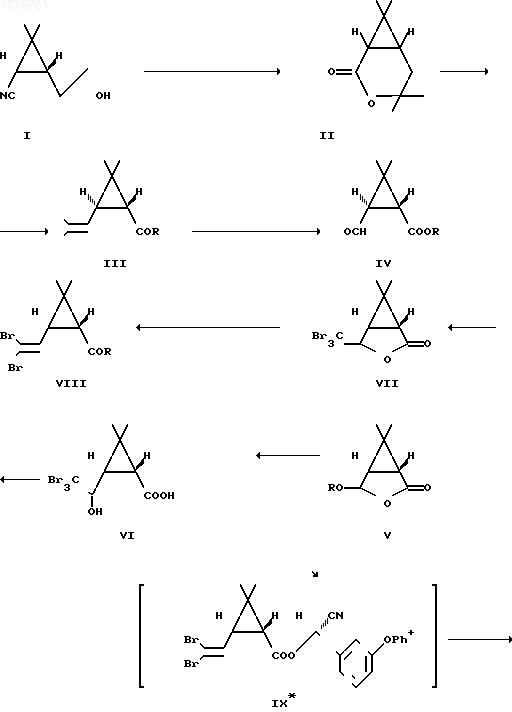
Смесь 208 мг лактона (II), 218 мг едкого натра и 10 мл диэтиленгликоля кипятят 15 мин, затем отгоняют 7 мл растворителя и нагревают 5 ч при 230оС. Реакционную массу охлаждают до комнатной температуры, разбавляют 15 мл воды и экстрагируют 10 мл эфира. К водному раствору прибавляют 2,5 мл 10%-ной серной кислоты и экстрагируют эфиром (3 х 10 мл). Экстракт промывают насыщенным раствором соли (4 х 10 мл), высушивают безводным сульфатом натрия и после упаривания растворителя получают 182 мг хризантемовой кислоты (III, R=OH), которую перколируют на силикагеле (элюент: 0,2%-ная уксусная кислота в бензоле). Выход кислоты после перколяции 130 мг (63%).
К раствору 73,5 г хризантемовой кислоты (III, R=OH) в 140 мл петролейного эфира добавляют 35 мл хлористого тионила и выдерживают в течение ночи при комнатной температуре. После удаления растворителя и избытка хлористого тионила выделяют 80 г хлорангидрида кислоты (III, R=Cl), который растворяют в 80 мл петролейного эфира. К полученному раствору прибавляют 65 мл пиридина и 55 мл метанола. Из реакционной смеси после удаления пиридина и упаривания растворителя выделяют 75,6 г метилового эфира (III, R=OCH3).
В раствор 70 г эфира (III, R=OCH3) в 700 мл метанола, охлажденный до минус 80оС, пропускают ток озона в течение 3,5 ч, после чего прибавляют 79 мл диметилсульфида. Растворитель удаляют в вакууме, остаток (75,9 г) растворяют в 560 мл 30%-ной уксусной кислоты, выдерживают раствор 15 мин при 80оС и после подщелачивания раствора экстрагируют 53,5 г альдегида (IV, R= CH3), 57,2 г альдегида (IV, R=CH3) обрабатывают раствором 16,9 г натрия в 570 мл метанола и выделяют 52,4 г лактона (V, R=CH3), который кипятят 2 ч в смеси 260 мл воды и 130 мл диоксана, после чего получают 25 г карональдегида (V, R=H). Выход карональдегида (V, R=H) в расчете на хризантемовую кислоту (III, R=OH) составляет 40%.
К раствору 36,8 г карональдегида в смеси 135 мл тетрагидрофурана и 27 мл бромоформа при минус 10оС прикапывают 90 мл 30%-ного раствора едкого кали в метаноле за 1 ч. Смесь перемешивают 2 ч при минус 10оС, после чего прибавляют 200 мл воды и перемешивают еще 0,5 с при 25оС. Растворители упаривают, водный раствор подкисляют 15%-ным раствором соляной кислоты. Выпавший осадок отфильтровывают, промывают водой и после высушивания получают 68,5 г (86%) кислоты (VI), которую обработкой n-толуолсульфокислотой в бензоле переводят в соответствующий лактон (VII) с выходом 95%. Полученный лактон (VII) в количестве 56,6 г растворяют в 400 мл сухого эфира, приливают 330 мл уксусной кислоты и при перемешивании прибавляют порциями 118 г цинковой пыли. Смесь перемешивают 2,5 ч при 25оС, после чего отфильтровывают. Фильтрат упаривают, остаток разбавляют водой, высушивают и перекристаллизовывают из изопропанола. Получают 36 г (80%) дельтаметриновой кислоты (VIII, R=OH). Выход полученной таким способом дельтаметриновой кислоты 65% в расчете на карональдегид (V, R=H).
К раствору 29,8 г дельтаметриновой кислоты (VIII, R=OH) в 250 мл эфира прибавляют при 0оС 5 капель диметилформамида и 17,9 г хлористого тионила. После удаления растворителя получают 31 г (98%) хлорангидрида (VIII, R=Cl).
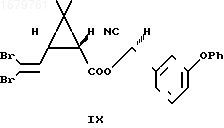
В колбу, содержащую 10 мл н-гептана, 1 мл воды, 1,98 г феноксибензальдегида, 22 мл диазабицикло (2,2,2)октана и 0,59 г цианида натрия добавляют при 20оС раствор хлорангидрида дельтаметриновой кислоты в 10 мл н-гептана, перемешивают 2 ч и отфильтровывают выделившийся осадок. Осадок на фильтре промывают 30 мл эфира, фильтрат высушивают сульфатом магния и после упаривания растворителя выделяют 4,4 г (96%) эфира в виде смеси двух диастереомеров (IX*) и (IX).
В 1200 мл изопроплового спирта растворяют 600 г смеси диастереомеров (IX*) и (IX), прибавляют к раствору 90 мл водного аммиака, охлаждают смесь до 0оС и перемешивают 48 ч при 0оС. Смесь фильтруют, осадок на фильтре промывают 300 мл изопропилового спирта, охлажденного до минус 20оС, и получают после высушивания 485 г дельтаметрина (81%).
Таким образом, целевой оксинитрил формулы I получают с выходом 40% в расчете на 3-карен, в то время как известное промежуточное соединение - диол формулы
HO
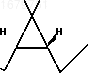
Это позволяет получать дельтаметрин с выходом 4,3% в расчете на 3-карен при использовании предлагаемого промежуточного соединения. При использовании известного промежуточного соединения выход дельтаметрина 1,8%.
Кроме того, способ получения известного промежуточного соединения требует использования взрывоопасной 90%-ной перекиси водорода, длительности процесса и хромсодержащего окислителя, что ведет к образованию хромсодержащих стоков.
Изобретение касается замещенных нитрилов, в частности получения 1S, 3R-2,2-диметил-3-(2-метил-2-оксипропил)циклопропанкарбонитрила в качестве промежуточного вещества в синтезе пиретроидного дельтаметрина. Цель - создание нового способа получения нового полупродукта. Синтез ведут обработкой кетонитрила трет-бутилнитрилом в метанольном растворе метилата натрия при нагревании и молярном соотношении исходных веществ 1 : 1 : 1,2 с последующим добавлением PCl5 при 0 - 5°С, затем избытка HCl в метанольном растворе при комнатной температуре и далее метилмагнийиодида, полученного in situ. Эти условия обеспечивают получение целевого продукта с лучшим выходом (40 против 17% ) без необходимости использования 90%-ной перекиси водорода и хромсодержащего окислителя, образующих хромсодержащие стоки. Дельтаметрие в расчете на 3-карен получают с выходом 4,3 против 1,8%. 2 с.п. ф-лы.
Заявка
4772962/04, 25.12.1989
Новосибирский институт органической химии СО АН СССР
Рукавишников А. В, Ткачев А. В
МПК / Метки
МПК: C07C 253/30, C07C 255/48
Метки: 2-диметил-3-(2-метил-2-оксипропил, 3r-2, инсектицида-дельтаметрина, качестве, пиретроидного, промежуточного, синтезе, соединения, циклопропанкарбонитрил
Опубликовано: 09.02.1995
Код ссылки
<a href="https://patents.su/1-1679761-1s-3r-2-2-dimetil-3-2-metil-2-oksipropil-ciklopropankarbonitril-v-kachestve-promezhutochnogo-soedineniya-v-sinteze-piretroidnogo-insekticida-deltametrina-i-sposob-polucheniya-prome.html" target="_blank" rel="follow" title="База патентов СССР">1s, 3r-2, 2-диметил-3-(2-метил-2-оксипропил) циклопропанкарбонитрил в качестве промежуточного соединения в синтезе пиретроидного инсектицида-дельтаметрина и способ получения промежуточного соединения</a>
Предыдущий патент: Устройство для нанесения покрытия на внутреннюю поверхность трубопровода
Следующий патент: Волновой движитель транспортного средства
Случайный патент: Фрикционный вариатор





