Биоспецифический сорбент для выделения l-аспарагиназы из клеток e. coli и способ выделения l-аспарагиназы с применением этого сорбента
Формула | Описание | Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Формула
1. Биоспецифический сорбент общей формулы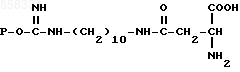
где P остаток агарозы,
для выделения L-аспарагиназы из клеток E.coli.
2. Способ выделения L-аспарагиназы из клеток E.coli аффинной хроматографией путем сорбции на биоспецифическом сорбенте с последующей промывкой сорбента буферным раствором и элюированием фермента, отличающийся тем, что, с целью повышения активности целевого продукта, в качестве биоспецифического сорбента используют соединение общей формулы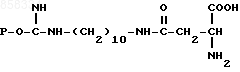
где P остаток агарозы,
и элюирование фермента ведут 0,02 0,03 М раствором L-аспарагина в 0,05 0,1 М фосфатном буферном растворе при рН 7,0 8,0.
Описание
P-O-
Известен биоспецифический сорбент для выделения L-аспарагиназы из клеток E. coli общей формулы
P-O-
Выделение L-аспарагиназы аффинной хроматографией с помощью указанного фермента ведут путем сорбции растворов фермента. Сорбент промывают буферным раствором.
Элюцию осуществляют 0,05 М натрийборатным буферным раствором, содержащим 0,3 М NaCl.
Недостатком известного сорбента является его нестабильность, одноразовость использования; активность полученного продукта невысокая.
С целью устранения указанных недостатков предлагается биоспецифический сорбент для выделения L-аспарагиназы из клеток E. coli общей формулы
P-O-
Выделение L-аспарагиназы аффинной хроматографией с помощью указанного сорбента ведут путем сорбции экстракта фермента. Сорбент промывают буферным раствором.
Элюцию фермента ведут 0,02-0,03 М раствором L-аспарагина в 0,05-0,1 М фосфатном буферном растворе при рН 7,0-8,0. Способ позволяет получать целевой продукт высокой активности.
Синтез биоспецифического сорбента проводят по схеме
a) P
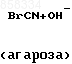 __
__ б) P
__
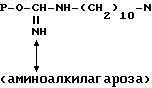 H2
H2в) P-O
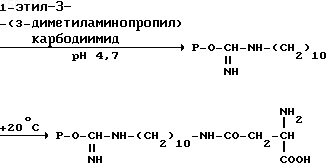 -NH-CO-CH2-
-NH-CO-CH2- 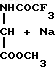 OH _
OH _ В качестве полимерной матрицы используют агарозу фирмы Farmacia Fine Chemicals (Швеция).
20 мл геля агарозы активируют бромцианом (0,2 г BrCN на 1 мл агарозы) при рН 11,0 и присоединяют декаметилендиамин (0,2 г на 1 мл агарозы) при рН 9,8.
Диамин, не вошедший в реакцию, отмывают и добавляют 10 мл раствора 0,5 г N
Гель агарозы отмывают диметилформамидом и водой, затем для отщепления защитных групп суспензию перемешивают с 200 мл 0,2 н раствора едкого натра (16), отмывают водой и хранят при 4оС.
Для определения содержания иммобилизованного ингибитора в биоспецифическом сорбенте суспензию сорбента гидролизуют 6 н раствором соляной кислоты при 110оС в течение 16 ч.
Аминокислотный анализ гидролизата дал концентрацию иммобилизованного ингибитора [L-ингибитора] 7,8
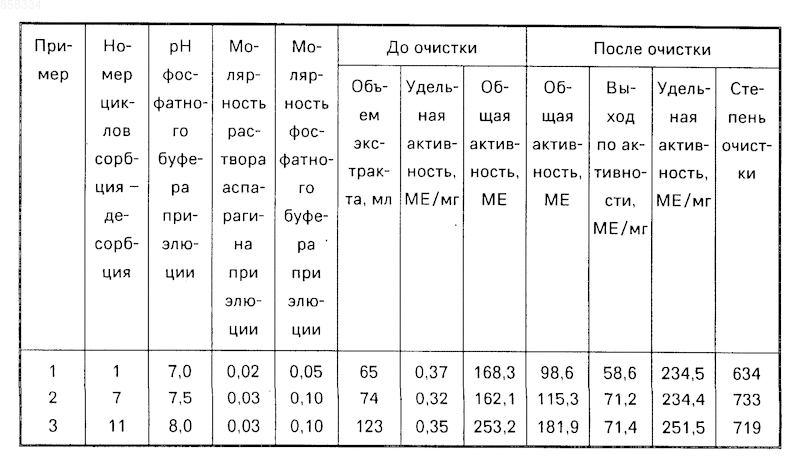
П р и м е р 1. 65 мл экстракта из клеток E. coli с удельной активностью 2,59 МЕ/мл пропускают через колонку (1,0 х 18 см), в которой находится 18 мл биоспецифического сорбента, полученного описанным способом из 20 мл агарозы.
Колонку последовательно промывают 50 мл 0,05 М фосфатного буферного раствора (рН 7,0); 300 мл 0,3 М раствора KCl в том же буфере; 70 мл 10%-ного раствора диметилформамида в том же буфере; 60 мл 0,5 М раствора KCl в том буфере и 100 мл 0,3 М раствора KCl в том же буфере.
L-Аспарагиназу элюируют 0,03 М раствором L-аспарагина в том же фосфатном буфере, содержащем 0,3 М KCl. Регенерацию сорбента осуществляют промывкой сорбента 8 М раствором мочевины в том же буфере, затем исходным буферным раствором. Данные примеров сведены в таблицу.
Молекулярная масса выделенной L-аспарагиназы, определенная методом седиментационного равновесия, равна 139000
Определенная изоэлектрическая точка L-аспарагиназы (pI) 5,20
Выделенная L-аспарагиназа по удельной активности (234-251 МЕ/мг белка) не уступает ферменту, выпускаемому фирмой "Bayer" (ФРГ) с активностью 220 МЕ/мг белка (5), при этом степень одноразовой очистки достигает 633-733 раза.
Одновременно заявляемый способ выделения L-аспарагиназы характеризуется высоким выходом (до 71%).
1. Биоспецифический сорбент общей формулы
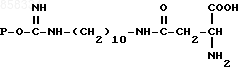
где P - остаток агарозы,
для выделения L-аспарагиназы из клеток E.coli.
2. Способ выделения L-аспарагиназы из клеток E.coli аффинной хроматографией путем сорбции на биоспецифическом сорбенте с последующей промывкой сорбента буферным раствором и элюированием фермента, отличающийся тем, что, с целью повышения активности целевого продукта, в качестве биоспецифического сорбента используют соединение общей формулы
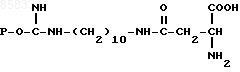
где P - остаток агарозы,
и элюирование фермента ведут 0,02 - 0,03 М раствором L-аспарагина в 0,05 - 0,1 М фосфатном буферном растворе при рН 7,0 - 8,0.
Рисунки
Заявка
2577917/04, 07.02.1978
Институт высокомолекулярных соединений АН СССР, Всесоюзный научно-исследовательский институт особочистых биопрепаратов
Власов Г. П, Мартюшин С. В
МПК / Метки
МПК: B01D 15/08, C12N 9/00
Метки: l-аспарагиназы, биоспецифический, выделения, клеток, применением, сорбент, сорбента, этого
Опубликовано: 20.04.1996
Код ссылки
<a href="https://patents.su/0-858334-biospecificheskijj-sorbent-dlya-vydeleniya-l-asparaginazy-iz-kletok-e-coli-i-sposob-vydeleniya-l-asparaginazy-s-primeneniem-ehtogo-sorbenta.html" target="_blank" rel="follow" title="База патентов СССР">Биоспецифический сорбент для выделения l-аспарагиназы из клеток e. coli и способ выделения l-аспарагиназы с применением этого сорбента</a>
Предыдущий патент: Способ изготовления жидкокристаллического индикатора
Следующий патент: Сверхпроводящий квантовый магнитометр с импульсной модуляцией
Случайный патент: Формовочная машина