Способ получения 3, 5, 6-трихлорпиридин-2-ола, способ получения 2, 2, 4-трихлор-4-цианобутаноилхлорида, способ получения 3, 3, 5, 6-тетрахлор-3, 4-дигидропиридин-2-она
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Номер патента: 1839671
Автор: Пьюз
Текст
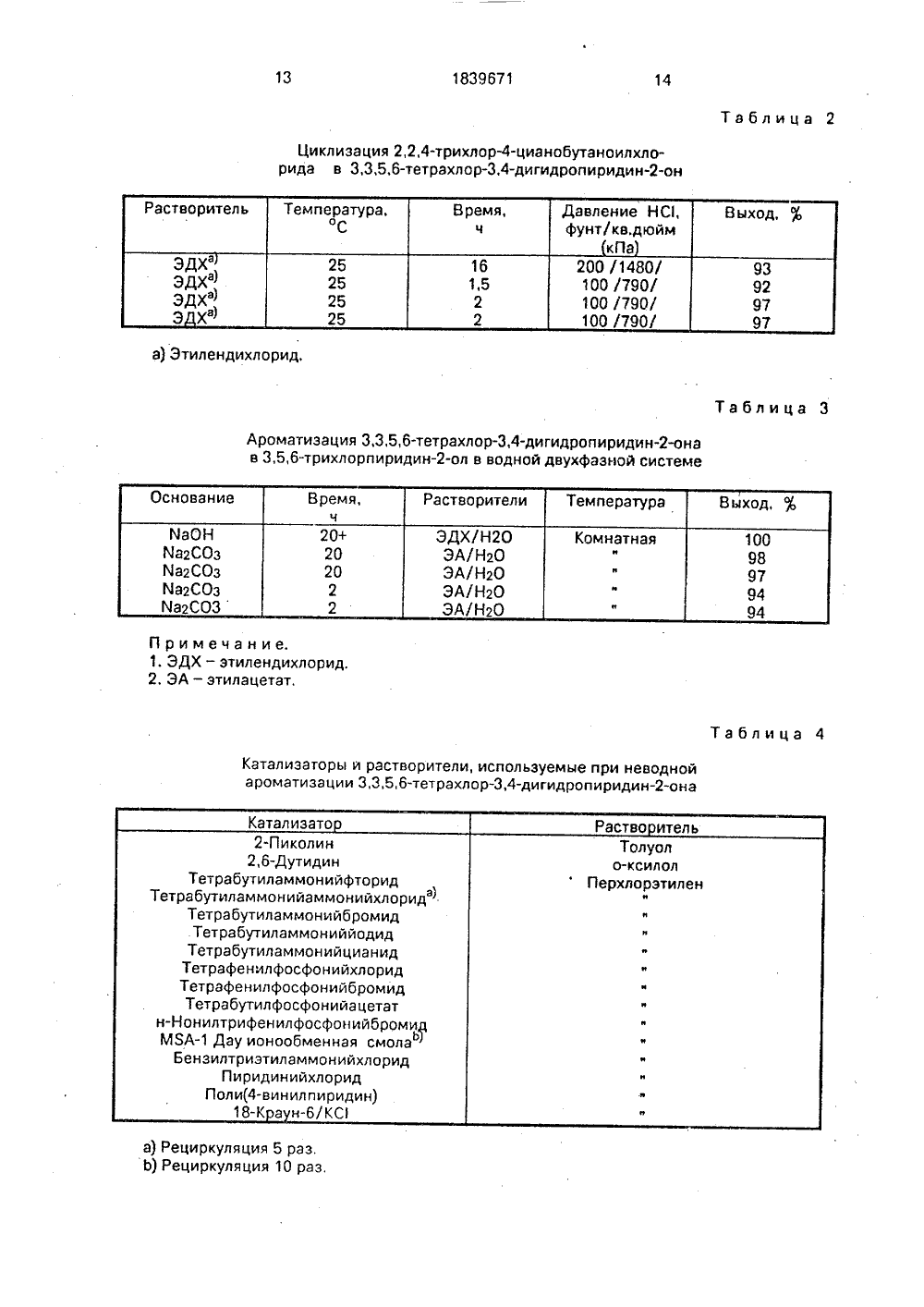
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСКИХ РЕСПУБЛИГОСУДАРСТВЕННОЕ ПАТЕНТНОЕВЕДОМСТВО СССР (ГОСПАТЕНТ СССР)ПИСАНИЕ(71) Дзе Дау Кемйкап Компани (05)(57) Использование. в качестве промежуточногопродукта для получения пестицидов. Сущность:усовершенствованный способ получения3,5,6-трихлорпиридин-ола. Реагент 1: трихлора -цетилхлорид. Реагент 2: акрилонитрил. Условияреакции; реагент 1 обрабатывают реагентом 2 в присутствии катапитических количеств меди или соли меди при 50 - 140 С с удалением образующегося НС при кипячении с обратным холодильником с получением 22,4-трихлор-цианобутаноилхлорида, который обрабатывают безводным НС под давлением 790 - 1480 мПа при комнатной температуре в инертном органическом растворителе с получением 3,3,5,6-тетра хлор,4-дигидропири. дин-она, который обрабатывают хлорид-ионом в инертном органическом инертном растворителе в двухфазной системе в присутствии воды и основания, такого как ЯаОН, Йа СО, йаНСО, или в без 2 3 3водной среде в присутствии третичного амина такого как 2-пиколин, 26-лутидин, или четвертичной аммониевой соли, такой как тетрэалкил(женил)аммонийгалогенид или в присутствии аммониевой ионообменной смолы 5 таблАР 0 ИДтИЗДЦИЯС 1С 1 С 1 С 1 С 1ОН Изобретение касается улучшенного способа получения 3,5,6- трихлорпиридин-ода.3,5,6-Трихлорпиридин-ол является промежуточным продуктом при получении некоторых пестицидов, например хлорпирифоса, хлорпирифосметила и триклопира,Известен способ получения смеси 2,3,5,6-тетрахлорпиридина и 3,5,6-трихлорпиридин-ола в реакции трихлорацетилхлорида с акрилонитрилом в присутствии катализатора 11.Продукты образуются в ходе следующих реакций (схема 1): 35Хотя приведенный ряд реакций преимущественно проводится в ходе одной операции и в замкнутой системе под давлением, общий выход 2,3,5,6-тетрахлорпиридина и 3,5,6-пиридин-ола;не слишком высок, Кро ме того, в реакции обычно образуется смесь двух продуктов, которую необходимо разделить или обработать:,на последующих стадиях с превращением одного продукта в другой. 45Изобретение направлено на улучшенный способ получения 3,5,6-трихлорпиридин-ола, включающий следующие стадии:а) реакцию трихлорацетилхлорида с акрилонитрилом при 50 - 140 С в присутствии 50 каталитического количества меди или соли меди ) с образованием 2,2,4-трихлор-цианобутаноилхлорида с одновременным удалением образующегося НС путем кипячения смеси; 55Ь) реакцию 2,2,4-трихлор-цианобутаноилхлорида в инертном органическом растворителе с безводным НС под давлением 136 - 1480 кПа и температуре от комнатной до 100 С с циклизацией бутаноилхлорида в 3,3,4,6-тетрахлор,4-дигидропиридин-о н;с) реакцию 3,3,5,6-тетрахлор,4-дигидропиридин-она с хлорид-ионом в инертном органическом растворителе с образованием 3,5,6-трихлорпиридин-ола,Изобретение также направлено на различные улучшения способа, касающиеся отдельных стадий.Найдено, что 3,5,6-трихлорпиридин- ол может быть получен с высоким выходом и без образования побочного тетрахлорпиридина проведением реакции присоединения, циклизации и ароматизации по отдельности. В первой реакции, т.е. в реакции присоединения трихлорацетилхлоридЭ.к акрилонитрилу, образуется 2,2,4-трихлор-цианобутаноилхлорид, циклизующийся в присутствии НС, Циклизация прамежуточного соединения в зависимости от того, удаляется ли НС или Н 20, может давать один из трех продуктов: 3,3,5,6-тетрахлор,4-дигидропиридин-ол, 3,5,6-трихлорпиридин-ол или 2,3,5,6-тетрахлорпиридин.Найдено, что вода, получаемая во время образования тетрахлорпиридина, является основным фактором, влияющим на снижение выходов вследствие многочисленных побочных реакций. Вода может образовываться в течение процесса циклизации, который сам по себе катализируется кислотами. Изобретение предоставляет способ достижения лучших выходов путем удаления НО, образующегося на стадии присоединения при разложении реагентов.55 Для удобства НС удаляют, вследствие чего образование воды предотвращается предпочтительно проведением реакции присоединения в условиях дефлегмации.Трихлорацетилхлорид (ТСАС) и акрилонитрил (ЧСМ) являются продажными продуктами и перед использованием обычно перегоняются. Трихлорацетилхлорид и акрилонитрил могут подвергаться реакции в молярных соотношениях в пределах от стехиометрического, т.е. 1;1, до 2-3-кратного избытка любого из реагентов, т,е. (1:3) -(3:1) Чсй/ТСАС. Предпочитаются обычно соотношения ЧВ 4/ТСАС 1,1 - 1,3,Реакцию присоединения проводят в присутствии каталитического количества соли медив инертной атмосфере, например в азоте или аргоне, Соли меди , которые могут быть использованы, включают, например, хлорид, бромид, йодид, оксид или ацетат, предпочтительно галогениды. Катализаторы, которые частично окисляются до состояния окисления меди ( ) или гидратируются, менее эффективны по сравнению с чистыми продуктами, Успешно может применяться добавление металлической меди, которая сама по себе может окисляться досостояния окисления медипри одновременном предотвращении дальнейшего окисления до состояния окисления меди . Медный катализатор обычно применяется в количестве 0,005 - 0,05 моль катализатора на 1 моль трихлорацетилхлорида, хотя могут применяться и большие количества,Реакция присоединения может осуществляться в чистом виде или в присутствии инертного растворителя. Алкилнитрилы,такие как ацетонитрил, обычно используются в катализируемых соединениями медиреакциях присоединения полигалоидных соединений к олефинам. Однако добавление ацетонитрила к реакционной смеси не приводит к какому-либо благоприятному эффекту, Поэтому реакция предпочтительно проводится в чистом виде или с избытком ТСАС или ЧСИ, эффективно служащих в качестве растворителя. Трихлорацетилхлорид может быть получен в промышленном масштабе фотохимическим окислением перхлорэтилена. Полученный этим способом ТСАС содержит обычно около 15 остаточного перхлорэтилена, который не оказывает отрицательного влияния на реакцию присоединения.Для предотвращения образования НС эа счет преждевременной циклизации 2,2,4- трихлор-цианобутаноилхлорида температуру реакции необходимо поллерживать в пределах 50-140 С. Дя удлления образуюмер, с помощью реакции 2,2,4-трихлор- цианобутаноилхлорида с безводным НС. Простое пропускание безводного НС в 2,2,4-трихлор-цианобутаноилхлорид в отсутствии растворителя при атмосферном давлении не приводит к циклизации. Поскольку повышенные температуры приводят к увеличению количеств прлуктов50 дегидратации и тетрахлорпиридина, рекомендуется поддерживать температуру ниже 100 С, Реакция циклизации эффективно протекает при температуре от комнатной до 100 С, предпочтительно при 40-60 С, Для сохранения подвижности реакционной смеси при температуре ниже температуры плавления продукта и для обеспечения эффективного контакта безводного НС с реакционной смесью предпочтительно проводить циклизацию под давлением в присутствии растворителя. Обычно применяют давления от 136 до 1480 кПа (5-200 фунт./кв,дюйм), предпочтительно от 273 до 1135 к Па (25 - 150 фунт./кв.дюйм).Подходящие для реакции циклизации растворители включают ароматические углеводороды, галоидированные углеводороды и эфиры карбоновых кислот, Примеры подходящих растворителей каждого класса включают (но не ограничиваются ими) толуол и ксилолы; хлористый метилен, этилендихлорид (ЭДХ), перхлорэтилен (ПХЭ); и этилацетат,Реакция циклизации может удобно проводиться периодическим или непрерывным способом в змеевиковом реакторе, При обычном проведении реакции 2,2,4-трихлор-цианобутаноилхлорид разбавляют соответствующим растворителем в закрытом сосуде под давлением и в сосуде создают необходимое давление с помощью безводного НС. Реакционную смесь перемешивают при соответствующей температуре до тех пор, пока не завершится реакция, обычно в течение 1-3 ч. Давление в сосуде сбрасывают и полученный продукт - 3,3,5,6- тетрахлор,4-дигидропиридин-он может отделяться обычными способами. Например, выпаривание растворителя дает сырой твердый продукт, который может суспендироваться с алифатическим углеводородом, например гексаном, и затем продукт отделяется фильтрованием, Полученный в результате продукт достаточно чист, чтобы после сушки использоваться на последующей стадии ароматизации, Альтернативно сырая реакционная смесь может использоваться непосредственно сразу же после стравливания и удаления Н С 1,Ароматизация 3,3,5,6-тетрахлор,4-дигидропиридин-она в 3,5,6- трихлорпиридин-ол может быть осуществлена различными способами. К числу наиболее эффективных методик относится обработка в двухфазной системе водным основанием или обработка хлорид-ионом в органическом растворителе.Поскольку целевой 3,5,6-трихлорпиридин-ол часто применяют в виде натриевой 5 10 15 20 25 30 35 40 45 соли, очень удобно проводить ароматизацию обработкой водными щелочными растворами. Реакция предпочтительно проводится в двухфазной системе с использованием не смешиваемого с водой органического растворителя, Подходящие для реакции ароматизации растворители включают ароматические углеводороды, галоидированные углеводороды и эфиры карбоновых кислот, Примеры подходящих растворителей каждого класса включают(но без ограничения только ими): толуол и ксилолы; хлористый метилен, этилендихлорид и перхлорэтилен; и этилацетат. Предпочтительно прИменять те же растворители, что и в реакции циклизации,Реакция ароматизации требует применения по меньшей мере двух эквивалентов основания на эквивалент 3,3,5,6-тетрахлор,4- дигидропиридин-она, Один эквивалент необходимо для отщепления одного моля НС 1, а второй эквивалент расходуется при превращении пиридинола в пиридинат. При желании основание может использоваться и в больших количествах, Подходящие основания включают (но не ограничиваются ими) гидроокиси и карбонаты щелочных металлов, Обычно предпочтительны карбонаты калия или натрия, в особенности в случае использования эфиров карбоновых кислот в качестве растворителей, которые восприимчивы к реакции с разбавленным каустиком при комнатной температуре.При обычном проведении реакции основание, дигидропиридон, растворитель и вода вводятся в контакт при перемешивании при температуре от комнатной до 100 С или температуре дефлегмации смеси, По окончании реакции (как правило, через 2-4 ч) 3,5,6 -трихлорпиридин-ол выделяют стандартными методами. К примеру, трихлорпиридинол может быть легко выделен подкислением реакционной смеси и отделением органической фазы. После сушки органического раствора выпаривание растворителя дает целевой пиридинол. Если желательно получить щелочнометаллическую соль трихлорпиридинола, водный раствор пиридината может быть получен простым отделением водной фазы.Реакция ароматизации может осуществляться с помощью обработки 3,3,5,6-тетрахлор,4-дигидропириди н-она хлорид-ионом в инертном органическом растворителе. Хлорид-ион может быть добавлен непосредственно или может быть образован на месте при инициировании отщепления НС от пиридона, Поскольку хлорид-ион образуется за счет отщепления НС10 1839671 45 от субстрата, требуются лишь каталитические количества хлорид-иона или вещества, способного инициировать отщепление НС 1. Подходящие катализаторы, отвечающие приведенному определению, включают (но не ограничиваются ими) следующие типы материалов. третичные или ароматические амины, например триалкиламины, пирицин, пиколины или лютидины, четвертичные соли аммония или фосфония, например тетраалкил- или ариламмония- или фосфонийгалогениды, комплексы краунэфиров, например 18-краун/КС и ионообменные .смолы, в частности аминовые смолы, например МЯАДау ионообменная смола. Конкретные примеры подходящих веществ включаю- тетрабутиламмонийгалогениды, тетрафенилфосфонийгалогениды, монилтрифенилфосфонийгалогениды, бензилтриэтиламмонийгалогениды, пиридинийгалогениды и поли(4- винилпиридин). К числу предпочтительных катализаторов относятся МЯАДау ионообменная смола и тетрабутиламмонийхлорид, Эти катализаторы обычно применяют в количестве, соответствующем 0,002-0,2 моль катализатора на 1 моль 3,3,5,6-тетрахлор,4- дигидропиридин-она, предпочтительно 0,005 - 0,05 моль катализатора на 1 моль дигидропиридинона.Подходящие растворители для реакции ароматизации включают те же ароматические углеводороды, галоидированные углеводороды и эфиры карбоновых кислот,что и применяемые на предшествующих стадиях. Особенно предпочитается для этой реакции перхлорэтилен. Реакцию осуществляют при 40-120 С, предпочтительно при температуре дефлегмации смеси,При типичном проведении реакции 3,3,5,6-тетрахлор,4-пиридин-он контактируют с катализатором и растворителем и реакционную смесь нагревают до дефлегмации. По окончании реакции, обычно через 1 - 3 ч, целевой 3,5,6-трихлорпиридин-ол может быть выделен стандартными методами. Например, в случае использования нерастворимого катализатора, такого как МЯАДау ионообменнэя смола, катализатор может быть удален фильтрованием в горячем состоянии, после чего может быть регенерирован и рециклизован в последующие реакции. После удаления катализатора реакциОнный раствор может охлаждаться для кристаллизации трихлорпиридинола, который затем отделяется с помощью фильтрования, При использовании растворимого катализатора, такого кэк тетрабутиламмонийхлорид, реакционная смесь может быть охлаждена для кристаллизации трихлорпиридинола, который отделяют фильтрованием, Содержащий растворимый 5 катализатор фильтрат может быть непосредственно рециклизован,Изобретение иллюстрируется следующими примерами, которые, однако, не предназначены для ограничения объема 10 изобретения. П р и м е р 1, Присоединение трихлорацетилхлорида к акрилонитрилу 15 О С 1 Н СС 1 С 1 СН 2Свежеперегнанный трихлорацетилхлорид (ТСАС), акрилонитрил (ЧсМ) и безводный катализатор нагревают в условиях 25 дефлегмации в атмосфере азота. Процентконверсии определяют отбором, охлаждением, фильтрованием и анализом образцов с помощью газовой хроматографии (ГХ) или спектроскопией ядерного магнитного резо нанса (ЯМР). Продукт реакции отделяют охлаждением реакционной смеси, испарением летучих исходных соединений и удалением катализатора фильтрованием.Полученные результаты приведены в табл.35 1.П р и м е р 2. Циклизация 2,2,4-трихлор 4-цианобутаноилхлорида С 1 Н40 С 1 С 1 С 1С, --С 1И О Циклизацию проводят в сосудеНазтеИоу С ВопеЬ на 600 мл, снабженном магнитной мешалкой. 2,2,4-Трихлор- цианобутаноилхлорид разбавляют соответству ющим растворителем и в сосуде создаютнеобходимое давление с помощью безводного НС 1. После перемешивания в течение заданного времени давление в сосуде стравливают и содержимое переносят в 55 круглодоннуа колбу для испарения в роторном испарителе. Содержимое колбы суспендируют с гексэном для облегчения отделения продукта фильтрованием. Полученные результаты приведены в табл. 2.ТСАС,моль ЧСИ, моль Катализатор,Выхо,Анализ Выделено 44 48 1,0 1,0 1,0 0,5 0,5 1,0 0,5 0,5 0,5 69 95 94 70 78 77 76 65 58 24 48 24 24 66 59 59 50 51 0,4 0,4 0,3 0,38 0,49 0,37 0,39 0,49 0,59 1,0 10, 0,48 ф О,48) О 49) О,48 д) 0,48 0,48 0,48 0,48 9 12 10 45 48 62 10 10 ТСАС дополнительно содержит 15 мас, перхлорэтилена П р и м е р 3, Ароматизация 3,3,5,6-тетрахлор,4-дигидропиридин-она (в двухфазной системе) С 1 С 1 С 1С 1н О С 1С 11 В обычном эксперименте 23,3 г (0,1 моль) дигидропиридона, 233 мл этилацетата, 233 мл воды и 0,3 моль основания перемешивают (магнитная мешалка) и нагревают с обратным холодильником в течение 2 ч, После охлаждения реакционную смесь подкисляют концентрированной НС и органическую фазу отделяют и сушат над М 9504, После фильтрования иэ фильтрата испарением получают целевой продукт. Полученные результаты приведены в табл.3. П р и м е р 4. Ароматиэация 3,3,5,6-тетрахлор,4-дигидропиридин-она (неводная).В трехгорлую круглодонную колбу емкостью 25 мл добавляют 5 г 3,3,5,6-тетрахлор,4-дигидропиридин-она, 0,1 г катализатора и 25 мл растворителя. Реакционную смесь нагревают до дефлегмации,ход реакции контролируют с помощью ГХ.Продукт выделяют фильтрованием. В каждом случае выход выделенного продукта составлял по меньшей мере 90. В табл, 45 указаны применяемые катализаторы и растворители.П р и м е р 5, Последовательная циклиэация-ароматизация,Циклизацию проводят в сосуде10 НазтеИоу емкостью 600 мл, снабженноммагнитной мешалкой. 2,2,4-Трихлор-цианобутаноилхлорид (аддукт) разбавляют 150мл перхлорэтилена и в сосуде создают давление до 150 фунт./кв.дюйм (1135 кПа) до 15 бавлением безводного НС 1. Послеперемешивания втечение 2 ч при указаннойтемпературе давление в сосуде стравливают и содержимое с помощью дополнительных 100 мл перхлорэтилена переносят в20 круглодонную колбу, содержащую МЯА-Дау ионообменную смолу. Смесь нагреваютс обратным холодильником в течение 1,5.ч,твердый катализатор удаляют фильтрованием в горячем состоянии. Фильтрат25 охлаждают для кристаллизации 3,5,6-трихлорпиридин-ола, который отфильтровывают и сушат, Полученные результатыприведены в табл. 5. 30 (56) Патент США М 4327216,кл. С 07 О 213/64, 1983.а) Этилендихлорид,Таблица 3 П р и м е ч а н и е.1. ЭДХ - этилендихлорид.2. ЭА - атил ацетат,Таблица 4 Катализаторы и растворители, используемые при неводной ароматизации 3,3,5,6-тетрахлор,4-дигидропиридин-она Катализато Раство итель 2-Пиколин 2,6-Дутиди н Тетрабутиламмонийфторид Тетрабутиламмонийаммонийхлорид) Тетрабутиламмонийбромид Тетрабутиламмониййодид Тетрабутиламмонийцианид Тетрафенилфосфонийхлорид Тетрафенилфосфонийбромид Тетрабутилфосфонийацетат н-Нонилтрифенилфосфонийбромид МЯАДау ионообменная смола Бензилтриэтиламмонийхлорид Пиридинийхлорид Поли(4-винил пиридин) 18-К а н/КС1839671 Таблица 5 Циклизация-ароматизация бретени ормул трихлорпи,3,5,6-тетСоставитель М.М Техред М.Морг ркулова тал Корре Редактор М.Стрельникова евская Тираж Подписно НПО "Поиск" Роспатента 113035, Москва, Ж, РауЬская наб 4/5Заказ 3411 роизводственно-издательский комбинат "Патент", г, Ужгород, ул.Гагарина. 1. Способ получения 3,5,6-трихлорпиридин-ола взаимодействием трихлорацетилхлорида с акрилонитрилом при повышенной температуре в присутствии каталитических количеств меди мли соли меди ( с образованием 2,2,4-трихлор-цианобутаноилхлорида, который подвергают взаимодействию с безводной НС в инертном органическом растворителе с получением3,3,5,6-тетра-хлор,4-дигидропи ридин- она, последний действием хлорид-иона в 15 инертном органическом растворителе пе- реводят в целевой продукт, отличающийся тем, что взаимодействие трихлорацетилхлорида с акрилонитрилом ведут при 50- 140 С с удалением образующегося НО прл кипячении с обратным холодильником, обработку 2,2,4-трихлор-цианобутаноилхлорида ведут под давлением 790 - 1480 кПа при комнатной температуре, обработку 3,3,5,6-тетрахлор,4-дигидропиридин-о на ведут в двухфазной системе в присутствии воды и основания, такого, как йаОН, Ма 2 СОз, ЙаНСОз, или в безводной среде в присутствии третичного амина, такого, как 2-пиколин, 2,6-лутидин, или четвертичной 30 аммониевой соли, такой, как тетраалкил(фенил)аммонийгалогенид, или фосфониевойсоли, такой, как тетраалкил(фенил)фосфонийгалогенид, или четвертичной аммониевой ионообменной 35 смолы, на основе триметиламина и хлорметилированного полистирола, или в присутствии комплекса Краун-эфира, такого, как 18-краун/НС 1.0 2. Способ получения 2,2,4-трихлор- цианобутаноилхлорида взаимодействием трихлорацетилхлорида с акрилонитрилом в присутствии каталитических количеств меди или соли меди (1) при повышенной температуре, отличающийся тем, что процесс ведут при 50 - 140 С с удалением образующегося НО при кипячении с обратным холодильником.3. Способ получения 3,3,5,6-тетрахлор,4-дигидропиридин-она взаимодействием 2,2,4-трихлор-цианобутаноилхлорида в инертном органическом растворителе с безводной НС, отличающийся тем, что процесс ведут при комнатной температуре и давлении 790 - 1480 кПа.4, Способ получения 3,5,6 ридин-ола взаимодействиемрахлор,4-дигидропиридин-она с хлорид-ионом в инертном органическом растворителе, отличающийся тем, что, с целью предотвращения образования побочного продукта, процесс ведут в двухфазной системе в присутствии воды и основания, такого, как Ма ОН, Маг СОэ, МаНСОз, или в безводной среде в присутствии третичного амина, такого, как 2-пиколин или 2,6-лутидин, или четвертичной аммониевой соли, такой, как тетраалкил(фенил) аммонийгалогенид, или соли фосфония, такой, как тетраалкил(фенил)фосфонийгалогенид, или четвертичной аммониевой ионообменной смолы на основе триметиламина и хлорметилированного полистирола, или комплекса Краун-эфира, такого, как 18-краун/КС.
СмотретьЗаявка
04743820, 11.05.1990
Пьюз Р. Гарт
МПК / Метки
МПК: C07C 255/17, C07D 213/64
Метки: 4-дигидропиридин-2-она, 4-трихлор-4-цианобутаноилхлорида, 6-тетрахлор-3, 6-трихлорпиридин-2-ола
Опубликовано: 30.12.1993
Код ссылки
<a href="https://patents.su/8-1839671-sposob-polucheniya-3-5-6-trikhlorpiridin-2-ola-sposob-polucheniya-2-2-4-trikhlor-4-cianobutanoilkhlorida-sposob-polucheniya-3-3-5-6-tetrakhlor-3-4-digidropiridin-2-ona.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения 3, 5, 6-трихлорпиридин-2-ола, способ получения 2, 2, 4-трихлор-4-цианобутаноилхлорида, способ получения 3, 3, 5, 6-тетрахлор-3, 4-дигидропиридин-2-она</a>
Предыдущий патент: Способ получения 4-(3, 4-дихлорфенил)-3, 4-дигидро-1(2h) нафталинона
Следующий патент: Способ получения фосфорсодержащих соединений
Случайный патент: Способ комбинированного нагрева стекла