Способ выделения оксидазы -аминокислот из яда гюрзы
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
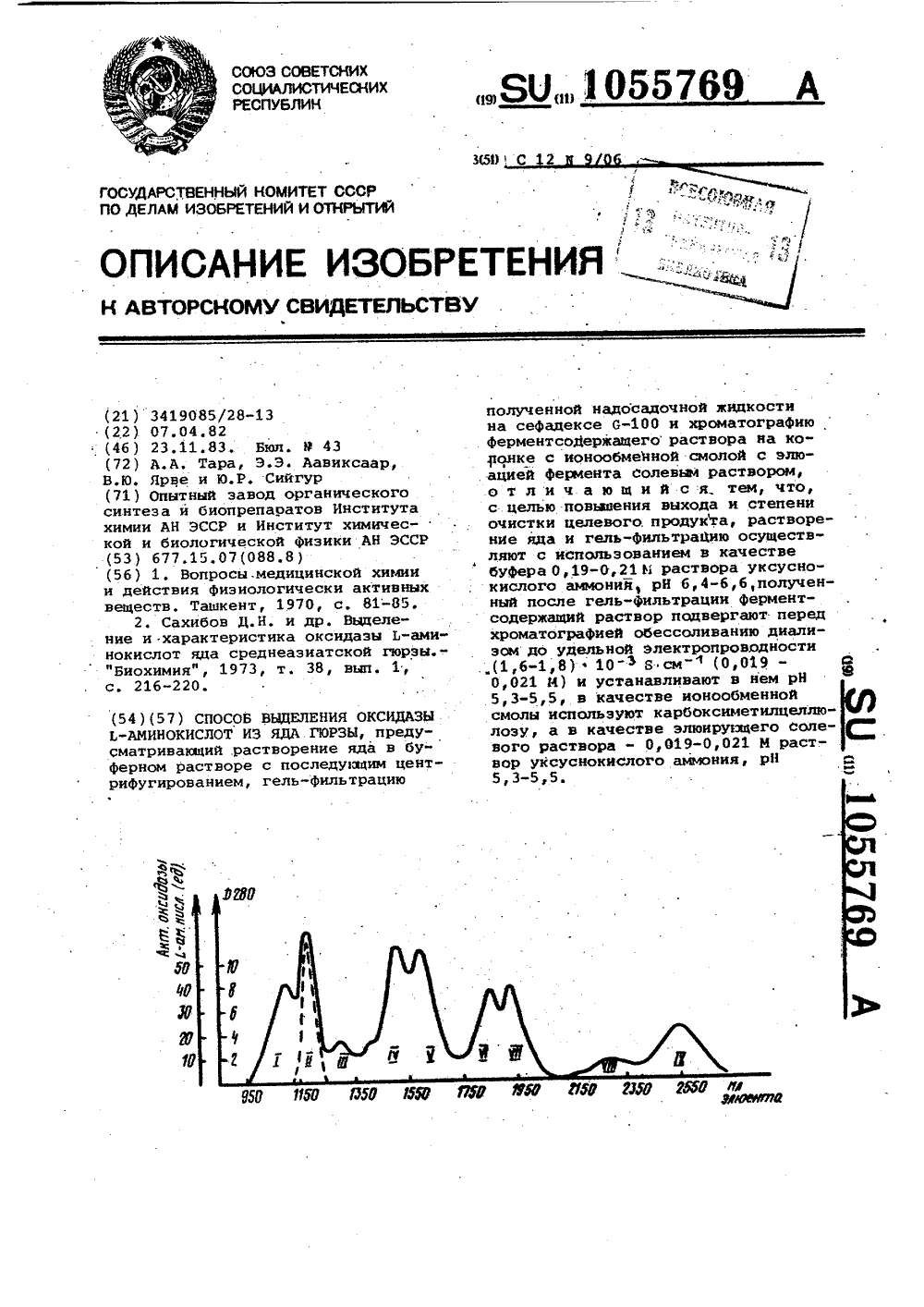
СОЮЗ СОВЕТСКИХСОЦИАЛИСТИЧЕСКИХРЕСПУБЛИК НОЙ КОМИТЕТ СССРОБРЕТЕНИЙ И ОТКРЫТИЙ ГОСУДАРСТВ;8 ПО ДЕЛАМ И Р.,л,ОПИСАНИЕ ИЗОБРЕН АВТОРСКОМУ СВИДЕТЕЛЬСТВ ЕНИ полученной надосадочной жидкостина сефадексе 0-100 и хроматографию. Ферментсо 4 ержащего раствора на колонке с ионообмейной смолой с элю.ацией фермента солевый раствором,о т л и ч а ю щ и й с я тем, что,с целью повьзаения выхода и степениочистки целевого. продукта, растворение яда и гель-Фильтрацию осуществляют с использованием в качествебуФера 0,19-0,21 М раствора уксуснокислого аммония, рН 6,4-б,б,полученный после гель-Фильтрации ферментсодержащий раствор подвергают передхроматографией обессоливанию диализом до удельной злектропроводности.(1,6-1,8 ф 10Б см ф (0,019 - Ф0,021 Й и устанавливают в нем рН5,3-5,5, в качестве ионообменнойсмолы используют карбоксиметилцеилюлозу, а в качестве элюирующего солевого раствора - 0,019-0,021 М раст;вор уксуснокислого амьюния, рН5,3-5,5,(21 ) 3419085/28-13(71) Опытный завод органическогосинтеза и биопрепаоатов Институтахимии АН ЭССР н Институт химической и биологической физики АН ЭССР(56) 1. Вопросы, медицинской химиии действия физиологически активныхвеществ. Ташкент, 1970, с. 81-85.2. Сахибов Д.Й. и др. Выделение и характеристика оксидазы Ь-аминокислот яда среднеазиатской гюрзы.- фБиохимия", 1973, т. 38, вып. 1,с. 216-220.(54)(57) СПОСОБ ВЫДЕЛЕНИЯ ОКСИДАЗЫЬ-АМИНОКИСЛОТ ИЗ ЯДА ГЮРЗЫ, предусматривающий растворение яда в буферном растворе с последующим центрифугированием, гель-фильтрациюИзобретение относится к выделению оксидазы Ь-аминокислот - фермента, каталиэирующего реакции окис-,лительного дезаминирования Ь-аминокислот с образованием еС-кетокислоты. Оксидаза Ь-аминокислот используется как для препаратинного получения тироксина, чистых о-изомеров аминокислот и с-кетокислот, таки для различных аналитических целейпри изучении процессон транспортааминокислот н процессе синтеза белка.Оксидаза Ь"аминокислот содержится во многих тканях животных (печень птиц), в микробах и в биологических жидкостях животных (змеиные 15яды).Получение оксидазы Ь-аминокислотиз тканей животных и из микробов необеспечивает чистоту фермента,таКкак источники фермента представляют 20многокомпонентную смесь различных,белков, разделение которых является сложной задачей, Наиболее эффективным источником фермента являютсязмеиные яды, так как стабильность структуры яда обеспечиваетчеткое разделение,Активность оксидазы Ь-аминокислот н ядах различных змей варьируется. Это связано с видовой специфич- ЗОностью ядов, а также зависит от места обитания и условий существованиязмей.Исследование ядов среднеазиатскихзмей показало, что наибольшей активностью оксидазы Ь-аминокислот обладасет яд гюрзы. Это и определяет выборяда гюрзы н качестве источника длявыделения ФерментаИзвестен способ выделения оксидазы Ь-аминокислот из яда гюрзы 40путем растворения яда в воде, осаждения белков сульфатом аммония, гельФильтрации на сефадексе 0-100 в присутствии фосфатного буфера с рН7,8 и обессоливания Ферментной фракции на сефадексе 0-25, Достигаемаястепень очистки фермента 5,4-7,0 13.Наиболее близким по достигаемомурезультату и технической сущностиявляется способ выделения оксидазы 5 ОЬ-аминокислот из яда гюрзы, предусматривающий растнорение яда в0,05 М Фосфатном буферном растворес рН 7,8 с последующим центрифугированием, гель-Фильтрацию полученной надосадочной жидкости на сефадексе 0-100. Затем фракцию, содержащую ферментатинную активность,обессоливают, высушивают лиофильнои растворяют в 0,0025 М Фосфатном бу-фере, после чего осуществляют хрома Отографию. на ДЭАЭ-целлюлозе с элюацией Фермента 4-ступенчатым градиентом Бас 1 (0,1-0,4 М) н 0,05 М Фосфатном буфере, рН 7,8 Г 2 3,Однако слабооснонной анионитДЭАЭ-целлюлоза - не является селективным ионообменником при очисткеоксидазы Ь-аминокислот. Ферментэлюируется, совместно с основнымколичеством белка после первой ступени ионной силы (0,1 М 1 Вл.1).Достигается только 3-кратная очистка,причем потери активности доходятдо 31. Степень очистки - 15,3 раза. Выход оксидазы Ь-аминокислот 65,4,Таким образом, недостатком способа является низкий выход оксидазы Ь-аминокислот и невысокая степень очистки.Целью изобретения является по-вышение выхода и степени .очисткиоксидазы Ь-аминокислот.Поставленная цель достигаетсяпредлагаемым способом выделенияоксидазы Ь-аминокислот из яда гюрзы,предусматривающим растворение яда вбуферном растворе с последующимцентрифугированием, гель-фильтрациюполученной надосадочной жидкости насефадексе 0-100 и хроматографиюФерментсодержащего раствора наколонке с ионообменной смолой с элюацией фермента соленым раствором,при чем растворение яда и гель-Фильтрацию осуществляют с использованиемв качестве буфера 0,19-0,21 М раствора уксуснокислого аммония, рН6,4-6,6, получеййщй йбсле гельфильтрации Ферментсодержащий раствор подвергают перед,хроматографией обессолинанию диализом до Удельной электропроводности (1,6-1,8) хх 10-ЗБсм(0,019-0,21 М) и устанавливают в нем рН 5,3-5,5,в качестве ионообменной смолы используюткарбоксиметилцеллюлоэу, а в качестве элюирующего соленого раствора -.0,019-0,021 М раствор уксуснокислогоаммония, рН 5,3-5,5,Аммоний уксуснокислый является1очень:гигроскопичным:, веществом и сцелью приготовления хорошо воспроизводимых буферных растворов необходимконтроль удельной электропроводности раствора, Удельная электропронодность рассчитывается по формуле УЭ = 1- (Я см ) К -1 где К - константа ячейки кондуктометра;см Р- сопротивление раствора, Ом.Предлагаемый способ обеспечивает повышение степени очистки до 25 раз и повышение выхода до 854 оксидаэы Ь-аминокислот.Использование уксуснокислого аммония в качестве буфера на стадии растнорения обеспечивает создание средыфдля последующего разделения,Гель-фильтрации подвергают раст. вор яда гюрзы, разделение происходит на геле, причем в качестве геляиспользуется сефадекс 0-100 сверх- тонкий, разделяющий белки в пределах молекулярного веса 4000-150000 5 дальтонов. Яд гюрзы, содержащий многокомпонентную смесь, разделяется на9 белковых пиков (см. чертеж). 1,111 - 1 Х пики исключаются, посколькув них присутствуют эндонуклеазы, 10 протеазы, фосфолипазы А, токсины, яда и другие вещества; Степень очистки 5-6 раз, выход 95.Последующей ионообменной хроматографии подвергают фракции 11 пика 5гель-фильтрации, причем удельную электропроводность .раствора уменьшают с диализом до (1,6-1,8) х х 10 Б см-", (0,019-0,021 М) рН 6,4-6,6, одновременно концентрируя раствор до 40 мл. рН раствора дово. дят до 5,3-5,5 с помоцью 20-нойуксусной кислоты. В качестве ионита используют избирательно действувцую карбоксиметилцеллюлозу и проводят селективное разделение. На ионит наносят раствор фермента .с удельной электропроводностью (1,6-1,8).10% сьГ 0,019-0,021 М, рН 5,3-5,5. При этом оксидаза Ь-аминокислот проходит ионообменник, а остальные белки связы ваются катионитом.Таким образом, предлагаемый способ заключается в следующем.Яд гюрзы растворяют в растворе уксуснокислого аммония, центрифуги руют, осадок выбрасывают, надосадочную жидкость используют для гель- фильтрации. Гель-фильтрацию проводят. с раствором уксуснокислого аммония0,19-0,21 И с удельной электропро-4 р водностью (14,5-15,5 ) 10 зБ см-, рН 6,4-6,6. Полученную фракцию оксидазы Ь-аминокислот с приблизитель но одинаковым молекулярным весом обессоливают и концентрируют при по мощи диализа с полиэтиленгликолем до удельной электропроводности (1,6-1,8) -10 З Б сМ-", (0,019-0,021 И) Полученный раствор фермента, рН 5,3-5,5, наносят на колонку с карбоксиметилцеллюлозой. Оксидаза Ь-аминокислот проходит катионит, а остальные белки (фосфодиэстераза, щелочная фосфатаза, 5-нуклеотидаза) связываются катионитом при рН 5,3-5,5 и удельной электропроводности раствора (1,6-1,8) 10Б см, ф, (0,019- 0,021 М). Фракции оксидаэы Ь-аминокислот собирают и концентрируют при помощи диализа с полиэтиленгликолем, Выход = 85. Степень очистки - 25 раз.66 Активность оксидазы Ь-аминокислот ед/мг белка. Характеристика препарата: выход - 85,2, степень очистки 25,0 раза, активность оксидазы 1,-аминокислот - 5,0 ед/мг белка.П р и м е р 2. К 1,0 г яда,добавляют 40 мп 0,2 М раствора уксуснокислого аммония с удельной электропроВодностью 15,0 10-З Бсм-", фН 6,5, Смесь медленно перемешивают 4 ч. Растворенный яд центрифугируют при 5000 об/мин в течение 30 мин при 4 С Осадок выбрасывают, надосадочную жидкость используют для гель- фильтрации. На уравновешенную 0,2 И П р и м е р 1. К 4,9 г яда гюрзыдобавляют 40 мл 0,19 И раствора;уксуснокислого аммония с удельнбй .электропроводностью 14,5-10 3 Б -см-рН 6,4. Смесь медленно перемешиваютв течение 4 ч при 4 ОС. Растворенныйяд центрифугирувт при 5000 об/минопри 4 С в течение 30 мин. Осадоквыбрасывают, надосадочную жидкостьиспользуют для гель-фильтрации. Науравновешенную 0,19 .И растворомуксуснокислого аммония (удельнаяэлектропроводность 14,5 10 зБ см )колонку с сефадексом 6-100 сверхтонким (размеры колонки 4,2 х 140) наносят раствор яда., Колонку элюируют 0,19 И растворомуксуснокислого аммония с удельнойэлектропроводностью 14,5 . 10 з Б см-,рН 6,4, са скоростью 13 мл/ч и собирают фракции до 19 мл. Оптическуюплотность элюата регистрируют непрерывно спомощью "Увикорд".Получают:9 белковыхпиков.Во 11 пике фракции,которые имеют активности оксидазы Ь-аминокислот,объединяют (объем 200 мп)и подвергают диализу до выхода 40 млжелтого раствора белка с удельнойэлектронроводностью 1,6 . 10 зБ .см ,0,019. И; доводят рН 20-"ной уксуснойкислотой до рН 5,3,Раствор фермента наносят на уравновешенную 0,019 М раствором уксуснокислого аммония (удельная электропро"водность 1,6 - 10-ЭБ см-", рН 5,3)колонку карбоксиметилцеллвлозы КМ.Через колонку пропускают 0,5 л раствора уксуснокислого аьиония, рН 5,3(удельная электропроводность раствора 1,5 10"ЗБ,см- . Скорость элюации 45 мл/ч, собираются фракции по15 мл. Оптическую плотность элватарегистрируют непрерывно с помощью"Увикорда". Во фракциях определяютактивность оксидаэы Ь-аминокислот(субстрат - Ь-лейцин). При ионообменной,хроматографии на КМ-целлюлозеоксидаза Ь-аминокислот проходит катионит в данных условиях, а остальные белки, имеюцие изоэлектрическуюточку воде 5,3, связываются катионитом. Фракции, содержацие активности оксидазы Ь-аминокислот, объединяют (выход 140 мл ) и концентрируют при помощй диализа.1055769 40 Ф-кетокислоты. раствором уксуснокислого аммония (удельная электропроводность 15,0 х х 10 3 Б см ) колонку с сефадексом 0-100 сверхтонким (размер колонки 4,2 х 140 см) наносят раствор яда. Колонку элюируют 0,2 И раствором уксуснокислого аммония с удельной электропроводностью 15,0 10 эБ см, рН 6,5, со скоростью 13 мл/ч и собирают фракции .по 19 мп. Оптическую плотность элюата регистрируют непрерывно с помощью "Увикорд", Получают 9 белковых пиков. Во 11 пике фракции, которые имеют активности оксидазы Ь-аминокислот, объединяют (объем 205 мл) и концентрируют при помощи диализа до 40 мл, Удельная электропроводность полученного раствора 1,7 10 эБ см 0,02 И. рН раствора доводят до 5,4 с помощью 20-ной уксусной кислоты.Раствор Фермента наносят на уравновешенную 0,02 М раствором уксусно- кислого аммония (удельная электропроводность 1,7 10 3 Я . см ") колонку КМ-целлюлозы. Через колонку пропускают 0,5 л 0,02 М растворауксуснокислого аммония, рН 5,4 (удельная электропроводность 1,7 х х 10Б-см ). Скорость элюации 45 мл/ч. Собираются Фракции по 15 мл. Оптическую плотность элюата регистрируют непрерывно с помощью "Увикорда". Во фракциях, содержащих белки, определяют активность оксидазы Ь-аминокислот (субстрат - Ь-лейцнн), объединяют их (выход 145 мл) и концентрируют при помощи диализа. Характеристика препарата: выход - 85,7 степень очистки - 25,6 раза, активность оксидазы Ь-аминокислот,4 ед/мг белка. П р и м е р 3. К 4,9 г яда добавляют 40 мл 0,21 М раствора уксусно- кислого аммония с удельной электропроводностью 15,510 З Б см-", рН 6,6. Смесь медленно перемешивают 4 ч при 4 С. Растворенный яд центдо рифугируют при 5000 об/мин при 4 С в течение 30 мин, Осадок выбрасывают, надосадочную жидкость используют для гель-фильтрации. На уравновешенную 0,21 И раствором уксусно- кислого аммония (удельная электропроводность 15,5 - 10" Бсм-") колонку с сефадексом 0-100 сверхтонким (размеры колонки 4,2 х 140 см) наносят раствор яда. Колонку элюируют 0,21 И раствором уксуснокислого аммония с удельной электропроводностью 15,5 х х 10 3 Б .см-", рН 6,6, со скоростью 13 мл/ч и собирают Фракции по 19 мл. Оптическую плотность элюата регистрируют непрерывно с помощью,имеют активности оксидазы Ь-аминокислот, объединяют (объем 200 мл )и подвергают диализу до выхода 40 мл 5 желтого раствора белка с удельнойэлектропроводностью 1,810- Б . см,. 0,021 М. Доводят рН 20-ной уксуснойкислотой до 5,5Раствор Фермента наносят на урав- Ю новешенную 0,021 М раствором уксуснокислого аммония (удельная электропроводность 1,8 10 ЗБ см ") колонку карбоксиметилцеллюлозы КМ,Через колонку пропускают 0,5 л 5 0,021 И раствора уксуснокислого аммония рН 5,5 (удельная электропроводность раствора 1,810 зЯ .см " ).,Скорость элкации 45 мл/ч. Собираютфракции по 15 мл. Оптическую плот ность элюата регистрируют непрерывнос помощью "Увикорда". Во фракциях определяют активность оксидазыЬ-аминокислот (субстрат - Ь-лейцин),При ионообменной хроматографии наКМ-целлюлозе оксидаза Ь-аминокислотпроходит катнонит в данных условиях,а .остальные белки, имеющие изоэлект-рическую точку выше 5,3, связываются на катионит. Фракции, содержащие активности оксидазы Ь-аминокисЗ 0 лот, объединяют (выход 140 мл) иконденсируит при помощи диализа.Характеристика препарата: выход -85,1, степень очистки - 25,2 разаактивность оксидазы Ь-аминокислот 35 5,1 ед/мг белка.Концентрированный раствор фермента полностью сохраняет активность в течение 24 мес при температуре хранения 4 С.Определение активности оксидазы Ь-аминокислот.Активность фермента оксидазы Ь-аминокислот определяют с Ь-лейцином, который окисляется под действием Фермента до соответствующей За единицу активности оксидазыЬ-аминокислотпринимают количество Фермента, которое окисляют 1 мклоль 50 Ь-лейцина до аС-кетокислоты в мину.ту при 25 С, рН 8,5, Активность оксидазы Ь-аминокислот выражают посодержанию белка в препарате, которое определяется по методу Лоури. Технико-экономнческий эффект предлагаемого изобретения заключаетсявэкономии змеиного яда за счет увеличения качества Ферментного препарата (увеличение выхода, повышение щ степени очистки), Упрощается процесс очисТки оксидазы Ь-аминокислот из яда гюрзы, особенно этап ионообменной хроматографии.Оксидаза Ь-аминокислотможет быть использована для различных аналити1055769 Составитель О.СкородумоваРедактор Я;Егорова Техред В.Далекорей ЕорректорС, Шекмар Заказ 9239/21 Тираж 523 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж, Раушская наб., д. 4/5филиал ПЛП "Патентф, г. Ужгород, ул. Проектная, 4 ческих целей при изучении процес(сов транспорта аминокислот в процессесинтеза белка (инженергенетика), а 8также для препаративных целей - при синтезе тироксина, чистых 0-изомеров аминокислот и Ь-кетокислот.
СмотретьЗаявка
3419085, 07.04.1982
ОПЫТНЫЙ ЗАВОД ОРГАНИЧЕСКОГО СИНТЕЗА И БИОПРЕПАРАТОВ ИНСТИТУТА ХИМИИ АН ЭССР, ИНСТИТУТ ХИМИЧЕСКОЙ И БИОЛОГИЧЕСКОЙ ФИЗИКИ АН ЭССР
ТАРА АНТС АУГУСТОВИЧ, ААВИКСААР ЭЛЬМЕ ЭДГАРОВНА, ЯРВЕ ВИЙВЕ ЮЛИУСОВНА, СИЙГУР ЮРИ РОМАНОВИЧ
МПК / Метки
МПК: C12N 9/06
Метки: аминокислот, выделения, гюрзы, оксидазы, яда
Опубликовано: 23.11.1983
Код ссылки
<a href="https://patents.su/5-1055769-sposob-vydeleniya-oksidazy-aminokislot-iz-yada-gyurzy.html" target="_blank" rel="follow" title="База патентов СССР">Способ выделения оксидазы -аминокислот из яда гюрзы</a>
Предыдущий патент: Способ производства ускорителя созревания коньячных спиртов из древесины дуба
Следующий патент: Способ получения иммобилизованного гемицеллюлазного комплекса
Случайный патент: Гидропневматическое энергопоглощающее устройство