Способ получения фермента -1, 6 глюкозидазы
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
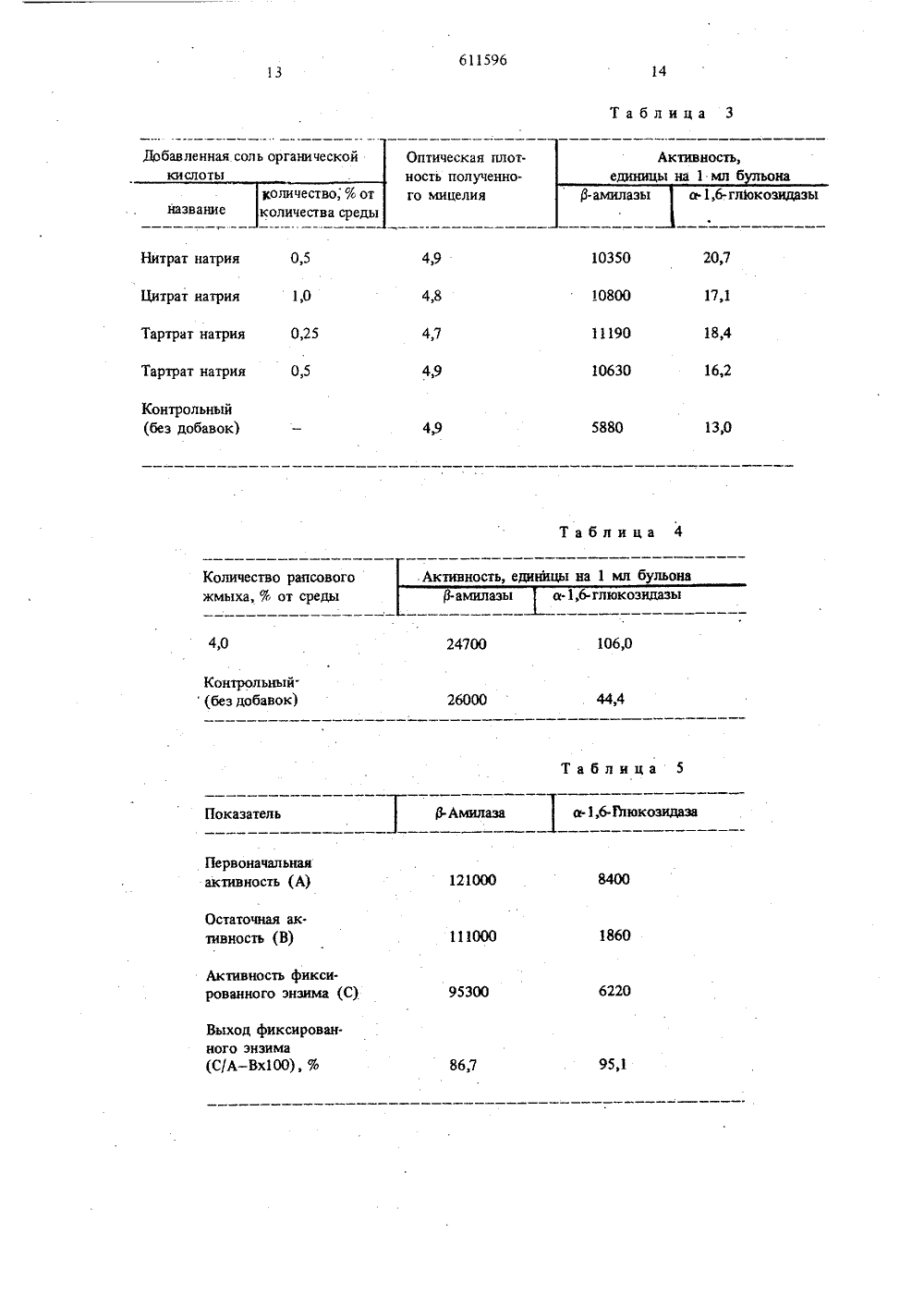
О П И С А Н И Е (и) 611596ИЗОБРЕТЕН ИЯ Союз Советских Социалистиыеских Республик(32) 11.01.74 (33) Япония осударственныи комитеСовета Министров СССРпо делан изооретенийи открытий 6465/74Опубликован юллетень22(72) Авторы изобретения Иностранцыиюки Такасаки и Есимаса Такахара(Япония) ттирмайенс энд Текнол Иностранная Эидженси оф Индастриал С(54) СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТА а - 1,6 - ГЛЮКОЗИДАЗЬ тозы создают различныения последовательно двухй. Все эти недостатки усидная разновидностьмером (1,1 - 1,4) х дящемся в длинной плесени или Аст. Изобретение относится к вопросам биохимии,а именно к способам получения а,б-глюкозидазыи 3-амилазы одновременно,Известен способ получения а,6-глюкозидазыпутем культивирования микроорганизмов, принадлежащих к роду Вас 11 цв на питательной среде, вкоторой в качестве источников углерода и азотаиспользуют продукты неполного гидролиза крахмала или мальтозы и гидролизат железа или смесьих с солью аммония 1). При этом поддерживаюттемпературу среды на уровне 30 С и рН 7,0 - 7,3,Известен также способ получения р.амилазыс помощью микроорганизмов, относящихся кразновидности Вас 11 цв, например Вас 1 цв роутпуха, Вас 11 цв гпедатеггцттт.Таким образом, известные способы получения 15а,б-глюкоэидазы и р-амилазы независимые, предусматривающие использование не одной и той жекультуры, а различных,Как известно, а,6-глюкозидазу и 3-амилаэуиспользуют при производстве мальтозы из крахмала, которое ведут двумя стадиями: на первой стадии обеспечивают воздействие на крахмал первогофермента, а на второй - второго.Таким образом, для получения указаннькэнзимов культивируют соответствующие микроорганизмы по отдельности, а при осушествленйи 25 процесса получения мальусловия для осуществлепроизводственных стадиложняют процесс.Целью изобретения является разработка спо. соба, обеспечивающего получение одновременно с ферментом а,6.глюкозидаэа фермента В-амилаза.Для достижения указанной цели из рода Ва с 11 цв для культивирования на питательной среде, содержащей источники углерода, азота и минераль ные соли, при работе по прецлагаемому способу используют штаммы Вас 11 цв сегецс чаг. вусов дев (ЕЕВМ У 2391) или ВасПцв вр. УТ 1002 (ЕЕВМ У 2837) или Вас 11 цв вр. УТ 1003 (ЕЕВМ Ио 2838) .Вас 1 цв сегецв была представлена Еегптепта топ ВевеагсЬ кпвттцте о 1 СцЬавЬ 1, .Ърап соглас. но . ЕЕВМ У 2391 20 декабря 1973 г, Вас 11 цв вр. УТ 1002 и ВасИцв вр. УТ 1003 были представлены этим же институтом 12 декабря 1974 г согласно ЕЕВМ У 2837 и ЕЕВМ Иф 2838.Ниже представлена характеристика этих мик. роорганизмов.Вас 1 цв сегецв лино(ЕЕВМ Мо 2391)Палочка разх (4,2 - 7,0) мкм, обычно нахоили короткой цепи подобноповусез, Неподвижная, грам-положительная, спорзигии беэ ощутимого разрастания.Питательный бульон. Хороший рост, осадок.Питательный косой агар. Обильное прорастание.филаментный, распределен по поверхности, кремовато-белый.Глюкозо-аспзрагиновый агар. Нет хорошегороста. филаментный.Глюкозо-нитратный агар. Нет роста, а еслиесть - очень незначительный.Тиразиновый косой агар. Хороший рост,филаментный, слегка коричневый,Использование цитрата. Положительное,Молоко, Пептонизация.Картофель. Хороший рост, желтовато-белый,слегка коричневый.Желатин, Разжижает.Получение аммиака, Положительное,Получение ацетилметилкарбинола. Положительное.Восстановление нитрата до нитрита. Отрицательное,Каталаза. Положительная,Получение индола. Отрицательное,Гидролиз крахмала. Положительный,Бульон с 1 чаС 1, В бульоне с 4% йаС не развивается.Вас 1 оз вр. УТ 1002 (АТЕЯМ Х 2837).Палочка размером (1 - 12) х (5 - 6) мкм, не.подвижная, грам-положительная, встречающаясяв виде короткой или длиагой цепи.питательный бульон. Осадок.Питательный косой агар. Незначительныйрост.Молоко, Медленная пептонизация.Картофель. Хороший рост, распределяетсяпо поверхности, желтовато-белый.Желатин. Разжижение.Получение аммиака. Положительное.Восстановление нитрата в нитрит. Положитель.ное.Каталаза. Положительное.Ацетилметилкарбонил. Производится.Цитрат натрия, Незначительный рост.Органический источник азота. Необходим для роста.Карбогидрат. Из глюкозы, фруктозы, гзлактозы, маннозы, лактозы, сорбита, глицерина, трегапоэы, крахмала и гликогена образуется кислота, а не газ.Температура роста. Произрастает при темпера. туре не выше 50 С, оптимальная температура 30- 35 С.Эта культура выделена иэ почвы.Вас 11 цз зр. УТ 1003 (АТЕЯМ Мф 2838).Палочка размером (1-1,6) х (2 - 7)мкм, неподвижная, грам-положительная, встречается в ви. де короткой или длинной цепи.Питательный бульон. Хороший рост, образу 10 15 Питательньй косой агар. Хороший рост, рас.пределяется по поверхности, желтовато-белый.Глюкоза. аспарагиновый агар, Незначительныйрост.Молоко. Пептонизация без коагуляции.Желатин. Медленное разжижение.Получение аммиака. Положительное.Ацетилметилкарбинол. Производится,Цитрат. Используется как источник углерода.Карбогидрат. Глюкоза, фруктоза, галактоза,манноза, а-арабиноза, О-ксилоза, лактоза, сукро.за, мальтоэа, трегалоза, раффиноза, маннит, сорбит, глицерин, инсулин используются без образо.вания газа.Температура роста. Максимальная 45 С, оп.тимальная 30 - 33 С,Культура выделена из почвы.Предлагаемый способ заключается в следую.щем,Одну из указанных культур культивируютв среде, включающей источники углерода и азота,В качестве первых используют мальтоэу, крахмал,гидролизаты последнего (декстрин), в качествевторых - пелтон, казеин, экстракты мяса, црож 25 жей, воду после эамачивания зерна, сено, соевыйжмых.Источники азота при необходимости пополняют неорганическими солями - фосфатом, сольюмагния, солью бария и солью кальция.30 В случае использования воды после замачивания зерна из нее предварительно удаляют вещество, ингибирующее образование Д-амилазы.Для увеличения выхода а,6-глюкоэидзэыи 13-амилаэы добавляют в среду соли марганца илиЗ различные его соединения, например сульфат мар.ганца. В первом случае соли марганца добавляютв среду в количестве порядка 1 х 10- 1 х 10 моля,во втором случае соединение марганца добавляетв среду в количестве порядка 1 х 10 моля.40 В среду добавляют цитрат и/или тартрзт в количествах порядка 0,01 - 1%. При использованиицитрата или тартрата натрия их вносят в среду вколичестве 0,1%. В среду добавляют также (дляувеличения выхода ферментов рапсовое семя,45 рапсовый жмых, экстракт,Культивируют бактерии в условиях аэрациипри 20 - 40 С в течение 24 - 72 чзс,При культивировании рН среды меняетсяот 5,5 до 9,5, оптимальное значение 6-8,20 50Полученные энзимы имеют ячеистую структуру, Их регенерируют фильтрацией культуральнойжидкости, затем фильтрат концентрируют путемдобавления ацетона, этанола, метанола или изопропанола и образования осадка, Для осажденияприменяют также сульфат аммония. Получаютр-амилаэу и а 1,6-глюкозидазу в смеси в виде оса 1 тка, насыщенного сульфатом аммония.Для регенерации ферментом используют также такие здсорбенты, кзк крахмал, зктивировзн.г тв 3тов с помощью крахмала улучшается, если егопредварительно нагреть до 40 - 65 С.Адсорбированную Р-амилазу злюируют раствором, содержагцим 1 - 10% мальтоэы, или раствором, содержащим растворимьгй крахмал, декстрин,мальтозу, Адсорбированные на активированномутле энзимы могут использоваться как связанныеэн зимы.Так, Р амилаза адсорбнруется в количестве8000-12000 единиц, а а,6-глюкозидаза в количестве 500 - 1000 единиц на 1 г активированного угля. Адсорбированные энзимы сохраняют свою активность на уровне 90 - 100% от ее первоначальногозначения.Ферменты хорошо адсорбируются и на диатомовых веществах, например перлите, и сохраняютв таком состоянии активность на высоком уровне(50 - 7 от первоначального значения) .Характеристики энзимов - Р-амилазы и а.глюкозидазы, полученных описываемым способом, приведены ниже.Р-,Амилаза.Действие, Энзим производит мальтозу изкрахмала, амилозы, амилопектина, гликогена, декстрина и др. 25Специфичность в отношении воздействиясубстрат. Степень гидролиза мальтозы в амилозуближе к 100% и крахмала в мальтозу к 6. Энзим не гидролизует а,б-глюкозидазную связь, ко.торая содержится в амилопектине, гликогене, дек- ЗОстрине и т.п.рН реакции составляет 3 - 10, оптимальноезначение около 7,0,Температура реакции до 65 С, оптимальнаяоколо 50 РС. 35Дезактивация, Около 20% активности теряется через 10 мин пребывания при 55 С. При 70 Счерез 10 мин наступает полная дезактивация.рН - Устойчивость. Энзим неустойчив в кислойсреде при рН ниже 5,0. Стабилен в интервалерН 610,0.Ингибирование. Ингибируется и-хлормеркурбензоатом и в некоторой степени монойодацетатом.Активность после ингибирования и- хлормеркурбензоатом восстанавливается путем добавления45цистеина.Ф+Сильно ингибиоуется ионами Сгг Н 9 А 9,а также ионом ЕеСпособ очистки. Энзим фракционируют путемосаждения из культурального бульона в результатенасыщения 30 - 5 сульфата аммония с последующей высокоэффективной очисткой на хроматографической колонке с использованием ЗерЬадех6-100.Измерение активности энзима. Энзимный55раствор вносят в 2 мл 0,1 И раствора фосфатно.го буфера (рн 7,0), содержащего 2,0% растворимогокрахмала, и доливают дистиллированную воду дообщего объема 4 мл. Смесь инкубируют при60Ял Г О ие лътаь ъаггзтлаФО зг(ътгътъОР ОРййч 1 час с о начала реакции производит 1 мг мальтозы, обозначают как 1 единица.а 1,6- Глюкозидаза. Действие. Этот энзим гидролизует а.1,6-глю.козидазную смесь амилопектина, который ужебыл в некоторой степени гидролизован р-амилазой,Специфичность по субстрату. Энзим производит мальтотриазу путем гидролиза Ь. 1,6- глюкозидазной связи пуллулана, В случае реакции с амилопектином не наблюдается усиления йодной кра.сящей способности, Энзим проявляет активность наамилопектине, предварительно гидролизованномв некоторой степени р-амилаэой. Энзим не действует на изомальтозу.рН реакции в пределе 5 - 10, оптимальноезначение около б - 6,5.Температура реакции около 50 С, оптимальная около 50 С,Дезактивация. Около 50% активности теряется после 10-минутной выдержки при 50 С, Полная дезактивация наступает через 10 мин пребывания при 65 С.рН-Стабильность. Энзим устойчив при рН 6-9,нестабилен в кислой среде и относительно устойчив в щелочнои.Ингибирование. Энзим в некоторой степениингибируется и- хлормеркурбензоатом и незначи.тельно. - монойодацетатом, Значительное ингибиру.ющее действие оказывают ионы Ня и Ац, инги г+бируется также ионом ЕеСпособ очистки. Энзим фракционируют изкультуральной жидкости путем осаждения 60 - 70%сульфата аммония с последующей очисткой иахроматографической колонке с использованиемЯерЬас 1 ех 6-100,Измерение энзимной активности. Активностьизмеряют по реакции, при которой в качестве суб.страта используют пуллулан. Энзим производитиз пуллулана мальтотриозу. Йпя этого некотороеколичество энзима добавляют к 0,5 мл 0,1 М рас.твора фосфата буфера (рН 7,0), содержащего 1%пуллулана, Смесь доводят до общего объема ио.рядка 0,1 мл дистиллированной водой. Затем ееинкубируют при 40 С в течение 60 мин, Количест.во энзима, которое производит 1 мг мальтотриозы,обозначают как 1 единица.Из препарата можно независимо выделитьр-амилазу и а,6-глюкозидаэу. Для этого жид.кость насыщают сульфатом аммония до концентра.ции 30 - 50%. Происходит осаждение 13-амипазы. За.тем насыщают жидкость сульфатом аммония доконцентрации 60 - 70%. При этом осаждается второй энзим. Полученные энзимы очищают на колонке, заряженной ЯерЬадех.П р и м е р 1. В эрленмейеровскую колбуемкостью 200 мл помещают 50 мл среды, содержащей 1% пептона 0 3 КНРО 4, 0,1 Мд 8047 НОи 1 мальтозы. Стерилизуют обычным способом, всреду вносят микоиды разновидности ВасНцвдю (ЕЕВМ йо 2391) и культивируют при 30 Св ечение двух дней, После культивирования изкультурального бульона центрифутированием удаляют клетки, Затем всплывающий слой исследуют для определения количества полученных знзимов. В результате было получено 628 единиц 1-амилазы и 18 единиц а,б-гликоэидазы, считаяна 1 мл среды.Культуральный бульон помещают в целлофановую трубку и диализируют по отношению кдистиллированной воде для того, чтобы удалить остаточный сахар.Часть указанных диализированных энзимов(в которых содержалось 204 единицы 1.амилазы и5,6 единиц а,6-глюкозидазы) приводят во взаимодействие с картофельной амилазой, амилопектином картофельным крахмалом, гликогеном и декстрином, каждый из которых был взят в концентрации 4% при рН 7 и 40 С (общий реакционныйобъем составлял 4,3 мл).Через постоянные промежутки времени отбирают пробы реакционного раствора, каждую из которых. берут в постоянном количестве, и в нихопределяют количество редуцирующего сахара пометоду Зопюду йезоп. Состав сахара в реакционной смеси определяют с помощью метода хромато.графин на бумаге (4 ч. пиридина, б ч. бутанола и3 ч, воды). В результате установлено, что образовавшийся сахар почти полностью представляет собоймальтозу (90 - 96%), в том случае когда амилоза,амилопектинкартофельный крахмал использова. З 0лись в качестве субстрата и в конечном реакцион.ном растворе наблюдали очень небольшое количествосахара, имеющего Я 1, соответствующий мальтотрио.зе (4 - 8%). В результате испытания с помощьюНцсоятат (производимого ЧогтЬпдгоп ВосЬеписа ЗЗСогрогатоп 0.8 А ) было установлено, что образование глюкозы происходит в чрезвычайно небольшом процентном количестве (менее 0,1%). Картофельная амилаза, амилопектин, декстрин и картофельный крахмал, испытанные таким образом, 40практически нацело гидролизуются в мальтозу через 8 час реакции. Гликоген также гидролизуетсяне менее чем на 90% в мальтозу через 23 час реакции,Пример 2, Всреду,имеющувтакой жесостав, 45что использовался в примере 1, инокулируют Васца;ар. УТ 1002 (РЕЯМ Мо 2837) и подвергают культивированию со встряхиванием при 30 С, Через48 час культивирования в культуральном бульонеопределяли количество образовавшихся энзимов. 50Было получено 121 единица 1-амилазы и 10,5 единиц а,6-глюкозидазы на 1 мл бульона.П р и м е р 3. В среду того же, что и в примере,1, состава инокулируют ВасИца ар,УТ 1003 (РЕЯМ У 2838) и подвергают культивированию со встряхиванием при 30 С, Через 48 час культивиро. вания в культуральном бульоне определили количество образовавшихся энзимов, В результате получено 152 ч, Д-амилаэы и 5,3 ч. а,6-глюкоэидазытюл 1ак Йен лтвл П р и м е р 4. В колбу емкостью 1 л помещают 250 мл среды, содержащей (%) 1 полипептона, 0,3 Кэ НР 04, 0,1 МдВ 047 Н,Ь и 1 декстрина, и подвергают ее стерилизации по обычнойметодике. Затем среду инокулируют микоидамиразновидности Васцз сегецз и проводят культивирование ее встряхиванием при 30 С. Через 48 часкультивации культуральный бульон центрифугируют для удаления клеток и полученный всплыв.ший слой испытывают на энзиматическую актив.ность.Было получено 420 единиц 3-амилазы и7,8 единиц а,6.глюкозидазы на 1 мл бульона,В 200 мл (часть указанного культурального бульо.на) вносят до 75% сульфата аммония и полученную в результате осажденную фракцию центрифугируют и растворяют в небольшом количествеводы, а полученный в результате раствор испытывают на энзиматическую активность, В результатеполучено 83000 едщпщ Д-амилазы и 952 единицыа,б-глюкозидазы,П р и м е р 5. Часть раствора знзима, по.лученного в примере 1 и. состоящего из 10000 единиц 1-амилазы и 275 единиц а,6.глюкозидазы,приводят во взаимодействие с 1 г амилопектинапри концентрации 1% в присутствии 5 х 10 зМ СаСэ,Реакция протекает при 40 С, рН среды при этомподдерживают на уровне 7. Редуцирующий сахарв реакционной смеси определяют по методикеБороду Меакоп, Получено 972 мг мальтозы. Количество полученной глюкозы составило 3,7 мг.Путем бумажной хроматографии обнаружено пятно мальтозы и пятно, соответствующее очень небольшому количеству мальтотриозы.П р и м е о б. Приготовляют среду, содержащую (%) 1 полипептона, 1 декстрина, 0,3 КНР 04и 0,1 МдЯО, 7 Н,О, а также среду, полученную врезультате добавления к укаэанной среде раэлич.ных количеств (1 х 10 7 - 1 х 10 змоли) сульфатамарганца, как показано в табл, 1. Эти среды номе.шают (каждую объемом 50 мл) в эрленмейеров.скую колбу объемом 200 мл и стерилизуют пообычной методике. После этого среды инокулируют микоидами равновидности ВасПцз сегеца иподвергают культивированию в условиях аэрациипри 30 С в течение 42 час.После культивирования культуральный бульонцентрифугируют и верхний слой подвергают испы.танию на содержание образовавшихся 5-амилазыи а,6.глюкозидазы. Результаты представлены втабл, 1,Как следует из табл. 1, добавление сульфатамагния повышает количество полученной а.1,6-глюкозидазы приблизительно в 3 раза,П р и м е р 7. В эрленмейеровские колбыемкостью 200 мл помещают 50 мл среды, содержащей (%) 1 полипептона, 0,3 КэНРО 4 и 0,1 МдВ)4 кх 7 НэО, и стерилизуют. Затем среду инокулируютмикоидами разновидности Вас 1 цэ свгецз и под30 С. На 24-м часу культивирования, когда коли.чество 3-амилазь составило 237 единиц на 1 мл среды, в среду стерильно добавляют сульфат марганцав количестве 1 х 10 ", считая на количество среды,и продолжают культивацию.На 42-м часу культивирование прекращают,Культуральный бульон центрифугируют для удаления из него клеток и полученный в результатевсплывший слой испытывают на р амилазную и а,6-глюкоэидазную активности. Результаты этогоиспытания представлены в табл. 2.Соль марганца, добавленная в среду в серединекультивирования, повышает количество полученнойа,6-глюкозидазы приблизительно в 1,7 раза иблагоприятствует образованию 13-амилазы. Когдакультивирование осуществляют в среде, содержащей марганцевую соль с самого начала, количествополученной а,6-глюкозидазы повышается приблизительно в 2 раза по сравнению с количеством,которое может быль получено без добавления соли дмарганца, а количество полученной 13-амилазы понижено, всего лишь 28,8 единиц на 1 мл,П р и м е р 8. Готовят среду, содержащую(%) 2 полипептона, 0,3 К 2 НРО, 0,1 Мд 807 Н 20и 5 10 4 М СаС 12, а также среды, полученные в результате добавления к указанной среде цитратанатрия в количествах, соответствующих концентрации 0,5 и 1%, и среды, полученные в результатедобавления тартрата натрия к укаэанной среде в .количествах, отвечающих концентрации порядка ЗО0,25 и 0,5%. В эрленмейеровские колбы емкостью200 мл помешают среды (в количестве 50 мл)и стерилизуют по обычной методике. В средыинокулируют микоиды разновидности Вас 1 озсегеа и подвергают их культивированйю при 30 Св течение 42 час.Затем культивируют, жидкость из каждойколбы центрифугируют и полученный в результатевсплывший слой подвергают пробе на определение 3-амилазной и а,6-глюкозидазной активности.4 оПолученные в результате данные представлены втабл, 3. В том случае, когда культивирование осуществляют в среде, содержащей рапсовый жмых, 45 количество полученной а,6- глюкоэидазы приблизительно в 2,4 раза превышает то количество, которое получается в среде, не содержащей рапсового жмыха,50Культуральный бульон, полученный в результате культивации в среде, содержащей рапсовый жмых, центрифугируют для удаления клеток. 2 л полученного всплывшего слоя объединяют с 4 л холодного этанола. Полученный осадок отделяют фильтрацией, а затем сушат. В результате получен порошкообразный энзим, состоящий из 115800 еди. ниц 13.амилазы и 4640 единиц а,6-глюкозидазы на 1 г, что указывает степень регенерации 33-амилазы 75%, а степень регенерации а,6.глюкозщазь -Добавление солей органических кислот заметно повышает количества полученных 3-амилазыи а,6-глюкозидаэы,П р и м е р 9. В два баночных ферментатора емкостью 10 л помещают среду, содержащую(%) 4 молочного казенка, 0,3 КтНРО 4 и 0,1 Мд 80,Хл 7 НО и 5 10 М СаС 1, а также 0,5 растворимогокрахмала, причем в каждый ферментатор загружа.ют по 0,5 л, В один из двух ферментаторов добавляют рапсовый жмых в количестве, соответствующем 4%, считая на вес среды, Затем среды двухферментаторов стерилизуют 30 мин при 121 С.После этого среды инокулируют микоидами разновидности Вас 111 ца сегез (100 мл) и осуществляют культивирование в условиях аэрации при 30 Спри подаче воздуха с объемной скоростью порядка 5 мин при перемешивании со скоростью порятка 250 об/мин. Через 24 час культивации культуральный бульон центрифугируют и полученный врезультате всплывший слой подвергают испытаниюна энэиматическую активность, Полученные ре-зультаты представлены в табл. 4,Нагревают до 60 С 30 мин. К полученномураствору добавляют 300 мл фильтрата культурымикондов разновидности Вас 11 иа сегеов. Фильтратимеет рН 7, 1403 единицы Р-амилазь. на 1 мл и 28,0единиц а,6-глюкозидазы на 1 мл. Смесь перемешивают для адсорбирования двух энэимов.Затем смесь отфильтровывают для регенерации энзимов и испытывают 3 а активность. Полученные результаты представлены в табл. 5. Затем смесь крахмала и целита, на котором были адсорбированы оба энзнма, добавили к 10%- ному водному раствору декстрина, содержащему 10% хлористого натрия. Это делают, чтобы осуществить злюирование энзимов с адсорбентов, В результате 3.амилазу и а.1,6-глюкозидазу регенерировали с выходами 100 и 85% соответственно.П р и м е р 13. Фильтрат (каждый объемом 100 мл) культуры микоидов разновидности Вас 11- 1 оэ сегеоз, содержащей 758 единиц 3-амилазы и 37,1 единицы а,6-глюкозидазы на 1 мл, смешивают с 5 г каждого из следующих веществ: кислой глины, бентонита, талька, целита и перлита сцелью адсорбции а,6-глюкозидазы.Адсорбированный знзим регенерируют филь.трацией или центрифугированием, пцательно промывают водой и затем определяют его активность Полученные результаты представлены в таблице .Как видно из приведенных данных, а.1,6- -глюкозидаза удовлетворительно адсорбируется всеми адсорбентами, количество адсорбированного энзима 400 - 700 единиц на 1 г.П р и м е р 14. К 100 г (вес сухого вещества) сжиженного крахмала с декстрозиым эквивалентом 1,5% добавляют 30000 единиц р-амилаэы, 3000 единицы а,6-глюкозидазы и 0,73 СаС 12. Смесь разбавляют до общего объема пдапа гг мп ддггедяют пд ю Г я нгтйндйпи- о611596 12 вают рН в интервале 6 - 6,5. В этих условиях осуществляют реакцию. Через 100 час в реакционной смеси определяют состав сахара методом буТаблица 1 Количество добавляемог сульфата марганца, моль Оптическая плот- ость полученного мицелия (660 нм,7 1 х 1036,8 х 10-4 22,5 1 х 10-4 5 25,0 МДобавлено к концу 24- 4 4(- Добавлено в начале аса культивирования. культивирован Кншчестводобавляемогосульфата мар. ганца, моль Время культивирования, час Оптическая плотность полученногомицелия (600 нм) мажной хроматографии. Сахар содержал (%) 90,6мальтозы, 7,1 мальтотриозы, 0,0 глюкозы и 2,3других сахаридов,611596 14 4 350 10 17,1 трат на 25 18,4,9 880 9 13,0 4 Табли апсов ого 106,0 аб Амил Покаэате 121000 186 95 95,трат натрия артрат натрия Тартрат натрия О Контрольнь (без добав Количеств жмыха, % Контрольный (без добавок Первоначальнаяактивность ( Остаточная тивность (В тивность фикси.ванного энзима ( Выход фиксированного энзимаС/А-ВХ 1 00), % птическая плотость полученноо мнцелия Таблица 3611596 15 Таблица 6 Вещество Кислая гли а 612 700 Бентонит 648 694 416 Тальк ЦелитПерлит 492 0 0 Составитель М, Андреева Техред Е. давидович Корректор С Шекмар Редактор Е. Корина Тираж 568 Подписное ПНИИПИ Государственного комитета Совета Министров СССРЗаказ 2943/49 Филиал ПЛП "Патент". г. Ужгород, ул. Проектная, 4 Формула изобретения Способ получения фермента а,6-глюкозидазы путем культивирования микроорганизма рода Ва. с 111 ца на питательной среде, содержащей источники углерода, азота и минеральные соли, о т л ич а ю щ и й с я тем, что, с целью получения одновременно с указанным ферментом фермента 11-амилазы, из микроорганизмов Вас 111 ца используют штаммы; Вас 111 ца сегеца айаг.вусоа 1 с 1 еа (РЕЯМ Х 2391) или Вас 111 ца ар. УТ 1002(РЕЯМ Иа 2837) или Вас 111 ца ар. УТ 1003 (РЕЯМУ 2838),Источники информации, принятые во вниманиепри экспертизе:1. Патент Великобритании У 1281093,кл, С 3 Н, 1972.
СмотретьЗаявка
2101415, 10.01.1975
ЕСИЮКИ ТАКАСАКИ, ЕСИМАСА ТАКАХАРА
МПК / Метки
МПК: C12D 13/10
Метки: глюкозидазы, фермента
Опубликовано: 15.06.1978
Код ссылки
<a href="https://patents.su/8-611596-sposob-polucheniya-fermenta-1-6-glyukozidazy.html" target="_blank" rel="follow" title="База патентов СССР">Способ получения фермента -1, 6 глюкозидазы</a>
Предыдущий патент: Способ одновременного получения ингибитора протеазы и гепарина
Следующий патент: Способ культивирования
Случайный патент: Способ опорожнения участков трубопроводов в многониточных системах газопроводов