Способ обработки гидроксидных осадков, содержащих тяжелые металлы
Похожие патенты | МПК / Метки | Текст | Заявка | Код ссылки
Текст
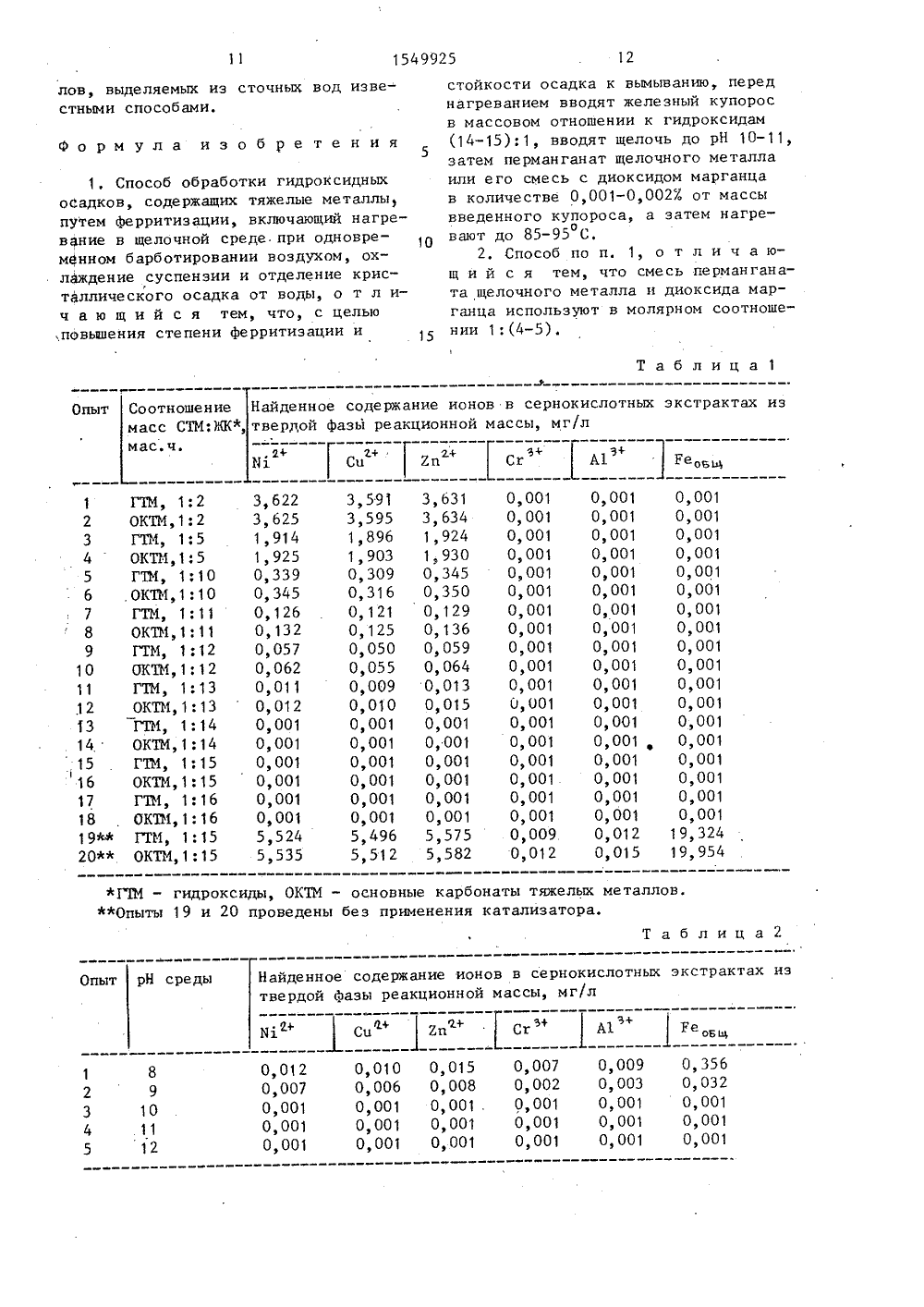
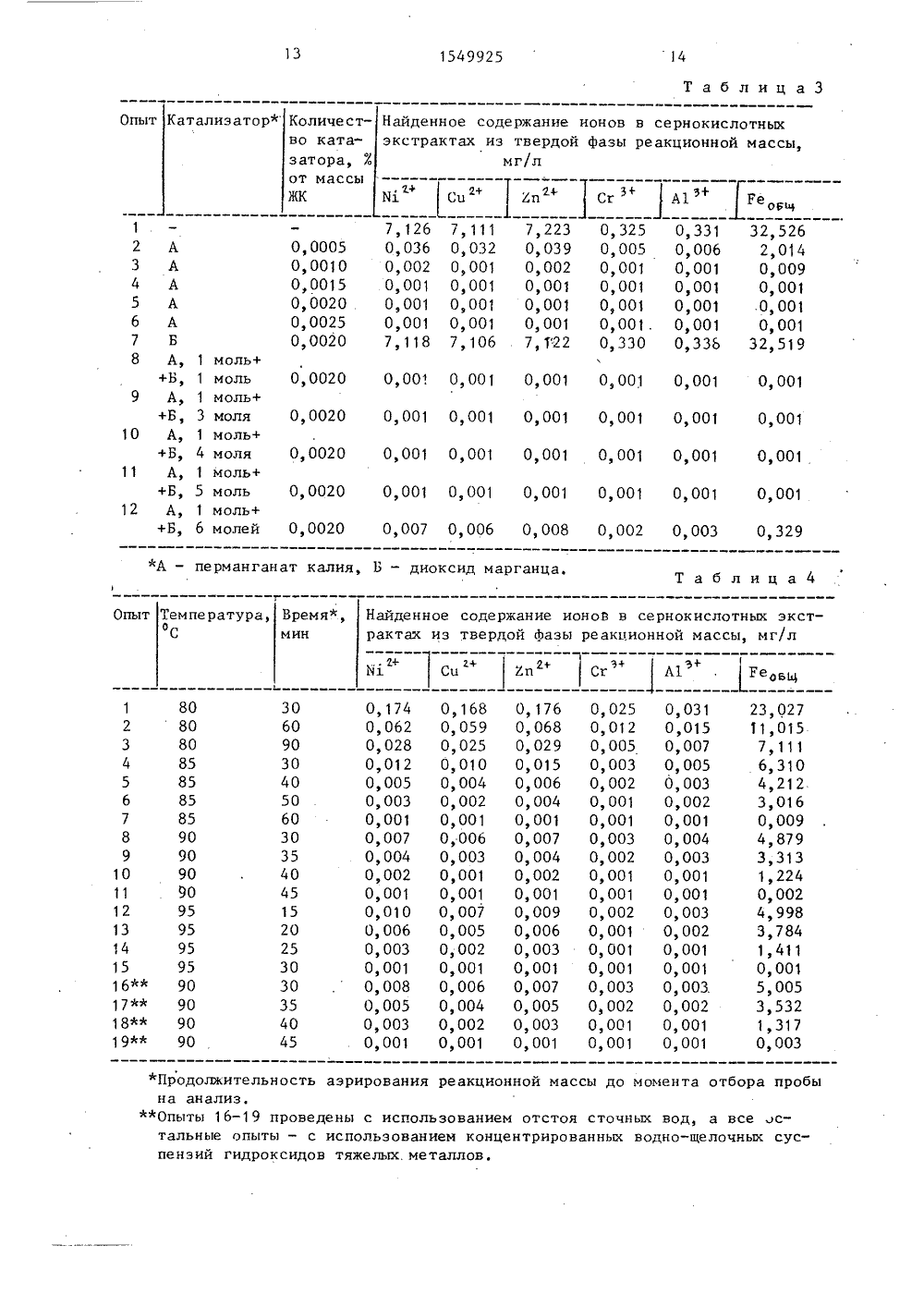
/23-26 одами и ии гидр гидрок ый купо идрокси суммарному содежелых металловвание ведут доманганат щелочно ржанию (14-15 рН 101, подщела и вводят лла или егИ водных о загрязненентами ных вод выше емых из сточспособам обраков, образуюыде садков в част сти тки гидроксидных осихся при очистке сто чных вод от иои предназначепредприятияхлургии, а такжительной,ругих отраслествляющих провод от ионов гидроксидным и/или способами. ов тяжелых металлов, ля использования на ерной и цветной метал имической, машиностро лектротехнической и д ромышленности, осуще ессы очистки сточных е тяжелых металл оксикарб он атнь ГОСУДАРСТВЕННЫЙ НОМИТЕТПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМПРИ ГКНТ СССР 4385848(71) Всесоюзный научно-исследователь ский институт по охране вод(54) СПОСОБ ОБРАБОТКИ ГИДРОКСИДНЫХ ОСАДКОВ, СОДЕРЖАЩИХ ТЯ)КЕЛЫЕ ИЕТАЛЛЫ (57) Изобретение относится к охране водных объектов окружающей среды от загрязнения высокотоксичными компонентами осадков, выделяемых из сточных вод, в частности к способам обра ботки гидроксидного осадка, образующегося при очистке сточных вод от ио нов тяжелых металлов. Целью изобретения является повьшение стойкости тение относится к охранеъектов окружающей средыия высокотоксичными комп а к вымыванию кислыми природнымиповышение степени ферритизаоксидов тяжелых металлов.сидный осадок вводят желеэрос в массовом отношении к смесь с диоксидом марганца в количестве 0,001-0,002% от массы введенного железного купороса. Образующуюся приО этом суспензию нагревают до 85-95 С и выдерживают с одновременным барботированием воздухом до полного окончания процесса ферритизации, после чего суспензию охлаждают, кристаллический осадок отделяют от воды и напоавляют на захоронение. 1 з,п, ф-лы, 4 табл. Целью изобретения является повыние стойкости осадков к вымыванию кислыми природными водами и по ние степени ферритизации осадков.Для осуществления способа гидроксидные осадки, образующиеся при очистке сточных вод от ионов тяжелых металлов, нагревают в щелочной среде с одновременным барботированием воздухом, охлаждают образовавшуюся суспензию и отделяют кристаллический осадок от воды, причем перед нагреванием вводят железный купорос в количестве 14-15 мас.ч. на 1 мас,ч. гидроксидов, затем подщелачивают до рН 10-11 и вводят катализатор процесса Ферритизации в количестве 0,001 О,002% от массы введенного железногокупороса, образовавшуюся при этомосуспензию нагревают до 85-95 С и5выдерживают при указанной температуре с одновременным барботированиемвоздухом до полного окончания процесса ферритизации, после чего суспензво охлаждают, кристаллический осадок отделяют от воды известным способом и направляют на захоронение,В качестве катализатора процессаферритизации используют перманганатщелочного металла или его смесь с ди оксидом марганца в молярном соотношении 1:(4-5).В процессе сложного химическогопроцесса из смесей гидроксидов и/илиосновных карбонатов двухвалентныхтяжелых металлов, содержавшихся висходном осадке сточных вод, и избытка соли двухвалентного железа образуется смесь ферритов тяжельче ме)талло в общей Формулы Ие ОГе О з . 25Если в исходном отстое сточныхвод помимо гидроксидов и/или основныхкарбонатов двухвалентных тяжелых металлов (никеля, кадмия, меди, цинкаи др,) содержались гидроксиды трехвалентных тяжелых металлов (например,хрома и/или алюминия), то в продуктах обработки отстоя предлагаемымспособом наряду с Ферритами двухвалентных тяжелых металлов присутствуют хромиты,(Ие ОСгО ) и алюминатыИ 3Иг з(11 е 0 фА 10) тех же металлов,Подобно Ферритам тяжелых металловхромиты и алюминаты при обычной температуре практически нерастворимы вразбавленных водных растворах сильных минеральных кислот, что обусловлено одинаковым строением их кристаллической решетки. Это обеспечиваетвозможность безопасного. захоронения45осадков смеси соединений тяжелых металлов, образующихся при обработкегидроксидного осадка сточных вод предложенным способом. Наиболее целесообразными местами захоронения такихосадков являются отработанные карьерыпо добыче железной и полиметаллических руд, где такие природные соединения тяжелых металлов уже имеются.При соблюдении необходимых условий полная Ферритизация смеси гидроксидов и/или основных карбонатов тяожелых металлов достигается при 85 Соза л.1 ч, а при 95 С - за 30 мин. Однако продолжительность процесса ферритизации соединений тяжелых металлов в отстое сточных вод предлагаемым способом не может служить параметром, определяющим полноту протекания этого процесса, поскольку состав и реакционная способность содержащихся в гидроксидном осадке соединений тяжелых металлов непостоянны. В лабораторных условиях о полноте протекания процесса ферритизации можно с достаточной степенью точности судить поотсутствию в твердой фазе реакционноймассы компонентов, растворимых приобычной температуре в разбавленныхводных растворах сильных минеральныхкислот, например в 0,0001 И растворесерной кислоты,Использование железного купоросав количестве, меньшем 14 мас.ч. на1 мас.ч. суммы гидроксидов,не обеспечивает полноты осаждения. Использование железного купороса в количествеболее 15 мас,ч, допустимо, но нецелесообразно, поскольку на свойствах получаемого осадка это заметно не отра -жается, а приводит лишь к неойравданному перерасходу железного купороса.При создании в обрабатываемом осадке сточных вод рН среды меньше 10существенно возрастает продолжительность процесса Ферритизации, а этоприводит к неоправданному перерасходутепловой энергии на обработку. Создание в осадке рН среды больше 11 при прочих равных условиях к заметному сокращению продолжительности процесса ферритизации не приводит, а обуславливает лишь неоправданный перерасход щелочного реагента.В отсутствие катализатора скоростьпроцесса ферритизации смесей гидроксидов и/или основных карбонатов тяжелыхметаллов относительно невелика: за 1 ч,при 95 С и прочих равных условиях Ферритизации подвергается не более 30%массы исходных соединений тяжелыхметаллов,Применение в качестве катализаторапроцесса ферритизации перманганатащелочного металла, в частности перманганата калия, в количестве меньше0,001% от массы железного купоросаприводит к существенному уменьшениюскорости процесса Ферритизации. Применение перманганата калия в количестве больше 0,02% от массы железногокупороса к дальнейшему заметному со5 154992кращению продолжительности процессаферритизации не приводит, а обуславливает лишь перерасход самого катализатора.5Диоксид марганца в отсутствие перманганата калия заметного каталитического действия на процесс ферритиэации смеси гидроксидов и/или основных карбонатов тяжелых металлов в 1 Оконцентрированных водно-щелочных суспензиях не оказывает,но смесь 1 мольперманганата калия и 4-5 моль диоксида марганца по каталитической активности приближается к активности чистого перманганата калия,Важным условием достижения полноты Ферритизации смесей гидроксидови/или основных карбонатов тяжелых металлов является непрерывное продувание воздуха в реакционную смесь напротяжении всего процесса Ферритизации. При перерывах в подаче воздуха(например, в аварийных ситуациях),для возобновления процесса ферритизации нужен некоторый индукционныйпериод или введение дополнительногоколичества катализатора (5-101. отпервоначального количества). Это может быть объяснено тем, что процесс 30окислительно-каталитической Ферритизации смесей гидроксидов и/или основных карбонатов тяжелых металлов вприсутствии кислорода воздуха имеетцепной характер: дополнительное вве 35дение катализатора необходимо для зарождения новых реакционных цепей.В отстое предварительно определяют суммарное содержание гидроксидов,после чего вводят рассчитанное количество железного купороса, подщелачивают, прибавляют катализатор процессаФерритизации и нагрев суспензии дозаданной температуры, выдерживают еепри непрерывном продувании воздухадо полного окончания процесса, Затемреакционную массу охлаждают до обычной температуры, осадок смеси соединений тяжелых металлов отделяют отводы и направляют на захоронение.П р и м е р 1. Определение опти- .мального количества железного купороса для достижения полноты Ферритиза-,ции соединений тяжелых металлов вводно-щелочных суспензиях,В эмалированный бак, снабженныйкольцевым барботером и контактнымтермометром, помещают 5 л 0,1 И раствора железного купороса и при не 5 6прерывном барботировании воздухом(скорость 5 л/мин) вносят небольшимипорциями заданное количество влажного осадка смеси гидроксидов или основных карбонатов тяжелых металловс известным содержанием суммы сухихвеществ,Образовавшуюся суспензию, не прекращая барботирования воздухом, подщелачивают химически чистым едким натром до рН 11, затем приливают 27,8 мл1%-ного раствора перманганата калия(0,0023 от массы железного купороса),опосле чего нагревают до 95 С и выдерживают при этой температуре до полно"го окончания процесса ферритизации,о чем судят пе минимальному содержанию ионов тяжелых металлов в сернокислотном экстракте из проб твердойфазы реакционной массы, Продолжительность процесса ферритизации -1 ч.Для определения конца ферритизации,останавливая процесс через данныепромежутки времени, отбирают пробыобъемом 100 мл,.охлаждают их проточной водой и фильтруют, Осадок нафильтре промывают дистиллированнойводой до отсутствия в промывной водещелочной реакции, затем снимают сФильтра и, не подвергая высушиванко,перемешивают с 100 мл 0,0001 И раствора серной кислоты в течение 15 минпри комнатной температуРе, после чего снова отфильтровывают нерастворившуюся в серной кислоте часть осадка,В сернокислотном экстракте (фильтрате)определяют содержание ионов тяжелыхметаллов методом атомно-адсорбционнойспектроскопии.За оптимальное соотношение массисходных соединений тяжелых металлови железного купороса, а также заполное окончание процесса ферритизации принимают те результаты, в которыхнайденное содержание ионов тяжелыхметаллов в сернокислотных экстрактахиз двух соседних проб твердой фазыреакционной массы не превышало0,001 мг/л,Смеси гидроксидов и основных карбонатов тяжелых металлов, не подвергавшиеся ферритизации, при обычнойкомнатной температуре за 15 мин полностью растворяются в избытке 0,0001 Исерной кислоты,Усредненные результаты серийныхопытов (по 10 опытов в каждой серии)представлены в табл. 1, 154992550 Как видно из данных табл, 1, с увеличением количества железного купороса (ЖК) на одно и то же количествосмеси соединений тяжелых. металлов(СТМ) при прочих равных условиях содержание ионов тяжелых металлов всернокислотном экстракте из твердойфазы реакционной массы убывает, Оптимальное соотношение масс СТМ:ЖК, прикотором содержание ионов тяжелых металлов в сернокислотных экстрактахминимально, находится в пределах 1;:(14-15) соответственно (см, табл. 1,опыты серий 13-16),15При использовании ЖК менее 14 мас. ч.на 1 мас,ч. смеси ГТМ или ОКТМ содержание ионов тяжелых металлов в сернокислотных экстрактах из твердой Фазыреакционной массы возрастает, чтосвидетельствует о неполном протекании процесса Ферритизации (см, опы ты 1-12), Использование ЖК более15 мас.ч, на 1 мас.ч. смеси ГТМ илиОКТМ к дальнейшему уменьшению содержания ионов тяжелых металлов в сернокислотных экстрактах не приводит, аобуславливает лишь неоправданный перерасход самого ЖК (см. опыты 17-18),В одинаковых условиях процессыФерритизации ГТМ и ОКТМ протекают сприблизительно одинаковой скоростью,о чем можно судить по близости количеств ионов тяжелых металлов, обнаруживаемых в сернокислотных экстрак 35тах из твердой фазы той и другой реакционной массы (ср, опыты четныхи нечетных номеров).При проведении процессов ферритизации ГТМ и ОКТМ в отсутствие катализатора и прочих равных условияхскорости этих процессов резко замедляютсяП р и м е р 2, Определение оптимальной величины рН среды процессаферритизации гидроксидов тяжелых металлов,Для проведения всех опытов используют осадок ГТМ с известным содержанием суммы сухих веществ. Ферритизацию смеси ГТМ проводят аналогичнопримеру 1, но с переменным значениемрН среды,Усредненные результаты опытовпредставлены в табл, 2,Как видно из табл. 2, оптимальная55величина рН среды, соответствующаядостижению минимального содержанияионов тяжелых металлов в сернокислотном экстракте из твердой фазы реакционной массы за одинаковый промежуток времени, находится в пределах 10 - 11 (см, табл, 2; опыты 3 и 4).При рН среды меньшей 10 и прочих равных условиях содержание ионов тяжелых металлов в сернокислотном экстракте существенно возрастает (см. табл,2, опыты 1 и 2), а при рН больше 11 остается без изменения (опыт 5),Способ осуществлен при соотношении масс ГТМ;И=1:15, количестве катализатора (ЕМпО) - 0,0023 от массы ЖК, температуре 95 С, интенсивности введения воздуха в реакционную смесь 5 л/мин и продолжительности процесса Ферритизации 0,5 ч.П р и м е р 3, Определение оптимального количества катализатора ферритизации гидроксидов тяжелых металлов.Серийные опыты ферритизации смеси ГТМ проводят по методике примера 1.Переменным параметром является количество катализатора, в качестве которого исполЬзуют перманганат калия или его смесь с диоксидом марганца;Усредненные результаты опытов представлены в табл, 3.Как видно из данных табл, 3, оптимальное количество перманганата калия, т,е, то его количество, при котором содержание ионов тяжелых металлов в сернокислотном экстракте из твердой фазы реакционной массы минимально, находится в пределах 0,001-0,002 Е от массы взятого в реакцию железного купороса (см, табл,3, опыты 3-5),Способ осуществлен при соотношении масс ГТМ:ЖК=1;15, рН среды 11, температуре 95 С, интенсивности введения воздуха в реакционную смесь 5 л/мин и продолжительности процесса Ферритизации 0,5 ч.При использовании перманганата калия в количестве меньше 0,001 Х от массы ЖК содержание ионов тяжелых металлов в сернокислотных экстрактах их твердой фазы реакционной массы резко возрастает, что свидетельствует о замедлении скорости процесса ферритизации и, следовательно, об увеличении энергоемкости этого процесса (см. табл. 3, опыт 2). Использование перманганата калия в количестве больше 0,002 Х от массы ЖК к дальнейшему заметному повышению скорости процесса ферритизации ГТМ не приводит, а обус 1549925 1 Олавливает лишь неоправданный перерасход катализатора (см. табл, 3, опыты 5 и 6).Из табл. 3 видно, что в отсутствиекатализатора (опыт 1) или в присутст 5вии одного только диоксида марганца(опыт 7) процесс Ферритиэации ГТМпротекает с приблизительно одинаковойскоростью, откуда следует, что диоксид марганца сам по себе на этот процесс каталитического действия не оказывает.Из табл. 3 видно, что перманганаткалия и его смеси с диоксидом марган-;15ца в молярных соотношениях 1: (1-5)соответственно в равных массовых количествах оказывают на процесс Ферритизации ГТМ приблизительно одинаковоекаталитическое действие (см. опыты 5и 8-10). При молярном соотношенииКМпО ;МпО =1:6 каталитическое действие меси уменьшается (см, опыт 11).Таким образом для катализа процесса Ферритизации ГТМ в концентрированных водно-щелочных суспензиях и восадке, образующемся при очистке сточных вод от ионов тяжелых металлов общеизвестным гидроксидным способом,вместо чистого перманганата калия мож но и целесообразно испольэовать егосмеси с более дешевым и доступнымдиоксидом марганца в молярном соотношении 1:(4-5).П р и м е р 4. Определение опти 35мальной температуры ферритизации смеси гидроксидов тяжелых металлов вконцентрированных водно-щелочных суспензиях и в осадке сточных вод.Для проведения опытов используютсмесь гидроксидов тяжелых металлов,выделенную из модельных сточных либонепосредственно осадок-отстой сточныхвод, полученный обработкой сточныхвод, В первом случае заданное количество смеси ГТМ суспендируют в растворе железного купороса а во второмслучае в пробе отстоя определяют суммарное содержание взвешенных веществ,после чего вводят в отстой заданноеколичество железного купороса. Про 50цесс ферритизации осуществляют по общей методике, описанной в примере 1.Переменным параметром во всех опытахявляется температура.Усредненные результаты опытовпредставлены в табл. 4,Способ осуществляют при соотношении масс ГТМ:ЖК=1: 15, количестве катализатора 0,0015% от массы ЖК, рН среды 11, интенсивности введения воздуха5 л/мин.Как видно из табл, 4, при 80 С(максимальная температура очисткисточных вод от ионов тяжелых металлов известными вариантами ферритногоспособа) полная ферритиэация смесигидроксидов тяжелых металлов в конусцентрированных водно-щелочных суспензиях не достигается даже эа 90 мин(см, табл, 4, опыты 1-3).Полная ферритизация смеси гидроксидов тяжелых металлов в концентриФрованных водно-щелочных суспензияхпредложенным способом достигаетсяпри 85 С за 60 мин (опыты 4-7), при900 за 45 минут (опыты 8-11), при95 С за 30 мин (опыты 12-15).Дальнейшее повышение температурыоФерритизации, например до 100 С, нецелесообразно, так как суммарная продолжительность процессов нагреваниясуспензий от 95 до 100 С и последуюоОщего охлаждения от 100 до 95 С дажев лабораторных условиях составляетне менее 7 мин.Из табл, 4 видно, что при одинаковой температуре и прочих равных условиях заметной разницы в продолжительности полной Ферритизации гидроксидов тяжелых металлов в концентрированных водно-щелочных суспенэиях (опыты 8-11) и в отстое сточных вод (опытты 16-19) не наблюдается. Отсюдаследует, что все закономерности процессов ферритизации гидроксидов и основных карбонатов тяжелых металлов,выявленные в предыдущих примерах,в полной мере распространяются и напроведение этих процессов в отстоях,образующихся при очистке сточных водот ионов тяжелых металлов,При использовании предлагаемогоспособа достигается полная ферритизация гидроксидов тяжелых металлов,образующихся при очистке сточных водот ионов тяжелых металлов известнымиспособами. Это обеспечивает возможность безопасного для окружающей среды захоронения получаемых при обработке отстоя осадков соединений тяжелых металлов в земных недрах беэстроительства специальных сооружений,а также высвобождение земельных площадей, необходимых для размещенияспециальных сооружений для захоронения осадков соединений тяжелых метал1549925 12 лов, выделяемых из сточных вод известными способами. стойкости осадка к вымыванию, переднагреванием вводят железный купоросв массовом отношении к гидроксидам(14-15):1, вводят щелочь до рН 10- 11,затем перманганат щелочного металлаили его смесь с диоксидом марганцав количестве 0,001-0,002% от массывведенного купороса, а затем нагрео,вают до 85-95 С.2. Способ по п. 1, о тлич ающ и й с я тем, что смесь перманганата щелочного металла и диоксида марганца используют в молярном соотношении 1:(4-5)Формула изобретения 1, Способ обработки гидроксидных оСадков, содержащих тяжелые металлы путем ферритизации, включающий нагревание в щелочной среде, при одновременном барботировании воздухом, охлаждение суспенэии и отделение кристаллического осадка от воды, о т л ич а ю щ и й с я тем, что, с целью ,повышения степени ферритизации и Таблица 1 оотношение Найденное содержание ионов в сернокислотных экстрактах изасс СТМ;ЖК, твердой фазы реакционной массы, мг/л Опыт ас. ч. 3+ э+А 1 Ре 0 в т+ц Хп 3,591 3,595 1,896 1,903 0,309 0,316 0,121 0,125 0,050 О, 055 0,009 0,010 0,001 0,001 0,001 О, 001 0,001 0,001 5,496 5,512 О, 001 О, 001 О, 001 О, 001 0,001 3,631 3, 634 1, 924 1, 930 0,345 0,350 0,129 0,136 0,059 О, 064 О, 013 О, 015 О, 001 О, 001 0 001 0,001 0,001 0,001 5,575 5,582 ОКТМГТМ,ОКТИ 6 7 8 ОКТМ,ГТМ,ОКТИ,ГТМ,ОКТИ юГТМ,ОКТИ,10 11 .12 13 14 ,15 16 17 ОКТМ,ГТМ,ОКТИ,ГТМ,ОКП 1,ГТИ,ОКТМ,92 ф 0 ГП 1 - гидроксилы, ОКТМ - основные Опыты 19 и 20 проведены без применрбонаты тяжелых металлов.ия катализатора. Т а б л и Опыт рН сре айденное соде вердой фазы р ание ионов в сернокислотных экстраккционной массы, мг/л А 1 Ре 0 в Си2 пС О, 356 О, 032 0,001 0,001 0,001 О, 009 О, 003 О, 001 О, 001 О, 001 0,007 О, 002 О, 001 0,001 0,001 О, 015 О, 008 0,001 .0,001 0,001 0,010 0,006 0,001 0,001 0,001 0,01 0,00 0,00 0,00 0,00 1:2 15 1:5 1;10 1:10 1:11 1:11 1:12 1:12 1:13 1 й 13 1:14 1:14 1:15 1:15 1:16 1:16 1:15 1:15 3, 622 3, 625 1, 914 1, 925 0,339 0,345 0,126 0,132О, 057 О, 062 О, 011 О, 012 0,001 0,001 0,001 0,001 0,0010,001 5,524 5,535 0,001 О, 001 О, 001 О, 001 О, 001 О, 001 О, 001 0,001 0,001 0,001 0,001 0,001 0,001 0,001 О, 001 О, 001 О, 001 О, 001 0,009 0,012 О, 001 0,001 0,001 0,001 0,001 0,001 0,001 0,0010,001 О, 001 0,001 О, 001 О, 012 О, 015 0 001 0,001 0,001 0,001 0,0010,001 О, 001 0,001 0,001 О, 001 0,001 0,001 0,001 0,001 0,001 0,001 9,324 9,9544 1549925 Т а блица Катализатор Найденное содержание ионов в сернокислотныхэкстрактах из твердой фазы реакционной массы,мг/л КоличестОпыт во катазатора, %от массыЖК С А 1 Ре М Сп Хп ,и, ь 7,126 0,036 0,002 0,001 0,001 0,001 7,118 7,223 0,039 О, 002 0 001 0,001 0,001 7, Г 22 О, 325 О, 005 О, 001 О, 001 О, 001 0,001.0,330 О, 001 О, 331 0,006 0,001 0,001 0,001 О, 001 О,ЗЗЬ 7,111 О, 032 О, 001 0,001 0,001 0,001 7,106 32,5262,014 0,009 0,001 .О, 001 О, 001 32,519 0,0005 0,0010 0,0015 0,0020 0,0025 0,0020 моль+мольмоль+молямоль+молямоль+моль О, 0020 О, 00". О, 001 О, 001 0,001 О, 001 0,001 0,001 0,001 0,329 0,0020 0,001 0,001 0,001 0,001 0,001 0,0020 0,001 0,001 0,001 0,001 0,001 0,0020 0,001 0,001 0,001 0,001 0,001 0,0020 0,007 О, 006 О, 008 О, 002 О, 003 моль+ молей А - перманганат калия,Б - диоксид марганца. Таб лица Температура,ОС Время,мин Найденное содержание ионов в сернокислотных экстрактах из твердой фазы реакционной массы, мг/л Опыт Ы 1 СиХп Продолжительность аэрирования реакционной массы до момента отбора пробы на анализ.Опыты 16-19 проведены с использованием отстоя сточных вод, а все стальные опыты - с использованием концентрированных водно-щелочных суспензий гидроксидов тяжелых. металлов. 1 2 А 3 А 4 А 5 А 6 А 7 Б 8 А, 1
СмотретьЗаявка
4385848, 25.01.1988
ВСЕСОЮЗНЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ПО ОХРАНЕ ВОД
ДЫХАНОВ НИКОЛАЙ НИКИФОРОВИЧ, КУРГАН ЕКАТЕРИНА ВЛАДИМИРОВНА
МПК / Метки
МПК: C02F 1/62, C02F 11/14
Метки: гидроксидных, металлы, осадков, содержащих, тяжелые
Опубликовано: 15.03.1990
Код ссылки
<a href="https://patents.su/7-1549925-sposob-obrabotki-gidroksidnykh-osadkov-soderzhashhikh-tyazhelye-metally.html" target="_blank" rel="follow" title="База патентов СССР">Способ обработки гидроксидных осадков, содержащих тяжелые металлы</a>
Предыдущий патент: Способ определения аденозинтрифосфата в мозге экспериментальных животных
Следующий патент: Способ очистки сточных вод анилинокрасочного производства от органических соединений
Случайный патент: Электрический выключатель